Практическая работа 1 Связь между свойствами сплава и типом диаграммы состояния
 Скачать 2.4 Mb. Скачать 2.4 Mb.
|
|
Практическая работа № 1 «Связь между свойствами сплава и типом диаграммы состояния» Цель работы - ознакомиться с методикой построения диаграмм состояния двухкомпонентных сплавов, изучить изменение свойств сплавов в зависимости от изменения концентрации их компонентов для основных типов диаграмм состояния. Задачи: 1. Изучить теоретические сведения о строении металлических сплавов. 2. Усвоить методику экспериментального построения диаграмм состояния двухкомпонентных сплавов. 3. Научиться практическому использованию правила фаз и правила отрезков. 4. Изучить связь между свойствами сплавов и типом диаграмм состояния. Задание 1 1. Дать определение каждого типа диаграмм состояния. 2. Вычертить схемы четырех типов диаграмм состояния и построить графики изменения свойств сплавов в зависимости от их состава. 3. Охарактеризовать линии, точки и области диаграмм состояния указанных типов. 4. Для всех диаграмм состояния (по заданию) построить кривую охлаждения сплава и определить при конкретной температуре концентрацию и количество фаз сплава, пользуясь правилом фаз и правилом отрезков. 5. Используя полученные данные описать изменение механических, физико-химических и технологических свойств сплавов в зависимости от изменения концентрации компонентов.
1) Диаграмма состояния 1 рода Сплав Sn-Zn образует механическую смесь. В жидком состоянии Sn и Zn неограниченно растворимы, а в твердом состоянии нерастворимы и не образуют химических соединений. Линия АСВ – ликвидус (начало кристаллизации), линия ECD – солидус (конец кристаллизации). При охлаждении сплава в точке 1 начинают выделяться кристаллы Zn; на участке 1-2 количество кристаллов цинка увеличивается, а количество жидкого сплава уменьшается. На участке 2-3 охлаждение твердого металла. 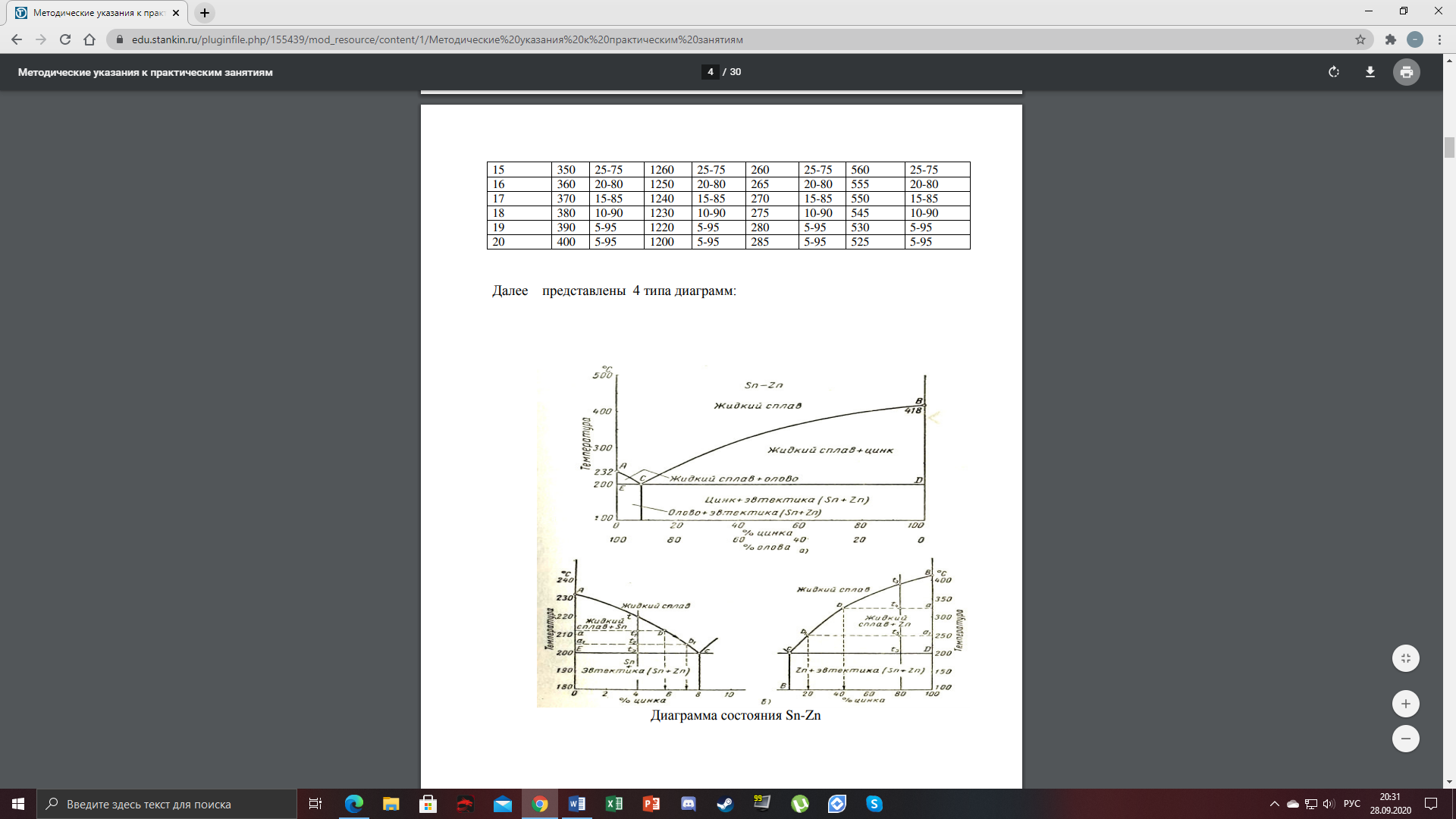 Точка (I) характеризует сплав с содержанием 25% Sn и 60% Zn при 3500С. Сплав (I) является заэвтектойдным и состоит при 3500С из двух фаз: жидкий сплав (Sn и Zn) и твердые кристаллы Zn. После полного охлаждения сплав будет содержать две фазы: Zn и эвтектику (Sn+Zn). В точке (I) сплав содержит жидкий сплав (Sn+Zn) и твердые кристаллы Zn. При этом по правилу отрезков: 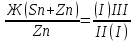 По диаграмме 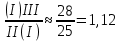 Количество Ж (Sn и Zn) 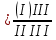 = =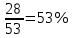 Количество Zn  = =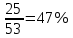 Физические свойства цинка. Цинк — металл средней твёрдости. В холодном состоянии хрупок, а при 100—150 °С весьма пластичен и легко прокатывается в листы и фольгу толщиной около сотых долей миллиметра. При 250 °С вновь становится хрупким. Полиморфных модификаций не имеет. Кристаллизуется в гексагональной решетке. Плотность твёрдого Цинка 7,133 г/см3(20 °С), жидкого 6,66 г/см3 (419,5 °С); tпл = 419,5 °С; tкип = 906 °С. Температурный коэффициент линейного расширения 39,7×10-6 (20—250 °С), коэффициент теплопроводности 110,950 вт/(м×К) 0,265 кал/см×сек×°С (20 °С), удельное электросопротивление 5,9×10-6 ом×см (20 °С), удельная теплоёмкость Ц. 25,433 кдж/(кг×К) [6,07 кал/г×оС)]. Предел прочности при растяжении 200—250 Мн/м2 (2000—2500 кгс/см2), относительное удлинение 40—50%, твёрдость по Бринеллю 400—500 Мн/м2 (4000—5000 кгс/см2). Ц. диамагнитен, его удельная магнитная восприимчивость — 0,175×10-6. Химические свойства цинка. Цинк активный металл и энергичный восстановитель. На воздухе при температуре до 100 °С Ц. быстро тускнеет, покрываясь поверхностной плёнкой основных карбонатов. Во влажном воздухе, особенно в присутствии СО2, происходит разрушение металла даже при обычных температурах. Физические свойства олова. Олово имеет две полиморфные модификации. Кристаллическая решётка обычного b-Sn (белое Олово) тетрагональная; плотность 7,29 г/см3. При температурах ниже 13,2 °С устойчиво a-Sn (серое Олово) кубической структуры типа алмаза; плотность 5,85 г/см3. Переход b ® a сопровождается превращением металла в порошок, tпл = 231,9 °С, tkип = 2270 °С. Температурный коэффициент линейного расширения 23·10–6 (0—100 °С); удельная теплоёмкость (0°С) 0,225 кдж/(кг·К), т. е. 0,0536 кал/(г·°С); теплопроводность (0 °С) 65,8 вт/(м·К), т. е. 0,157 кал/(см·-сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10–6 ом·м, т. е. 11,5·10–6 ом ·см.Предел прочности при растяжении 16,6 Мн/м2 (1,7 кгс/мм2)', относительное удлинение 80—90%; твёрдость по Бринеллю 38,3—41,2 Мн/м2 (3,9—4,2 кгс/мм2). Химические свойства олова. В соответствии с конфигурацией внешних электронов атома 5s25p2 О. имеет две степени окисления: +2 и +4; последняя более устойчива; соединения Sn (II) — сильные восстановители. Сухим и влажным воздухом при температуре до 100 °С О. практически не окисляется: его предохраняет тонкая, прочная и плотная плёнка SnO2. По отношению к холодной и кипящей воде О. устойчиво. 2) Диаграмма состояния 2 рода Компоненты Cu-Ni неограниченно растворимы в жидком состоянии и не образуют химических соединений. Точка (V) характеризует сплав с 25% Cu и 75% Ni при 1260 0С, который состоит из жидкого и твердого раствора Cu-Ni. 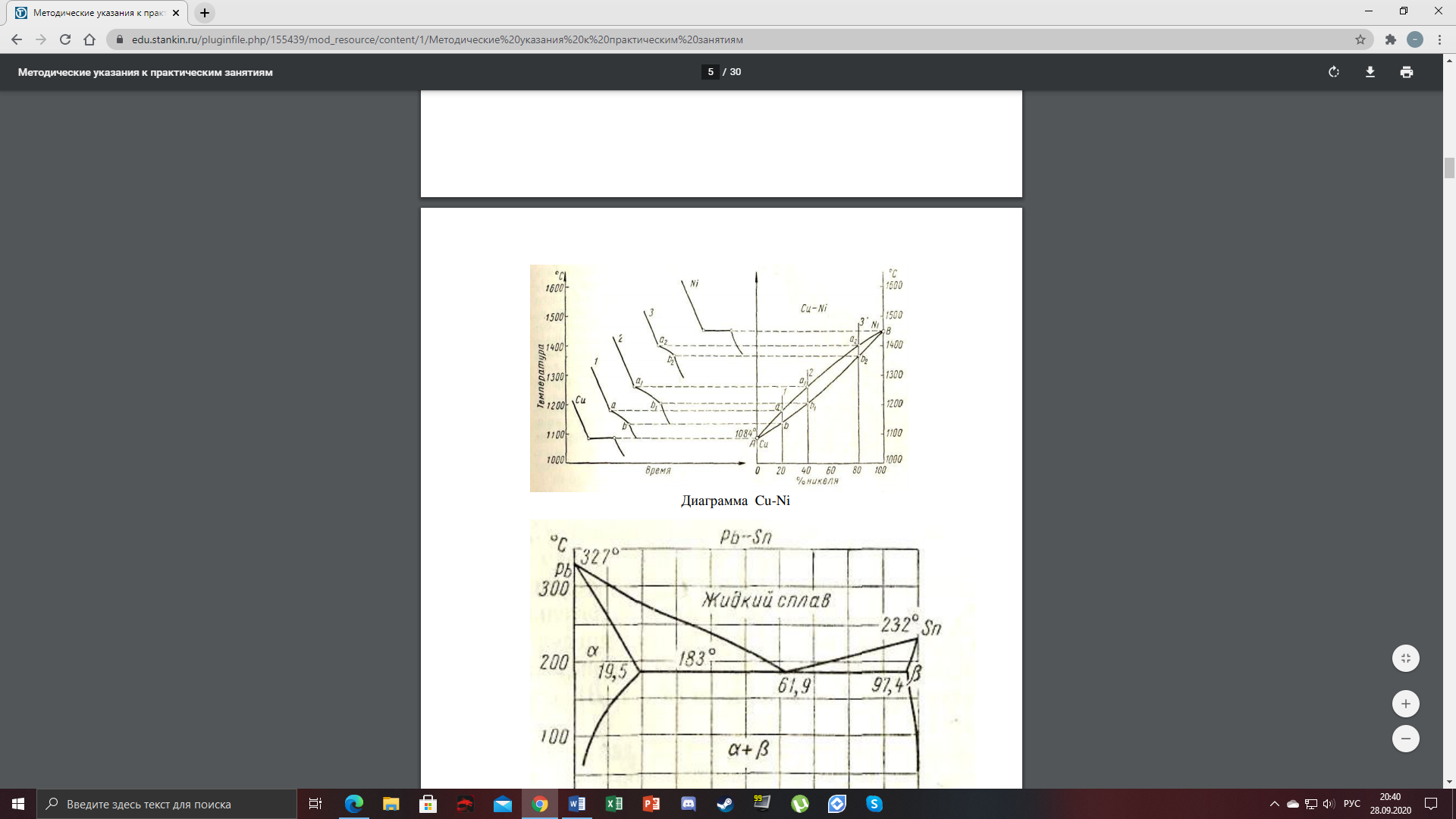 Линия А1В – ликвидус (начало кристаллизации), линия В2А – солидус (конец кристаллизации). Между точками 1 и 2 сплав находится в двухфазном состоянии. В процессе кристаллизации изменяется концентрация фаз. В точке V сплав находится в твердом состоянии. К медно-никелевым сплавам относятся сплавы на основе меди, в которых основным легирующим элементом является никель. Легирование меди никелем значительно повышает ее механические свойства, коррозионную стойкость, термоэлектрические характеристики. Промышленные медно-никелевые сплавы можно условно разделить на две группы: конструкционные и электротехнические. К первой группе относятся коррозионно-стойкие и высокопрочные сплавы типа мельхиор, нейзильбер и куниаль. В качестве дополнительных легирующих элементов в них добавляют марганец, алюминий, цинк, железо, кобальт, свинец, а также хром, церий, магний, литий. Мельхиоры имеют высокую коррозионную стойкость в различных средах - в пресной и морской воде, в органических кислотах, растворах солей, в атмосферных условиях. Добавки железа и марганца увеличивают стойкость медно-никелевых сплавов против ударной коррозии. Являясь твердыми растворами, мельхиоры обрабатываются давлением в горячем и холодном состоянии. Сплавы на основе меди, в которых основными легирующими компонентами являются никель и цинк, называются нейзильберами. Они представляют собой твердые растворы на основе меди. Легирование цинком приводит к повышению механических свойств медно-никелевых сплавов и приданию им красивого серебристого цвета и удешевлению. Нейзильберы отличаются высокой коррозионной стойкостью: не окисляются на воздухе, сравнительно устойчивы в органических кислотах и растворах солей. Нейзильберы обрабатываются давлением в горячем (за исключением свинцовистого нейзильбера) и в холодном состоянии. Небольшое количество свинца вводится для улучшения обработки резанием. 3) Диаграмма состояния 3 рода Сплав Pb-Sn с неограниченной растворимостью в жидком состоянии, с ограниченной растворимостью в твердом состоянии и не образующие химических соединений. Компоненты Pb и Sn, фазы: жидкая (Pb+Sn), твердый раствор Pb в Sn и твердый раствор Sn в Pb. 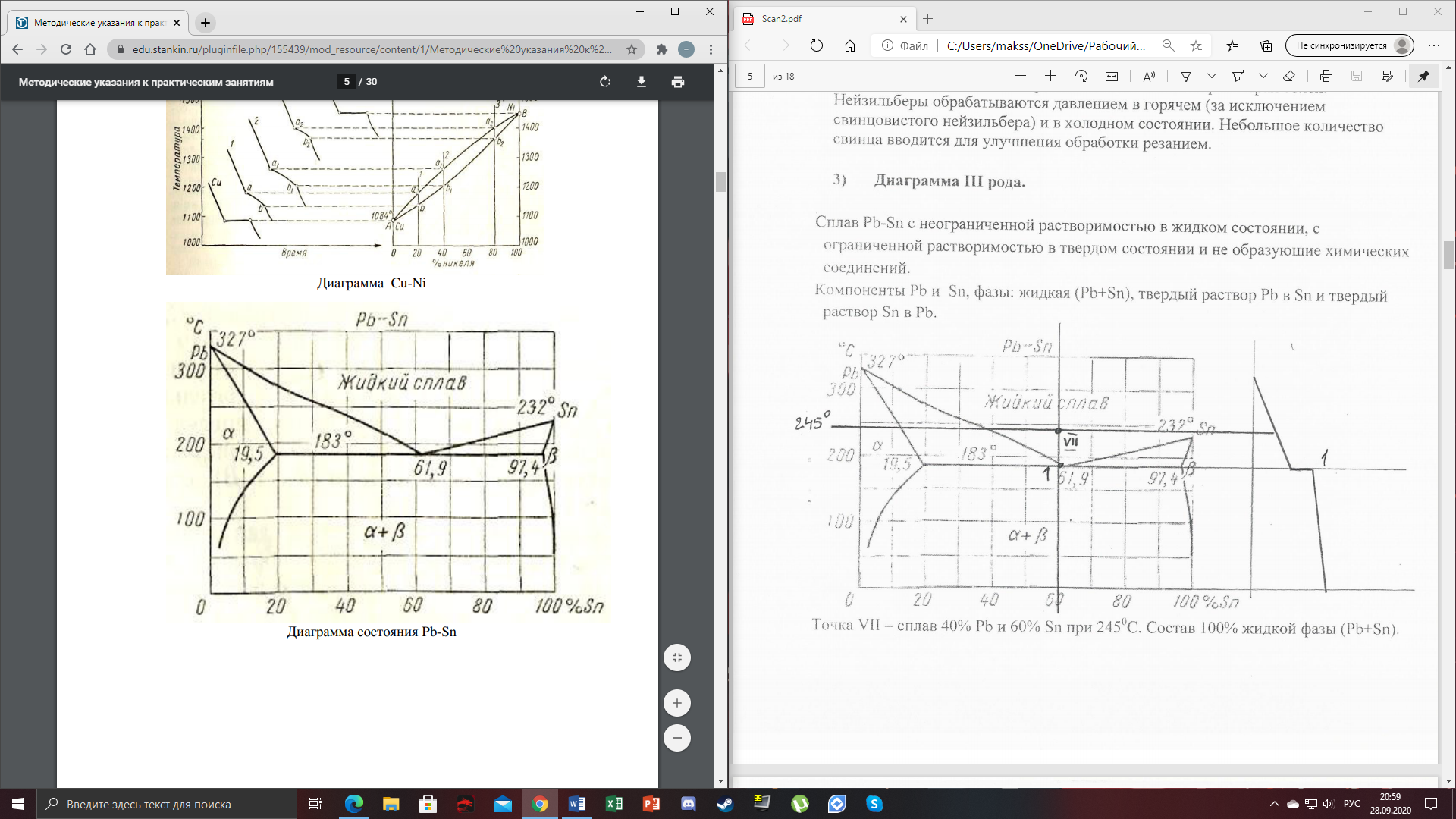 Точка VII – сплав 25% Pb и 75% Sn при 260 0С. Состав 100% жидкой фазы (Pb+Sn). При охлаждении сплава в точке 1 наступает эвтектическая реакция. Из жидкости выделяются кристаллы обоих твердых растворов. 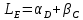 L – жидкая фаза, 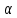 - твердый раствор компонента Sn в компоненте Pb. - твердый раствор компонента Sn в компоненте Pb.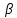 – твердый раствор компонента Pb в компоненте Sn. – твердый раствор компонента Pb в компоненте Sn.В результате кристаллизации образуется еще эвтектика α+β. 4) Диаграмма состояния 4 рода 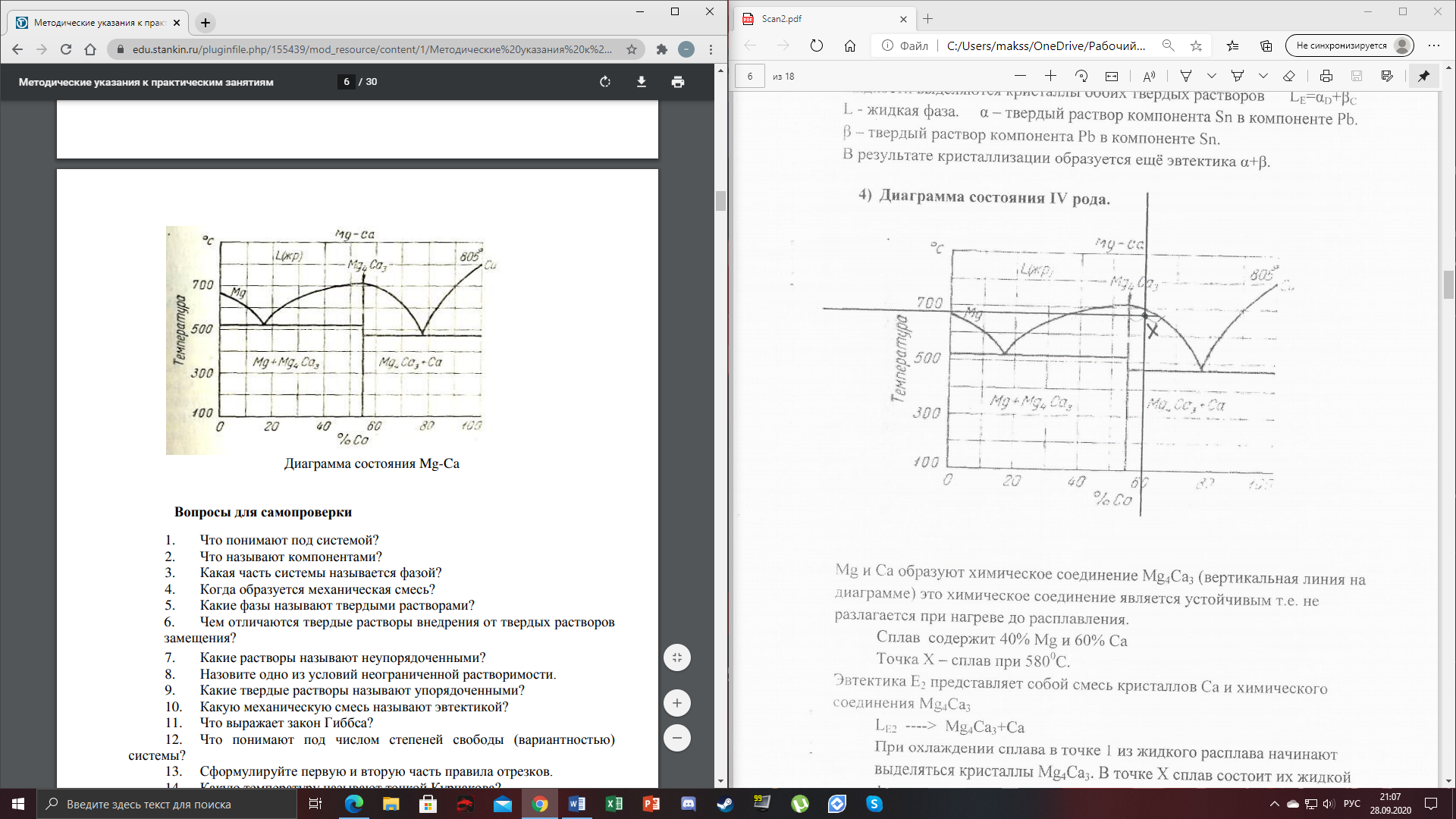 Mg и Ca образуют химическое соединение Mg4Ca3 (вертикальная линия на диаграмме) – это химическое соединение является устойчивым, т.е. не разлагается при нагреве до расплавления. Сплав содержит 25% Mg и 75% Са Точка Х – сплав при 560 0С. Эвтектика Е2 представляет собой смесь кристаллов Са и химического соединения Mg4Ca3 LE2 → Mg4Ca3 + Ca Сплав находится в состоянии равновесия. | ||||||||||||||||||||||||||
