пз. Практическая работа 1 Тема Введение в курс патологической физиологии. Техника безопасности при работе с животными. Подготовка животных к эксперименту и способы введения лекарственных веществ Цель занятия
 Скачать 361.12 Kb. Скачать 361.12 Kb.
|
|
Практическая работа №1 Тема:Введение в курс патологической физиологии. Техника безопасности при работе с животными. Подготовка животных к эксперименту и способы введения лекарственных веществ Цель занятия. Дать общее представление о патологической физиологии, ее значении в подготовке ветеринарного врача. Научить основным принципам подготовки подопытных животных к эксперименту, элементам ведения опыта и обработке полученных данных. Задание 1. Отработать методику введения различных препаратов подопытным животным. Оснащение: шприцы с иглами; клетки для кроликов; станки для собак; клетки для крыс; клетки для мышей; изогнутые ножницы; зонды пищеводные для кролика; сосуд Дьюара на 200 мл; 0,65%-ный раствор натрия хлорида (300 мл); 0,9%-ный раствор натрия хлорида (500 мл); 70%-ный раствор этилового спирта (100 мл); подопытные животные: лягушки, крысы, мыши, кролики, куры, собаки. Постановка опыта:Лягушке подкожно инъецируют жидкость в спинной лимфатический мешок. Для этого лягушку до головы обматывают марлевой салфеткой, берут ее в левую руку, в правой держат шприц, и, вкалывая иглу под кожу головы лягушки в каудальном направлении, вводят 0,5 мл изотонического раствора натрия хлорида. Кролику для моделирования патологических процессов инъецируют различные растворы в краевую вену уха. Выстригают шерсть с наружной поверхности уха над кровеносным сосудом. Ваткой, смоченной 70%-ным раствором этилового спирта, протирают кожу. Находят вену и прижимают ее двумя пальцами ниже места инъекции. Вена набухает, увеличивается в размере, становится рельефной, хорошо заметной. Шприц с 1 мл физиологического раствора держат в правой руке (рис. 1), предварительно удалив все пузырьки воздуха. Короткую тонкую иголку держат срезом вверх, наклоняют к поверхности кожи и отрывистым движением прокалывают ее рядом с веной. Ставят иглу полого и, пользуясь подвижностью кожи, направляют ее острие в сосуд, осторожно прокалывая его переднюю стенку (не прокалывая задней). Если игла попала в крупную вену, то при слабом оттягивании поршня в содержимое шприца вливается струйка крови. Прекращают сжимать вену и, медленно продвигая поршень шприца, вводят раствор в сосуд. Рис.1. Инъекция в краевую вену уха кролика 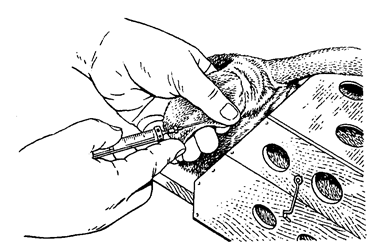 Подкожно препараты инъецируют мышам в области спины, кроликам в область лопатки, внутримышечно – в мышцы бедра. Для принудительного введения жидкости в желудок кролику поступают следующим образом (рис. 2). Из мягкой резины вырезают зевник такого размера, чтобы он мог поместиться между коренными зубами. В центре его делают отверстие, к концам прикрепляют тесемки (2). Зевник вставляют в рот, тесемки завязывают за ушами. Зевник можно также изготовить из деревянной катушки для ниток. В отверстие зевника вводят резиновый зонд (1), слегка смазанный вазелином. Для заливки животному определенного количества жидкости заданной температуры используют сосуд Дьюара (4) и резиновые шары от пульверизатора. В горло сосуда вставляют пробку, через которую проходят две стеклянные трубки. Одна соединена с зондом через переходный кран (3), а другая с резиновыми шарами (5). Наряду с сосудом Дьюара, в зависимости от объема вливаемой жидкости можно использовать шприц Жене или обычный шприц, наконечник которого соединяют с зондом. Рис.2. Схема введения жидкости кролику через пищеводный зонд: 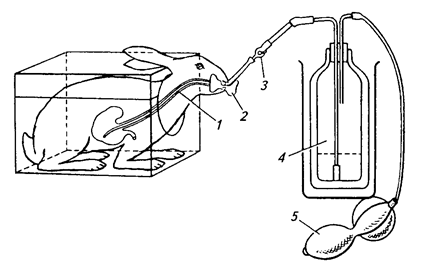 1 – резиновый пищеводный зонд; 2 – резиновый зевник; 3 — переходный кран; 4 – сосуд Дьюара; 5 – резиновые шары для нагнетания воздуха В сосуд наливают воду (50 мл), подогретую до температуры 40°С, повышают давление, открывают переходный кран, и жидкость быстро перемещается из резервуара в желудок кролика. В толстый кишечник препараты вводят ректально. Наконечник спринцовки, смазанный вазелином, вставляют в прямую кишку и вливают 20-30 мл теплой жидкости. Собаке внутривенные инъекции делают через малую подкожную вену бедра, на ограниченном отрезке, пересекающим сзади и сверху, вперед и вниз латеральную поверхность скакательного сустава. В месте расположения сосуда с кожи состригают волосы, ее поверхность смазывают 5%-ным спиртовым раствором йода, на бедро накладывают резиновый жгут. Если собака небольшая, то центральный конец вены один из студентов прижимает пальцами (рис. 3). Иглу вкалывают в расширенную, набухшую вену по направлению к сердцу, и после снятия жгута, убедившись, что игла находится в просвете сосуда, в него медленно вводят содержимое шприца. Белым крысам и мышам инъекции различных препаратов в кровь осуществляют через хвостовую вену. Животное помещают в плексигласовую клеточку; для расширения хвост опускают на 2-3 мин в теплую (40°С) воду, высушивают его марлевой салфеткой и обтирают 70%-ным раствором этилового спирта. Придерживая кончик хвоста левой рукой, в правую берут шприц, наполненный физраствором (рис. 4). Тонкой иглой сначала прокалывают кожу на латеральной поверхности хвоста, а затем стенку сосуда. При попадании иглы в просвет вены в шприце появляется кровь, и при движении поршня затем ощущается свободный ток жидкости.  Крысам, мышам и морским свинкам делают также подкожные и внутрибрюшинные инъекции, для чего предварительно удаляют волосы с места укола и протирают его 70%-ным растворам этилового спирта. Местом для внутривенного введения препаратов у птиц (кур) служит подкрыльцовая вена. Удерживая птицу в руках, на внутренней поверхности крыла находят сосуд и в этом месте выщипывают несколько перьев. Кожу протирают дезинфицирующим раствором. Левой рукой в области локтевого сустава прижимают центральный конец сосуда, а в периферический, проколов кожу, вводят инъекционную иглу по направлению к сердцу. Убедитесь в том, что игла в сосуде, прекращают его сдавливание и, нажимая на поршень, вводят содержимое шприца в вену. Для предупреждения развития гематомы кровеносный сосуд в месте укола прижимают пальцами в течение 2-3 мин. Рис.4. Инъекция в хвостовую вену крысы Лошадям, крупному и мелкому рогатому скоту используемые препараты вводят в основном в яремную вену. В верхней части средней трети шеи по ходу яремного желоба выстригают шерсть. Кожу смазывают 5%-ным спиртовым раствором йода. Ниже места инъекции сдавливают вену большим пальцем левой руки (а) или жгутом (б) (рис.5).  Рис.5. Инъекция в яремную вену лошади: А – пережатие сосуда пальцем; б – пережатие сосуда жгутом  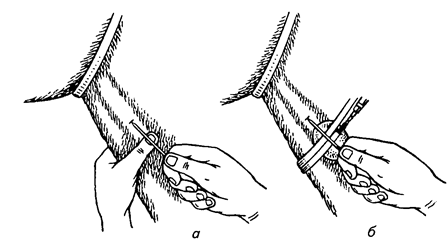 Крупным животным препараты вводят подкожно в те места, где хорошо развита подкожная клетчатка, но мало нервов и крупных кровеносных сосудов: боковая поверхность груди, за лопатками, задняя часть шеи (выше яремного желоба), наружная поверхность бедра. В месте, выбранном для инъекции, выстригают шерсть, кожу смазывают 5%-ным спиртовым раствором йода. В стерильный или одноразовый шприц набирают нужную жидкостью. Оттягивают левой рукой кожную складку и продольно к ее основанию под углом 45° вкалывают иглу, инъецируют содержимое шприца. Место укола вновь смазывают раствором йода. Свиньям растворы препаратов вводят в кровь через большую ушную вену. Перед инъекцией кожу уха протирают влажной салфеткой или ватой, затем 70%-ным раствором этилового спирта. Основание уха сдавливают резиновым жгутиком или прижимают вену пальцами. Иглу вкалывают по направлению к голове (рис. 6). Подкожные инъекции делают в области основания ушной раковины, внутримышечные – в области наружной поверхности бедра. Наркотизирование и фиксация подопытных животных Оснащение:шприцы с иглами, препаровальные иглы, операционные столики для лабораторных животных, пробковые дощечки, булавки, 20%-ный раствор уретана (30 мл), 70%-ный раствор этилового спирта (100 мл), подопытные животные лягушки, крысы, кролики. Постановка опыта. Подавляющее число оперативных вмешательств, связанных с подготовкой, а частично и с проведением патофизиологических экспериментов, осуществляют на наркотизированных животных. Кроме инъецируемых наркотических средств нередко применяют ингаляционные (вдыхаемые) наркотики; в этих случаях наиболее часто употребляют эфир. Кошек, крыс, мышей помещают в закрытые емкости: ящик (кошек), стеклянный колпак или большую воронку (рис.7), для морских свинок, крыс и мышей, куда кладут вату, смоченную эфиром для наркоза.  Рис.7. Наркотизирование мыши эфиром Для собак и кроликов готовят ингаляционные маски. О глубине наркоза судят по поведению животных. Для наркоза лягушек чаще используют 10%-ный раствор этилового спирта. Этих животных можно затем обездвижить, разрушая, головной (спинальная лягушка) или спинной мозг. Лягушку плотно заворачивают в марлевую салфетку, двумя пальцами левой руки (мизинцем и безымянным) слегка прижимают вытянутые задние лапки, но сильно не сдавливают. Затем средним и большим пальцами подпирают голову лягушки с боков, а указательным слегка наклоняют ее вниз (рис. 8, а). При правильном положении пальцев хорошо обозначается субокципитальное отверстие между затылочной костью и первым позвонком. Не отпуская пальцев левой руки, через отверстие в череп вводят препаровальную иглу и, поворачивая ее в разные стороны, разрушают головной мозг (рис. 8, б). Для разрушения спинного мозга иглу поворачивают на 180 и вводят в позвоночный канал. К опытам приступают спустя 10-15 мин. 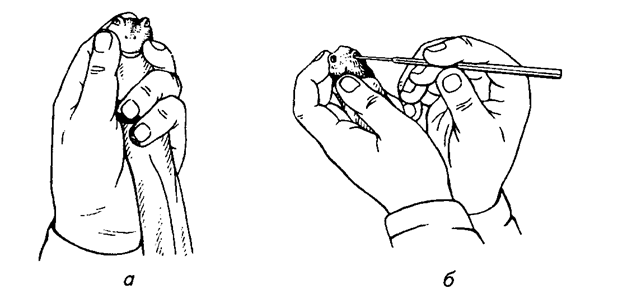 Рис.8. Фиксация лягушки (а) и разрушение головного мозга (б) Лягушек наркотизируют одним из следующих способов: Погружением на 5-8 мин в 10%-ный раствор этилового спирта; Ингаляцией паров эфира под стеклянной воронкой; Инъекцией в спинной лимфатический мешок одного из растворов: 5%-ного раствора хлоралгидрата (1,5-2 мл), 1%-ного раствора гексенала (0,5 мл), 10% — ного раствора уретана (1-1,5 мл), 25%-ного раствора этанола (2 мл). Во время патофизиологических экспериментов нередко нужно ограничить двигательную способность животных. Фиксируют животных, находящихся под наркозом, а также бодрствующих. Лягушек для визуального наблюдения помещают под стеклянную воронку или колпак. Наркотизированную или спинальную лягушку укрепляют на пробковой (пенопластовой) дощечке, прикалывая конечности булавками (рис. 9). Морских свинок, мышей и крыс наблюдают в террариумах, под стеклянными колпаками или воронками. Для более жесткой иммобилизации используют клеточки из плексигласа с дырчатыми стенками. Наркотизированных мелких лабораторных животных фиксируют на специальном операционном столике (рис.10). Выдвижное (1) и шарнирное (2) устройства позволяют менять высоту и угол наклона доски стола. Четыре движущихся в пазах зажима (3) служат для привязывания конечностей с помощью марлевых тесемок. Набор держателей (4) обеспечивает фиксацию головы подопытного животного.  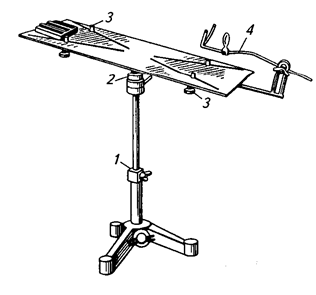
Более крупных лабораторных животных (кроликов и кошек) в состоянии наркоза фиксируют спиной вниз или вверх на специальных операционных столиках размером 75×17 см (рис. 11). Конечности привязывают марлевыми бинтами; для фиксации головы используют головодержатель. 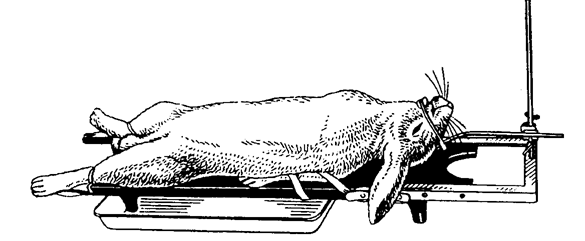 Рис.11. Фиксация кролика на операционном столе Кроликов и кошек, находящихся без наркоза, удобно помещать в решетчатые деревянные клетки (рис. 12). Длинна клетки 30 см, высота 18 см, ширина 15 см. В центре передней стенки проделано овальное отверстие, позволяющее вывести голову кролика (кошки) за пределы клетки. Дно имеет несколько продольных вырезов для удаления мочи и фекальных масс, выделяющихся во время опыта, поэтому клетку располагают на эмалированной кювете соответствующего размера. Верхняя треть клетки представляет собой откидывающуюся крышку. Кролика (кошку) сажают в клетку, голову животного выводят наружу через отверстие в передней стенке, клетку закрывают. Рис.12. Клетка для фиксации кролика 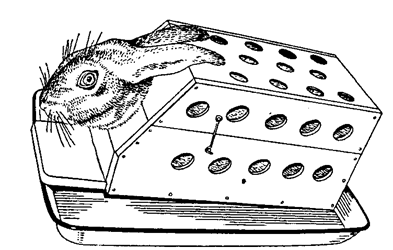 Собакам надевают намордник или накладывают повязку, удерживающую челюсти в сомкнутом состоянии. Середину повязки размещают на гребне носа, а концы крепко завязывают под нижней челюстью. На затылке связывают оставшиеся части тесьмы (бинта) (рис. 13). Рис.13. Фиксация челюсти собаки 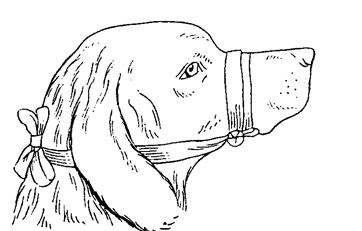 Интактных, ненаркотизированных собак на время опыта в павловский станок, надев лямки на передние и задние лапы. Собак, находящихся в состоянии наркоза, фиксируют на металлическом или древесном, покрытом белой масляной краской пологом операционном столе с вогнутой крышкой и четырьмя прикрепленными по краям скобами для привязывания лямок. Такой стол можно сделать в любой столярной мастерской. Собаку привязывают к поверхности стола лямками (тесьма, бинт), которыми крепят передние и задние конечности. Голову крепят специальным держателем. Овцу и свинью на период опыта можно поместить в Павловский станок, но лучше в деревянную или сваренную из металлических полос клетку, соответствующую размерам животного с входной и выходной дверцами. Наркотизированных овец и свиней для проведения операций или вивисекционных опытов фиксируют таким же образом, как и собак на вышеописанном операционном столе. Лошадям на время проведения болезнетворных манипуляций (инъекции, взятие крови и пр.) на верхнюю губу накладывают закрутку. Корове и быку сдавливают носовую перегородку большим и указательным пальцами. Для этого студент, стоящий сбоку от головы животного, захватывает рукой ближайший рог и поворачивает голову животного, а другой рукой сдавливает носовую перегородку. При более продолжительных и болезненных процедурах носовую перегородку сдавливают специальными носовыми щипцами. При необходимости ограничений крупных животных в движениях, например при исследовании дыхания или сердечной деятельности, пользуются станками, в условиях хозяйств – стойлами. Кур для иммобилизации помещают в решетчатую металлическую клетку (рис. 14). Голова, шея и хвост птицы выведены наружу через овальные отверстия в задней и передней стенках. Фекальные массы поступают в кювету.  Рис.14. Клетка для фиксации кур Практическая работа № 2. Тема. Техника безопасности при работе с приборами, трупным материалом. Меры личной гигиены. Цель.Усвоить правила работы с химическими веществами, электроприборами, хирургическими инструментами, микроскопом, санным и замораживающим микротомом, трупами и боенскими конфискатами. Содержание занятия.Инструкция по технике безопасности для сотрудников и студентов кафедры микробиологии, вирусологии и патанатомии ФГОУ ВПО «ДонГАУ». Вскрытие трупа животного. 1.Техника безопасности при работе с химическими веществами 1. При работе с кислотами, щелочами, эфиром, хлороформом, ксилолом, дезинфицирующими средствами и другими химическими веществами необходимо соблюдать осторожность: не разливать, не нюхать из флаконов и других ёмкостей. Хранить их необходимо в отдельной комнате под замком, не допуская испарения. Своевременно вести учет расхода химических веществ в специальном журнале. 2. Если ртуть пролилась из термометра или других приборов, то её необходимо тщательно собрать всю во флакон вплоть до мельчайших капелек. 3. При попадании кислот, щелочей и т. п. на открытые части тела необходимо быстро и аккуратно смыть их нейтрализующие средством или тщательно промыть проточной водой. 4. При приготовлении растворов кислот их следует добавлять небольшими порциями к воде, а не наоборот. 5.Флаконы с испаряющимися веществами должны быть герметически закрыты. Помещения, где они хранятся или используются, Должны быть оборудованы вентиляцией или регулярно проветриваться. 6. Приготовление растворов, проведение реакций с легко испаряющимися веществами разрешается в вытяжных шкафах или в хорошо вентилируемых помещениях. 2.Техника безопасности при работе с электроприборами 1. Включение в сеть термостатов, дистилляторов, приборов, для точки микротомных ножей, диапроекторов, центрифуг и других электроприборов проводить только сухими руками и после заземления. 2. Не прикасаться к оголенным проводам, открытым электроблокам, деталям и т. п. 3.Не проводить ремонт включенных в электросеть приборов. 4. Не включать без надобности электроприборы. 5. Использование автоклава разрешается только после его техосмотра, проверки манометра и соответствующего разрешения госнадзора стандартизации. Техника безопасности при работе с хирургическими инструментами 1. Необходимо быть предельно внимательным при работе с хирургическими инструментами, так как при неосторожном с ними обращении (резкий поворот со скальпелем в руках, шприцем, ножницами, препаровальной иглой и др.) можно пораниться самому и травмировать находящихся рядом. 2. Ножи, скальпели держать таким образом, чтобы ладонь лежала поверх рукоятки. 3. Разрезы делать только по направлению к себе или слева направо. 4. При вскрытии трупов не оставлять инструменты в полостях, не втыкать их в ткани. 5. Не работать вдвоём на одной стороне трупа. 3.Техника безопасности при работе с микроскопом 1. При изучении препаратов под микроскопом необходимо снимать очки. 2.Не делать резких поворотов головой вблизи тубуса микроскопа, чтобы не повредить глаза, лицо. 3. Чтобы не травмировать пальцы, предметные стекла (гистосрезы) Орать за торцовую часть (ребро). 4. Чтобы не раздавить стекло гистосреза, объектив следует опускать под контролем зрения. 5. Не использовать зеркало для наведения «солнечных зайчиков», а после работы зеркало поворачивать так, чтобы в нем не отражалось солнце. 6.Переносить микроскоп надо так, чтобы одна рука снизу поддерживала ножку (башмак), а другая удерживала тубусодержатель. 4.Техника безопасности при работе на санном и замораживающем микротомах 1.Извлекать, переносить и вставлять в зажим микротомный нож (бритву) следует, прочно удерживая его за спинку. Необходимо соблюдать при этом большую осторожность, чтобы нож не выскользнул из рук. 2.При работе на микротоме не допускать резких движений ножа вперед и при отведении назад. 3.Следует соблюдать особую осторожность движений рук при перемещении ножа в направлении «к себе», «от себя», снятии гистосреза. 4.После снятия гистосреза аккуратно под контролем глаз отодвигать зажим бритвы с укрепленным в нем ножом в крайнее от себя положение, удерживая за ручку зажима. 5.Спиртовку, планшет со стеклами, карандаши по стеклу, препаровальную иглу, волу и другие необходимые для работы принадлежности располагать слева от микротома. 6. Банку с раствором (спирт-эфир) для обезжиривания стекол устанавливать вдали от горящей спиртовки и других источников открытого огня. 7. Предметные и покровные стекла мыть, просушивать, натирать белком осторожно, не допуская соскальзывания пальцев на реберную поверхность стекла. 8. При перемещении баллонов с углекислотой не допускать их падения, резких изменений положения, не стучать по ним металлическими предметами, не устанавливать вблизи нагревательных приборов. Переносить баллоны следует, удерживая за корпус, а не за вентиль. Каждый баллон необходимо регулярно подвергать техосмотру и клеймению на предмет пригодности к дальнейшему использованию, аккуратно проводить подключение заряженного баллона к микротому. 5.Техника безопасности при работе с трупами 1. Прием трупов проводить только при наличии сопроводительного документа (направления). При этом необходимо выяснить полный анамнез на павшее животное и эпизоотическое состояние хозяйства. 2. При подозрении на сибирскую язву провести лабораторное исследование мазков крови, взятой из уха. 3. При гибели животного от сибирской язвы снятие шкуры и вскрытие трупа не проводить. Также запрещается снимать шкуру при гибели от брадзота и энтеротоксемии овец, ботулизма, бешенства, злокачественного отека, эпизоотического лимфангоита лошадей, мелиоидоза (ложного сапа), оспы овец, коз, свиней, сапа лошадей, чумы крупного рогатого скота, свиней и верблюдов, эмфизематозного карбункула крупного рогатого скота, туляремии. 4. При вскрытии трупов животных не допускать посторонних лиц. 5. Работать с трупным материалом следует в соответствующей спецодежде (халат, фартук, нарукавники, перчатки, при вскрытии крупных трупов сапоги резиновые). При вскрытии трупов животных, павших от особо опасных инфекционных болезней, необходимо пользоваться защитными очками и марлевой (в несколько слоев) повязкой. В летнее время на голову, а зимой на головной убор следует надевать полотняную шапочку (косынку). 6. Студенты и др. лица, присутствующие при вскрытии трупов животных, должны быть в халатах, колпачках (косынках). 7. Вскрытие проводится в перчатках. При отсутствии последних подногтевые пространства и венчики пальцев смазать раствором йода, затем для защиты кожи от мацерации покрыть руки вазелином или жиром. 8. Для защиты от насекомых летом руки, шею, лицо надо смазать диметилфталаном, пастой «Тайга» или др. отпугивающими веществами, применять маску пчеловода или накомарник. 9. При вскрытии трупов не разбрасывать органы и их части, не разбрызгивать кровь и др. жидкости. Все складывается аккуратно в определенном месте. 10. В случае ранения вскрытие приостановить, остановить кровотечение, рану обработать 5%-ым спиртовым раствором йода. 11. После вскрытия убрать части трупа, вымыть столы, пол. 12. Инструменты надо вымыть теплой водой, затем продезинфицировать 3-4%-ым раствором креолина или лизола, либо 3-5%-ым раствором формалина или прокипятить в 1-2%-ом растворе соды, высушить. Для длительного хранения инструменты следует смазать вазелином. 13. Нарукавники, фартуки, сапоги после вскрытия вымыть водой и продезинфицировать 3-4%-ым раствором формалина или лизола. 14. Перчатки следует вымыть водой с мылом на руках, продезинфицировать раствором сулемы 1:1000 или хлорамина, насухо вытереть, опудрить тальком, затем снять с рук, начиная с запястья, проверить на целостность. 15. Если вскрытие проводили без перчаток, то руга-т надо тщательно вымыть с мылом и продезинфицировать раствором сулемы 1:1000 или 2-3%-ым раствором карболовой или уксусной кислоты, 3-4%-ым раствором формалина. Для уничтожения трупного запаха руки можно погрузить в 0,5%-ый раствор марганцовокислого калия, затем для устранения бурой окраски кожи — в насыщенный раствор щавелевой кислоты или смазать подсолнечным маслом. 16. Уходя из прозекториума, следует тщательно продезинфицировать обувь о дезковрик, находящийся при входе в прозекториум и систематически увлажняющийся дезраствором. Практическая работа№ 3. Тема: Основы патогистологической техники Цель: освоить технику подготовка патологического материала для микроскопического исследования Содержание занятия: Патологическая анатомия изучает нарушения нормального строения органов и тканей, возникающие в больном организме. При этом изучению подвергаются изменения, доступные невооруженному глазу, так и более тонкие, т.е. требующие применения микроскопа. Задачей патолого–гистологической техники является подготовка патологического материала для микроскопического исследования, заключающаяся в обработке материала, позволяющей произвести оптическую дифференцировку элементов органов, ткани, клетки. а)трупы павших и убитых животных; б)трупы экспериментальных животных; в)органы, удаляемые у больных животных при хирургических операциях. Схема патолого–гистологической обработки материала
а) декальцинация; б) заливка в целлоидин; в) заливка в парафин.
а) окраска Гематоксилин-эозином; б) дополнительные окраски.
Правила взятия материала от трупов для патогистологического исследования:
Фиксацией называется обработка с целью сохранения структуры объектов в неизменном состоянии от воздействия: а)от каждого органа, где обнаружены патологические изменения; б) от главнейших внутренних органов.
Общие сведения о фиксации патологического материала Фиксацией называется обработка с целью сохранения структуры объектов в неизменном состоянии от воздействия: а)физических факторов (высыхание); б)неорганических факторов (окисление); в)органических факторов (гниение, патолиз). Сущность фиксации заключается в коллоидной реакции превращения тканевых белков из золя в гель, т.е. в коагуляции белков. Фиксирующая жидкость может быть простой или сложной. Сложными жидкостями называются жидкости, состоящие из нескольких веществ (жидкость Карнуа, Мюллера, Ценкера и др.). Преимуществом метода фиксации является возможность длительного сохранения материала. Недостатком метода является некоторое искажение истинной структуры органа. Искажение истинной структуры органа называется артефактом. Артефакт корригируется: а) наблюдением свежих объектов; б) использованием различных фиксаторов. Общие правила фиксации материала
Самым распространенным стандартным методом фиксации является формалин. Формалином называется 40%-водный раствор газа формальдегида (НСОН). Правила фиксации материала в формалине
а) кусочек материала толщиной менее 0,5см помещается в пробирку с 20%-водным формалином; б) нагревается в течение 3–5мин, до появления пузырьков (не кипятить).
а) тонких цитологических структур; б) веществ, растворимых в воде (гликоген, мочевая кислота). Достоинства формалиновой фиксации
Недостатки фиксации в формалине
Для выявления веществ, растворимых в воде, пользуются безводными фиксаторами (абсолютный спирт, 96% спирт). Сложные фиксирующие жидкости
Примечание:
Подготовка материала к микрокопированию. Окраска срезов Декальцинация Декальцинацией называется удаление извести из материала. Известь является физиологическим компонентом в некоторых тканях (кость) и очень часто является патологическим продуктом (в обызвествленных хрящах, в туберкулезных, сапных, паразитарных узелках). Известь создает препятствия для приготовления срезов и поэтому должны быть удалена. Все методы декальцинации основаны на растворении извести в слабых растворах кислот. Кислоты, в свою очередь, нейтрализуются слабыми щелочными растворами. Декальцинирующие жидкости: Азотная кислота–3–10см3. Воды дистиллированной–97–90см3.
а) 5%-водный раствор калийных квасцов; б) насыщенный раствор углекислого лития. Уплотнение материала Заливка материала в плотные среды необходима:
Наиболее употребительными способами уплотнения материала являются: а) для замораживания–плотной средой служит сухой лед; б) для заливки в прозрачные среды–целлоидин, парафин, желатин. Заливка материала в целлоидин В патогистологической технике употребляется специальный целлоидин, кинолента, коллодиум, который растворяется в спирт эфире. Схема заливки в целлоидин:
Целлоидин жидкий 5%, 2–4дня; целлоидин густой 10%, 1–2дня; уплотнение целлоидина в чашечках, 2–3дня.
Заключение материала в парафин Схема заливки в парафин:
спирт 70%, 1–2суток; спирт 96%, 1–2суток; спирт абсолютный, 1–2суток; спирт-ксилол, 2–3часа; ксилол, 2–3часа.
ксилол–парафин, 2–3часа; парафин, 4–6часов; парафин (свежая порция), 4–6часов.
Изготовление срезов Объектом патогистологического исследования является срез. Срезы могут быть изготовлены толщиной 1–2мк. Наиболее употребительными являются срезы толщиной в 6–12мк. Аппараты, на которых изготовляют срезы, называются микротомами. Микротомы бывают:
Основных частей у каждого микротома пять: Станина. Держатель ножа. Предметный столик. Микрометрическая установка. Микротомный нож. Окрашивание срезов Цель окраски срезов является оптическая дифференцировка структурных элементов и тканей. Сущность окраски выявлена недостаточно. Для объяснения окраски предложено много теорий, которые могут быть подразделены на 3 группы:
Примером химической теории является теория самообразования Эрлиха и Уина, согласно которой при окраске происходит химическое соединение краски и объекта по типу соединения кислот и щелочей с образованием соли. Примером физической теории окраски является теория адсорбции Ауэрбаха, согласно которой при окраске краситель откладывается на объекте по физическим законам адсорбции без химического соединения. Примером физико–химической теории является теория обменной адсорбции Михаэльса, согласно которой при окраске происходит коллоидная реакция адсорбции с последующим соединением краски и окрашиваемого вещества по типу адсорбирования. Эта теория в настоящее время является наиболее распространенной. Употребляемые в гистологической технике краски делятся на 4 группы:
Эозин – кислая краска красного цвета. Реагирует со щелочной протоплазмой. Гематоксилин – краска со щелочной реакцией лилового цвета. Реагирует с кислым ядром. Способы окраски:
Окраска срезов гематоксилин – эозином
Результаты окраски Ядра клеток синие, с включением хроматинового вещества (темно–синие точки). Цитоплазма розового цвета. Соединительная ткань ярко–розового цвета. Практическая работа№ 4. Тема: Действие болезнетворных факторов на животный организм Цель: изучить болезнетворное воздействие механических факторов на организм животного. К патогенным факторам внешней среды, способным вызвать заболевания животных, относят механические, физические, химические и биологические. Они становятся болезнетворными, если по силе и продолжительности превосходят адаптационные, приспособительные возможности организма. Болезнетворное воздействие механических факторов Подразумевает повреждения, обусловленные приложением механической силы к тканям, превышающей их способность к сопротивлению, называют Механической травмой (от греч. Trauma — рана, повреждения). Заболевания, вызванные механическими факторами, составляют более 50 % незаразных болезней домашних животных. Период же войн называют эпидемией травматизма. Различают несколько видов травматических повреждений. Сотрясение мозгаНаступает в результате удара по голове или падения животного. Сопровождается функциональными расстройствами без грубых деструктивных изменений мозговой ткани, нарушением межмолекулярных связей в нервных клетках. Для сотрясения мозга характерны потеря сознания, боковое положение животного, падение артериального давления, брадикардия, одышка, рвота. Клинические признаки сравнительно быстро исчезают. Контузия Характерна повреждением тканей с разрывом сосудов мозга, других тканей. Причина — удар, ушиб, взрывная волна. Симптоматика зависит от интенсивности механической травмы и функциональной значимости поврежденного участка мозга. УшибХарактерен размозжением тканей, разрывом сосудов, кровоизлияниями, некрозом, болевой реакцией. При нарушении целостности кожных покровов развивается гнойное или гнилостное воспаление. Раны— нарушение целостности покровных тканей, сосудов, мышц, внутренних органов в результате воздействия значительной механической силы. Различают раны колотые резаные, рваные, огнестрельные, размозженные, операционные, Наиболее часто встречающаяся хирургическая патология; Симптоматика и последствия зависят от приложенной силы, локализации раневого процесса, возможных осложнений. Ранения могут принимать массовый характер при стрижке овец, ковыльной болезни, когда остями плода различных видов ковыля травмируются ткани и органы животных, в условиях ведения боевых действий. Повреждения опорно-двигательного аппарата, Такие, как переломы костей (открытые и закрытые), вывихи костей в суставах, растяжения и разрывы мышц, сухожилий, возникают в результате падений, аварийных ситуаций. Осложнения, сопровождающие травматизм: повреждения жизненно важных органов, часто несовместимые с жизнью; кровопотеря; асептическое, гнойное, гнилостное воспаления; парезы, параличи, атрофии; столбнячная инфекция; травматический шок. Болезнетворное действие Физических факторов подразумевает действие на организм высокой и низкой температур, изменений барометрического давления, электрического тока, атмосферного электричества, инфракрасных лучей, ультрафиолетового излучения, ионизирующих излучений, лучевое поражение. Электричество. Длина волн от 10 м до 1 км. Источниками тока, поражающего организм животных, является природное электричество или сетевой электроток. Действию природного тока животные могут быть подвержены во время дождя, когда разряды молнии напряжением до 1 млн. В вызывают паралич дыхательного и сосудодвигательного центров. На теле пораженного животного остаются последствия в виде ожогов разной степени, вплоть до обугливания. Патогенное действие сетевого электрического тока животные испытывают при контакте различных частей тела с оголенными электропроводами. Нередки случаи повреждения током через конечности, когда животное наступает на оголенный провод. Животные (коровы) могут подвергаться действию тока, когда пьют воду из автопоилок, система металлических труб которых из-за неисправности электросети может быть подключена к источнику тока. Действие сетевого тока зависит от его параметров, путей прохождения через организм, вида и состояния животного. Установлено, что поражающий эффект переменного тока выше, чем постоянного, но при напряжении более 450 В. постоянный ток становится более опасным. Ток частотой 50 Гц опаснее в сравнительном аспекте, чем частотой 300-600 Гц, а токи ультравысоких частот (1 млн. Гц и выше) для жизни не опасны, их используют в физиотерапии. Сопротивление электрическому току зависит как от напряжения, так и от свойств тканей, через которые он проходит. Наиболее часто у животных электротравма обусловлена контактом токонесущего предмета с покровными тканями. Они обладают наибольшим сопротивлением, но кожа, волосы, копыта могут быть в момент прохождения тока сухими или влажными. Сопротивление сухой кожи составляет 40-100 кОм, влажной – 0,8 и 1 кОм, поэтому при равных условиях мокрое животное погибнет от электротравмы быстрее, чем имеющее сухие покровы. Поражающее действие тока зависит от длительности действия, пути прохождения его по организму. Наиболее опасно поражение током дыхательного и сосудодвигательного центров при прохождении через голову, а также через область сердца. В первом случае может наступить смерть от остановки дыхания. Во втором возникают спазм коронарных сосудов и фибрилляция сердца. Чувствительность животных разных видов к электротравме неодинакова. Лошади более чувствительны, чем крупный рогатый скот, собаки погибают быстрее, чем кошки. Очень чувствительны к току овцы. Прохождение электрического тока через организм сопровождается общими и местными изменениями. Общие Сводятся к возбуждению нервных рецепторов поперечнополосатых и гладких мышц. Развитие тонических судорог приводит к резкому подъему артериального давления, остановке дыхания, непроизвольному мочеиспусканию и дефекации, спазму голосовых связок. Повышен выброс адреналина и норадреналина. Если электротравма не смертельна, то вслед за перевозбуждением следует длительное состояние запредельного торможения. Исход электротравмы во многом зависит от исходного функционального состояния центральной нервной системы. Местные проявления электротравмы сводятся к ожогам, электрическому рисунку и разрывам мягких тканей на месте входа и выхода тока. Механизм действия электротока (электротравма) обусловлен тремя факторами: 1) Электротермическое действие определяет переход электрической энергии в тепловую, при этом возможны ожоги разной степени, действие образовавшихся газов и паров воды; 2) Электромеханическое действие тока вызвано прямым переходом электроэнергии в механическую и образованием разрывов мягких тканей трещинами и переломами костей; 3) Электрохимическое действие тока заключается в электролизе, появлении свободных радикалов, перемещении ионов; у анода скапливаются положительно заряженные ионы, что приводит к коагуляционному некрозу клеток, а отрицательные ионы направляются к катоду, создавая щелочную среду с последующим колликвационным некрозом (электрический рисунок). Действие барометрического давления. Находясь в среде обитания, животный мир наряду с другими природными факторами испытывает на себе изменения барометрического давления. На уровне моря барометрическое давление равно 760 мм рт. ст. Чем выше поднимается животное над уровнем моря, тем давление ниже, при опускании в шахты или под воду оно повышается. Действие пониженного атмосферного давления. В естественных условиях животные испытывают действие пониженного барометрического давления при перемещении на высокогорные пастбища, транспортировке самолетами, проведении экспериментов в барокамерах в результате разрежения воздуха. Механизм развития горной болезни определяются двумя факторами: снижением парциального давления кислорода во вдыхаемом воздухе, гипоксией; и влиянием на организм пониженного барометрического давления (гипобарии). Снижение парциального давления кислорода во вдыхаемом воздухе сопровождается гипоксемией — уменьшением содержания кислорода в крови и последующей гипоксией — уменьшением содержания кислорода в тканях. Реакция организма будет зависеть от степени и продолжительности гипоксии. Чем длительнее гипоксия, тем лучше условия для адаптации организма, развития компенсаторных реакций: увеличения числа эритроцитов и гемоглобина крови, рефлекторной одышки и тахикардии, гипертрофии миокарда. Эритроцитоз и гипергемоглобинемия позитивно влияют на организм при возврате животных с высокогорных пастбищ в долины. При быстрых подъемах на значительную высоту вовлекаются механизмы экстренной адаптации. Гипоксия сопровождается раздражением рефлексогенных зон, рефлекторно учащается дыхание. Оно углубляется, вовлекаются резервные альвеолы. Увеличивается количество циркулирующей крови за счет срочного выброса из депо. Тахикардия сопровождается увеличением ударного и минутного объемов сердца. Усиливается кровоснабжение жизненно важных органов — мозга, сердца, почек. Ограничивается функциональная активность других органов и тканей. Причиной возможной остановки дыхания и последующей смерти является газовый алкалоз и гипокапния, обусловленные гипервентиляцией легких и неполным окислением субстратов, уменьшенным образованием конечных продуктов — СО2 и Н2О. Второй фактор, определяющий симптоматику горной болезни, — синдром декомпрессии. Снижение барометрического давления сопровождается расширением газов, растворенных в жидких средах организма и анатомических полостях. Из-за повышения разницы между внутренним и внешним давлением возможны разрыв мелких сосудов и кровотечение из носа и ушей. При умеренной декомпрессии возможна адаптация путем повышения тонуса стенок кровеносных сосудов. Действие повышенного атмосферного давления. Организм подвергается действию повышенного атмосферного давления (гипербарии) в глубоких шахтах, под водой или в барокамерах. Гипербария сопровождается повышением парциального давления азота, кислорода, других газов. При погружении в воду через каждые 10 м давление повышается на 100 кПа (1 ат). Болезнетворное влияние гипербарии организм испытывает уже при компрессии, равной 200-300 кПа: пульс и дыхание замедляются, повышается кровенаполнение внутренних органов, вдавливаются внутрь барабанные перепонки. Быстрое перемещение от нормального к высокому атмосферному давлению может привести к разрыву кровеносных сосудов, легочных альвеол. Гипербария сопровождается усиленным растворением в биологических средах атмосферных газов (сатурация), особенно азота. Он насыщает не только кровь, но и органы, богатые липидами. Жировая ткань поглощает азота в 5 раз больше, чем кровь. Липидами богата мозговая ткань, поэтому от сатурации прежде всего страдает функция центральной нервной системы. Первоначально наблюдают явления легкого возбуждения, затем торможения — глубинного наркоза. Токсическое действие избытка газов проявляется нарушениями координации движений, ослаблением сердечной деятельности. Особая опасность для жизни возникает при быстром перемещении организма из среды с высоким давлением в нормальные условия (декомпрессия). Возникает так называемая кессонная болезнь. В ее патогенезе основное значение имеет десатурация — образование пузырьков газа, растворенного в крови и высвобождающегося из тканей. Пузырьки азота начинают циркулировать, они сливаются, превращаются в эмболы, закрывающие просвет сосудов. Развивается множественная газоэмболия, нарушающая нормальное кровоснабжение органов. Появляются основные признаки декомпрессионной болезни: острые суставные и мышечные боли, нарушение деятельности головного мозга и периферических нервов, дыхания и работы сердца. Возможны судороги. Профилактируют кессонную болезнь путем медленного снижения атмосферного давления, обеспечивающего постепенную диффузию азота через легкие во внешнюю среду. Практическая работа№ 5. Тема: Цель: |
