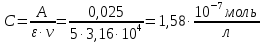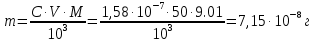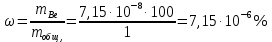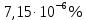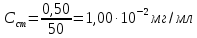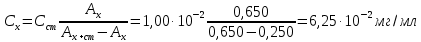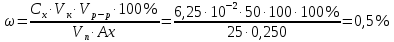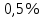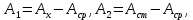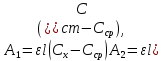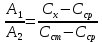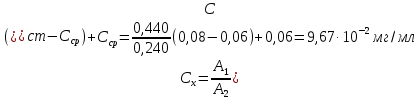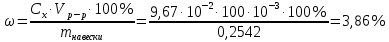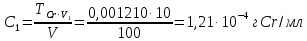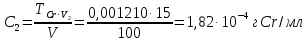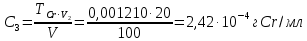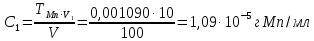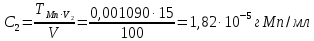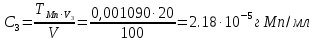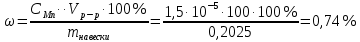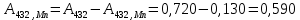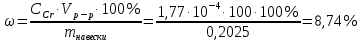Решение задач по теме АБСОРБЦИОННАЯ СПЕКТРОСКОПИЯ. СМА_Практические задания. Практическая работа 2 Решение задач по теме абсорбционная спектроскопия саратов 2020г. Задача 1
 Скачать 219.73 Kb. Скачать 219.73 Kb.
|
|
| V,мл КМnО4 | 10,0 | 15,0 | 20,0 | V.мл К2Сг207 | 10,0 | 15,0 | 20.0 |
| А533 | 0,230 | 0,350 | 0,470 | А533 | 0 | 0 | 0 |
| А432 | 0,100 | 0,140 | 0.180 | А432 | 0,430 | 0,600 | 0,780 |
Рассчитываем концентрации стандартных растворов.
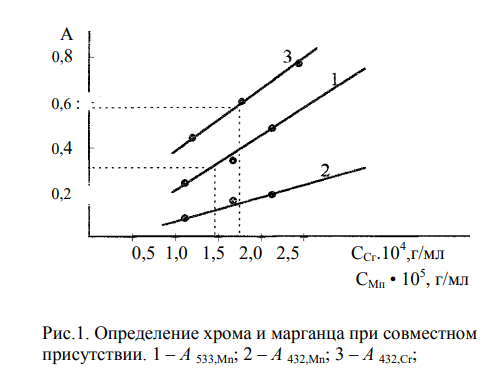
Строим градуировочные графики в координатах , откладывая на оси ординат значения относительных оптических плотностей, а на оси абсцисс — концентрации растворов.
графики, по которым определяют концентрацию, необходимо вычерчивать с большой точностью и в достаточно большом масштабе (20смх25см);
примерно половина точек должна лежать по одну сторону кривой, а половина – по другую.
По градуировочному графику (кривая 1) находим концентрацию марганца СMn = 1,50.10-5 г/мл. Массовая доля (%) марганца в стали равна:
По градуировочному графику (кривая 2) находим соответствующую данной концентрации Mn A 432,Mn = 0,130, а затем
По градуировочному графику (кривая 3) находим концентрацию хрома ССг = 1,77.10–4 г/мл и рассчитываем массовую долю хрома в навеске (%):
| Содержание железа (П), мг/л | 1,00 | 1,05 | 1,10 | 1,15 |
| Оптическая плостность, А | 0,12 | 0,36 | 0,60 | 0,84 |
Решение:
Для того чтобы найти содержание железа в анализируемом растворе по исходным данным, построим градуировочный график координатах с помощью Excel, отложив на оси ординат значения относительных оптических плотностей, а на оси абсцисс — содержание железа (II).
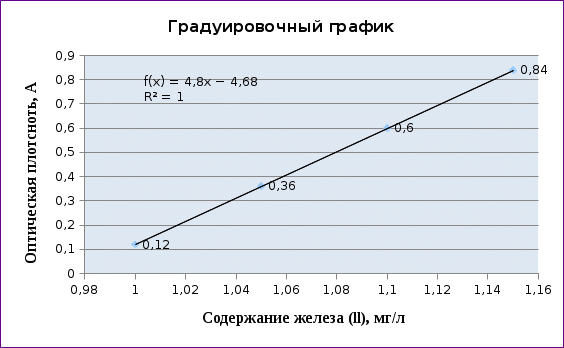
Выведим уравнение на основании полученных данных, подставив вместо переменной y значение оптической плотности исследуемого раствора:
y = 4,8 x – 4,68 ;
0,38 = 4,8 x - 4,68;
– 4,8 x = - 0,38 - 4,68;
-4,8 x = -5,06 / ( -1);
x = 1,0542 – содержание железа в растворе без учета разбавления.
Учитывая разбавление раствора в 5 раз перед проведением измерения, вычислим содержание железа:
1,054 * 5 = 5, 271 мг.
Ответ: 5,271 мг.
Задача № 6.
Рассчитать молярный коэффициент светопоглощения комплексного соединения меди (П), если оптическая плотность раствора, приготовленного растворением 0,1 мг навески в объеме 50 мл, измеренная при толщине слоя кюветы 1 см, равна 0,27.
Решение:
Для того чтобы определить молярный коэффициент светопоглощения, для начала необходимо подсчитать молярную концентрацию раствора:
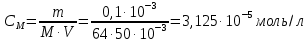
где M( Cu) = 64 г/моль
Молярный коэффициент следует выразить из уравнения Бугера –Ламберта –Бера для нахождения оптической плотности:
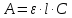 ,
,где А – оптическая плотность;
ε – молярный коэффициент светопоглощения;
l – толщина слоя кюветы, см;
C – молярная концентрация раствора, моль/л.
Отсюда
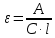
Подставим данные и найдем молярный коэффициент светопоглощения:
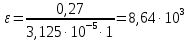
Ответ:
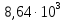 .
.Ответы на контрольные вопросы
1.Перечислите основные процессы, лежащие в основе используемых в химическом анализе спектральных методов.
Спектральный анализ — совокупность методов качественного и количественного определения состава веществ, основанных на исследовании спектров испускания, поглощения, люминесценции, отражения и рассеяния электромагнитного излучения. Спектроскопические методы анализа основаны на способности атомов и молекул вещества испускать, поглощать или рассеивать электромагнитное излучение.
Изменение интенсивности электромагнитного излучения после взаимодействия с веществом связано с качественным и количественным составом вещества, что обуславливает широкое распространение и интенсивное развитие методов спектроскопии в анализе.
2. Укажите отличия упругого и неупругого взаимодействия электромагнитного излучения с веществом.
При упругом взаимодействии электромагнитной волны с частицей исследуемого вещества энергия волны остается неизменной, меняется только направление ее распространения. К числу спектроскопических методов, основанных на упругом взаимодействии, относят рефрактометрические методы анализа.
При неупругом взаимодействии происходит обмен энергией между излучающими частицами вещества и внешним (диагностирующим) электромагнитным излучением. При этом изменяется как внутреннее состояние анализируемых частиц, так и энергия (длина волны) излучения.
3.Сформулируйтезадачиатомного и молекулярного спектрального анализа.
Различают атомный и молекулярный спектральный анализ. Задачей атомного спектрального анализа является установление элементного состава вещества. Одним из наиболее мощных методов элементного анализа является атомно-эмиссионный спектральный анализ, изучающий спектры испускания свободных атомов и ионов в газовой фазе. Молекулярный спектральный анализпредполагает идентификацию данного вещества и (или) определение его количества (концентрации, массы).
Совокупность спектральных методов качественного и количественного анализа, основанных на изучении спектров поглощения электромагнитного излучения исследуемым веществом, называют спектроскопией поглощения, илиабсорбционной спектроскопией.
4. Разновидности молекулярного абсорбционного спектрального анализа:
1) Молекулярно-абсорбционный анализ в УФ и видимой областях спектра
2) Молекулярно-абсорбционный анализ в ИК области спектра
3) Спектроскопия комбинационного рассеяния
4) Люминесцентный анализ
5) Рентгеновский спектральный анализ(РСА)
6) Рефрактометрический анализ
7) Масс-спектрометрия
8) Спектроскопия ядерного магнитного резонанса
5. Классификация спектроскопических методов.
Молекулярный спектральный анализ предполагает качественное и количественное определение, молекулярного состава пробы по молекулярным спектрам поглощения и испускания.
Молекулярные спектры очень сложны, так как возможны различные электронные переходы в молекулах (электронные спектры), колебательные переходы с изменением колебательных состояний ядер атомов, входящих в состав молекулы (колебательный спектр), и изменения вращательных состояний молекулы (вращательный спектр). Эти спектры расположены в различных областях длин волн (частот). Электронные спектры, усложняющиеся колебательной и вращательной структурой, представляют собой систему характерных полос, которые располагаются от вакуумной ультрафиолетовой (1000А) до ближней инфракрасной области ( 12000А). Колебательные спектры, сопровождающиеся вращательной структурой, расположены в ближней инфракрасной части спектра от 1,2 до 40 (от 8-103.до 250 см1). Вращательные спектры расположены в более далекой инфракрасной части спектра и измерение их оптическими (термоэлектрическими) средствами возможно до 1,5 мм (т. е. от 250 до 6 см1). Вращательные спектры заходят в микроволновую область, изучаемую средствами радиоспектроскопии.
6. Определение электромагнитной волны:
Электромагнитная волна — электромагнитные колебания, распространяющиеся в пространстве с конечной скоростью, зависящей от свойств среды. Электромагнитной волной называют распространяющееся электромагнитное поле.
7. Перечислите наиболее важные параметры электромагнитного излучения.
Основные характеристики ЭМИ:
Частота ( Гц) - число колебаний электрического поля в секунду.
Длина волны λ (нм = 10-9м) – это наименьшее расстояние между двумя точками, колеблющимися в одной фазе.
Волновое число
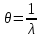 (см-1) – число волн, приходящихся на 1 см пути излучения в вакууме.
(см-1) – число волн, приходящихся на 1 см пути излучения в вакууме.Интенсивность I (
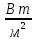 ) – энергия излучения в 1 сек. (на практике – это значение аналитического сигнала в произвольных единицах – число делений шкалы прибора).
) – энергия излучения в 1 сек. (на практике – это значение аналитического сигнала в произвольных единицах – число делений шкалы прибора).8. Сформулируйте соотношение между энергией световой волны и ее частотой, длиной волны, волновым числом.
С помощью трех величин: длины волны
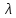 , волнового числа ν , частоты v можно охарактеризовать величину энергии электромагнитного излучения. Физик Макс Планк установил зависимость между энергией Е электромагнитного излучения и частотой ν. Такая зависимость представлена выражением Е=h·v,
, волнового числа ν , частоты v можно охарактеризовать величину энергии электромагнитного излучения. Физик Макс Планк установил зависимость между энергией Е электромагнитного излучения и частотой ν. Такая зависимость представлена выражением Е=h·v, где Е –энергия электромагнитного излучения, ДЖ;
h- 6,6256 ·10-34 Дж·с, постоянная Планка ( квант действия Планка),
v- частота электромагнитного излучения , Гц.
Энергия излучения Е прямо пропорциональна его частоте v, которая рассчитывается следующим образом v=с/λ. Если объединить два выражения можно получить прямую зависимость между энергией Е и длиной волны λ:
E = h ∙V = h ∙
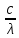
Из данного уравнения видно, что энергия Е света обратно пропорциональна длине волны λ.
Чем меньше значение λ, тем больше энергия электромагнитного излучения.
Таким образом, энергия УФ-излучения больше, чем энергия ИК-излучения, длина волны которого больше.
9. Дайте определение мощности и интенсивности излучения, приведите единицы их измерения.
Мощность (или поток) излучения - энергия, переносимая в единицу времени. Измеряется в ваттах (Вт).
Интенсивность излучения – это мощность световой энергии (поток излучения за единицу времени), проходящей через площадку единичного сечения, расположенную перпендикулярно выбранному направлению в единичном телесном угле.
Единицей измерения интенсивности является Вт/м².
10. Приведите соотношение Бора для спектральных термов.
Н. Бор связал с каждым спектральным термом vnэнергию En, воспользовавшись формулой Планка:
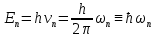 ,
,Формула Бора для квантов энергии испускания или поглощения атома:
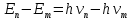 ,
,т.е. при переходе с уровня
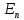 на уровень
на уровень 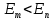 атом испускает фотон с частотой v. При обратном переходе атом поглощает фотон.
атом испускает фотон с частотой v. При обратном переходе атом поглощает фотон.Формула содержит два фундаментальных утверждения:
Энергетический спектр атома дискретен;
Частоты атомного излучения связаны с атомными энергетическими уровнями.
11. Какие виды движения и соответствующие им спектры возникают при образовании из двух атомов А и В молекулы АВ?
Существуют два вида движения: гармоническое и ангармоническое колебание.
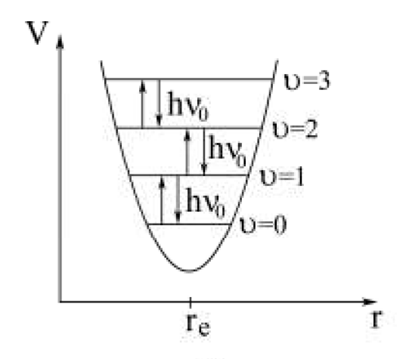
Кривая потенциальной энергии и уровни колебательной энергии гармонического осциллятора.
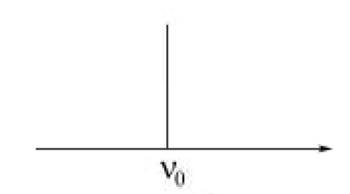
Схематический колебательный спектр гармонического осциллятора.
В результате квантования энергии Eкол.гарм .гармонический осциллятор характеризуется набором равноотстоящих энергетических уровней, отличающихся друг от друга на одинаковую величину hν0. Правило отбора для перехода между колебательными уровнями гармонического осциллятора имеет вид:
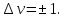
Схематический колебательный спектр ангармонического осциллятора.
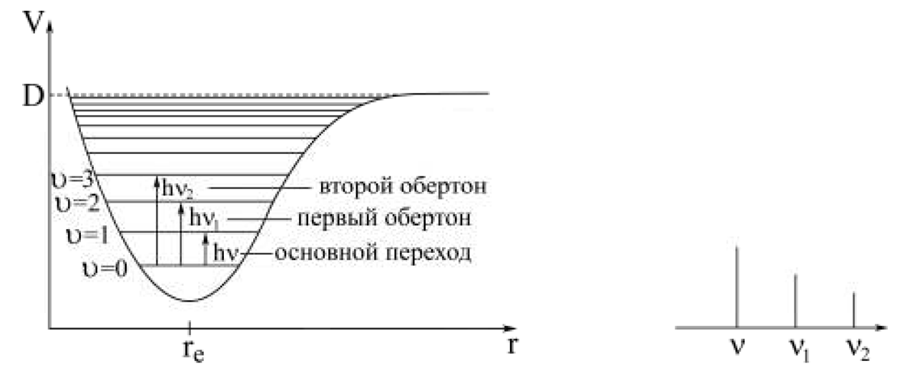
В случае ангармонического осциллятора (реальной молекулярной системы) могут реализовываться переходы не только между соседними колебательными уровнями с Δυ = 1, но и переходы с Δυ = 2, 3,.....
Это приводит к появлению в колебательном спектре нескольких полос с частотами ν, ν1 , ν2 и т.д.
12. Как соотносятся значения энергий электронных, колебательных и вращательных переходов?
| | 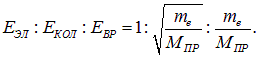 | |
В соответствии с этими отношениями система уровней молекулы складывается из сравнительно далеко отстоящих электронных уровней, испытывающих расщепление под влиянием колебаний ядер. Эти расщепленные уровни, в свою очередь, испытывают еще более тонкое расщепление в связи с вращением молекул.
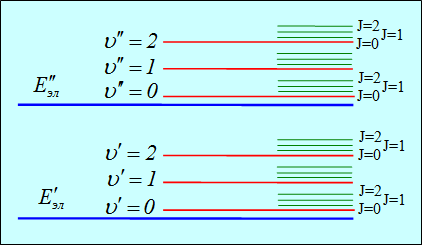
Схема расположения электронных, вращательных и колебательных уровней энергии молекулы.
Учитывая соотношения между энергиями
приходим к выводу, что при слабых возбуждениях изменяется только
13. Какие основные блоки содержатся в спектральных аналитических приборах?
Каждый прибор, предназначенный для измерения оптической плотности или спектров поглощения, включает в себя следующие основные узлы:
источник излучения с непрерывным (сплошным) распределением энергии в широком интервале длин волн;
устройство, позволяющее выделить сравнительно узкие участки спектра;
помещения для образцов (кюветы);
приемник излучения;
регистрирующее устройство
Источники излучения. При измерениях в областях электронных спектров поглощения для диапазона длин волн от 350 до 1300 нм применяют лампы накаливания, а от 200до 400 нм – водородные.
Устройства для выделения узких участков спектра в качестве рабочих световых потоков.При фотоколориметрических измерениях из всей видимой области спектра выделяют лучи определенных длин волн. Для этого на пути световых потоков перед поглощающими растворами помещают избирательные поглотители света – светофильтры. Они пропускают лучи лишь в определенном интервале длин волн и практически полностью поглощают лучи других длин волн. Светофильтры для фотометрирования выбирают так, чтобы максимум поглощения раствора соответствовал максимуму пропускания (минимуму поглощения) светофильтра.
Приемники излучения. В современных приборах в качестве приемников излучения в УФ, видимой и ближней ИК- области спектра используются фотоэлементы.
Кюветы. При работе с растворами используются кюветы – специальные сосуды из материала, не поглощающего в данной области спектра, с тщательно отполированными плоскопараллельными стенками и точно известной толщиной слоя раствора.
14. Перечислите материалы, используемые для изготовления оптических элементов спектральных приборов в УФ, видимой и ИК областях спектра.
К оптическим материалам относят материалы, прозрачные для оптического диапазона электромагнитных волн (света), используемые для изготовления оптических элементов (деталей), работающих в ультрафиолетовой, видимой и инфракрасной областях спектра. Оптические материалы являются оптическими средами, к которым относят также оптические пленки, воздух, жидкости, газы, оптические клеи, воск, лак и прочие вещества, пропускающие оптическое излучение.
Оптические материалы (ГОСТ 23136-93) подразделяются на: оптические стекла, оптические ситаллы, оптические кристаллы; оптическую керамику, оптические полимеры.
По строению оптические материалы подразделяют на моно- и поликристаллические, стекла, аморфные, стекло-кристаллические и жидкокристаллические. Природные монокристаллы, напр., флюорита CaF2, кварца SiO2, кальцита СаСО3, слюды, каменной соли и др., давно используют в качестве оптических материалов. Кроме того, используют большое кол-во синтетических монокристаллов, обладающих прозрачностью в различных участках диапазона и имеющих высокую однородность и определенные габариты.
Поликристаллические оптические материалы характеризуются прозрачностью, по величине сходной с прозрачностью монокристаллов, и лучшими по сравнению с ними конструкционнымисвойствами. Наиб. применение находит оптическая керамика на основе Аl2О3, MgAl2O4, SiO2,), а также бескислородные поликристаллические оптические материалы для ИК области спектра- LiF, MgF2, ZnS, ZnSe и др.
15. Назовите основные источники излучения для УФ, видимой и ИК областей спектра.
Источником излучения может служить дейтериевая лампа (в УФ-спектроскопии), лампа накаливания с вольфрамовой нитью (спектроскопия в видимой области) или стержень, нагретый до температуры порядка 400С, излучающий в ИК-области.
Монохроматор – оптический прибор, позволяющий выделять излучение заданной длины волны (обычно с точностью до 1 нм) или проводить сканирование по длинам волн в выбранном диапазоне.
Детектором для спектрометров, работающих в видимой и УФ-области, обычно служит ФЭУ или диодная матрица, для ИК-спектрометров – термопара, которая регистрирует изменения температуры, возникающие в результате поглощения части ИК- (теплового) излучения.

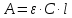 ,
,