практическая работа. практика 3(2). Практическая работа 3 Приготовление титрованного раствора для кислотноосновного титрования. (Гост 25794. 183 Реактивы. Методы приготовления титрованных растворов для кислотноосновного титрования)
 Скачать 136.98 Kb. Скачать 136.98 Kb.
|
|
Практическая работа №3 «Приготовление титрованного раствора для кислотно-основного титрования. (ГОСТ 25794.1-83 Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования)» Выполнила : Чунчалиева Оксана Эдуардовна 2022 г. Цели: Образовательная: рассмотерть устройство установки для титрования. Развивающая: сформировать умения подготавливать реактивы к выполнению анализа. Воспитательная: сформировать понимание необходимости применять технику безопасности в химической лаборатории. Контрольные вопросы Какой способ приготовления растворов выбран в данном задании? Для чего нужны поправки на температуру при приготовлении растворов? Какие расчеты необходимы при выполнении задания? Ответы на контрольные вопросы. Какой способ приготовления растворов выбран в данном задании Титриметрический анализ основан на точном измерении реактива, израсходованного на реакцию с определяемым веществом. Раньше этот вид анализа называли объемным, так как в расчетах используют объем раствора, пошедшего на реакцию. Титриметрия отличается от гравиметрии малой трудоемкостью, простотой аппаратурного оформления. Титриметрический анализ в отношении скорости выполнения дает огромное преимущество по сравнению с гравиметрическим, являющимся, однако, наиболее точным химическим методом анализа. Реакция, используемая в титриметрическом анализе, должна протекать количественно, т. е. должны выполняться следующие условия: ● константа равновесия должна быть достаточно велика; ● реакция должна протекать с большой скоростью; ● реакция не должна осложняться побочными реакциями; ● должен быть способ определения точки эквивалентности. Если не выполняется хотя бы одно условие, то метод титриметрии непригоден. Для этого метода необходимо: 1) использовать мерную посуду для точного определения объемов растворов; 2) использовать титрованный или стандартный раствор; 3) подобрать способ фиксации точки эквивалентности. Для чего нужны поправки на температуру при приготовлении растворов? При выполнении особо точных работ в объемном анализе необходимо помнить, что водные растворы расширяются при повышении температуры и сжимаются при охлаждении, что приводит к изменению концентрации титрованного раствора. Кубический коэффициент расширения всякого водного раствора зависит от концентрации растворенного вещества. Для воды и для 0,1 н водных растворов практически он одинаков. В таблице приводятся поправки к объему воды и некоторых водных растворов, находящихся в мерных колбах, к объему при 20°С, которая в объемном анализе принимается за нормальную температуру. 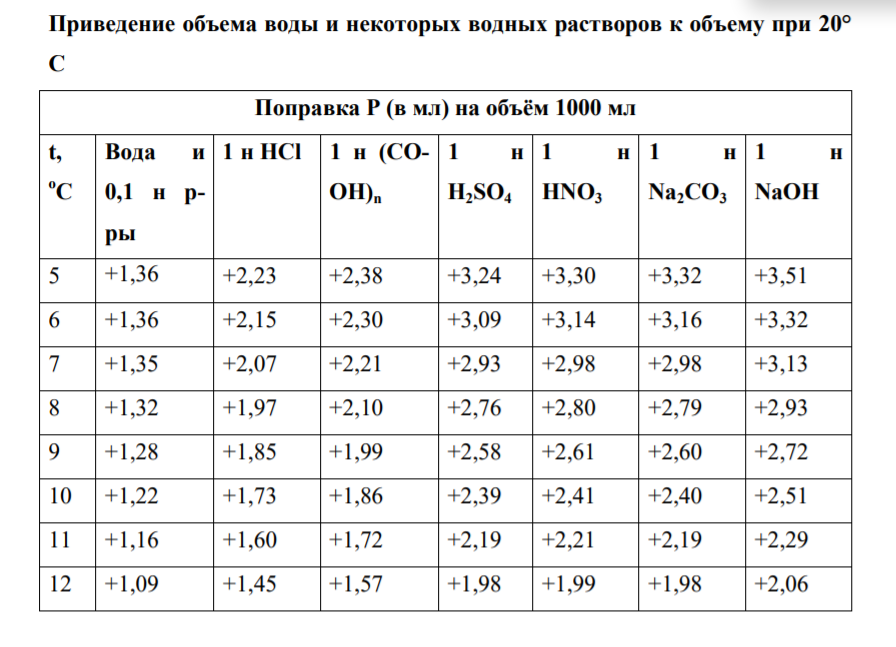 При изготовлении концентрированных растворов избегают получения концентраций, близких к насыщенным, так как при понижении температуры раствора возможно выпадение в осадок растворенного вещества. Допустимые отклонения в концентрации концентрированных растворов приведены в таблице № 8 приложения № 3 Приказа № 751н. Какие расчеты необходимы при выполнении задания? Расчеты при разбавлении и укреплении концентрированных растворов Концентрация оказалась выше требуемой. Объём воды, необходимый для разбавления полученного раствора, вычисляется по формуле: 𝑥 = A C−B B , где X – объём воды, необходимый для разбавления полученного раствора, в мл; A – объём изготовленного раствора, в мл; C – фактическая концентрация раствора, в %; B – требуемая концентрация раствора, в %. Например, при анализе установлено, что концентрация Калия бромида получилась 23% вместо 20%, тогда: 𝑥 = 1000×(23%−20%) 20 =150 мл Т.е. к 1 литру 20% раствора Калия бромида следует добавить 150 мл воды очищенной для получения 20% раствора. После исправления концентрации проверяем на полный химический анализ. Объём становится 1150 мл. Концентрация оказалась ниже требуемой. Массу ЛВ для укрепления полученного раствора вычисляется по формуле: 𝑥 = 𝐴 × (𝐵 − 𝐶) 100 × ρ × 20% − B где X – масса вещества, которую следует добавить к раствору; A – объём изготовленного раствора, в мл; B – требуемая концентрация раствора, в %; C – фактическая концентрация раствора, в %; 20% - плотность раствора нужной концентрации (5, 10, 20 % и т.д.) Например, концентрация Калия бромида составляет 18% вместо 20%, тогда: 𝑥 = 1000×(20%−18%) 100×1,144−20% =21,19 г После растворения в 1 литре 18% раствора калия бромида 21,19 г вещества проводим полный химический анализ и объём увеличивается на: 21,19 ×КУО Калия бромида = 21,19×0,27 = 5,7 мл и стал равен 1005,7 мл. Фильтруют растворы в штангласы, которые оформляют этикеткой (на белом фоне чёрные буквы): На обратной стороне штангласа – паспорт штангласа, на котором указывается: – дата приготовления; – № анализа; – № серии; – роспись приготовившего; – роспись проверившего; – срок годности. Точную молярную концентрацию с, моль/дм3, с коэффициентом поправки вычисляют по формуле 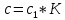 где с1 - заданная молярная концентрация вещества в растворе, моль/дм3; К - коэффициент поправки. Точную молярную концентрацию с, моль/дм3, без коэффициента поправки вычисляют по формуле 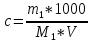 где m1 - масса навески установочного вещества, г; М1 - молярная масса эквивалента установочного вещества, г/моль; V -объем анализируемого раствора, израсходованный на титрование, см3 Точная молярная концентрация вещества в растворе выражается четырьмя значащими цифрами после запятой. Коэффициент поправки (K) определяют по установочным веществам или их растворам. При применении установочного вещества коэффициент поправки вычисляют по формуле: 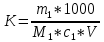 где m1 - масса навески установочного вещества, г; М1 - молярная масса эквивалента установочного вещества, г/моль; с1 - заданная молярная концентрация вещества в растворе, моль/дм3; V -объем анализируемого раствора, израсходованный на титрование, см3. При применении раствора установочного вещества (заданная молярная концентрация обоих растворов одинаковая) коэффициент поправки вычисляют по формуле  где V1- объем раствора установочного вещества, взятый или израсходованный на титрование, см3; К1 - коэффициент поправки раствора установочного вещества; V- объем анализируемого раствора, взятый или израсходованный на титрование, см3. Вывод: В ходе работы поставленные цели были достигнуты. А именно: я рассмотрела устройство установки для титрования. Сформировала умения подготавливать реактивы к выполнению анализа. Сформировала понимание необходимости применять технику безопасности в химической лаборатории. |
