практикум строев. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.74 Mb. Скачать 1.74 Mb.
|
ОБМЕН УГЛЕВОДОВМетоды исследования обмена углеводов необходимы для диагностики сахарного диабета и других эндокринных заболеваний, энзимопатий, функции печени, почек и т.д. Одним из информативных показателей состояния углеводного обмена является уровень глюкозы в крови, исследование которого чаще всего проводится в клинике. Реже прибегают к изучению содержания других сахаров и гликогена, а также к определению концентрации молочной и пировиноградной кислот. При наследственных нарушениях метаболизма углеводов известную диагностическую ценность представляет определение активности участвующих в нем ферментов. Работа 46. Определение содержания глюкозы в крови о-толуидиновым методом Реактивы. Трихлоруксусная кислота, 30 г/л раствор; о-толуидиновый реактив*; глюкоза, основной стандартный 27,8 мМ раствор, свежеприготовленный. Оборудование. Штатив с пробирками; пипетки вместимостью 0,1, 1 и 5 мл; водяная баня; центрифуга с центрифужными весами; ФЭК. Материал. Кровь, взятая из пальца. Метод основан на способности глюкозы при нагревании с о-толуидином в растворе уксусной кислоты давать зеленое окрашивание, интенсивность которого пропорциональна концентрации глюкозы. Ход определения. В центрифужную пробирку отмеряют 0,9 мл раствора трихлоруксусной кислоты. Из пальца обследуемого берут микропипеткой 0,1 мл крови и выдувают в пробирку с трихлоруксусной кислотой. Смесь в пробирке перемешивают встряхиванием и центрифугируют 10 мин при 3000 об/мин. Отбирают 0,5 мл центрифугута в другую пробирку и добавляют в нее 2 мл о-толуидинового реактива. Пробирку помещают в кипящую водяную баню на 8 мин, после чего охлаждают под струей холодной воды. Для постановки стандартной пробы вместо крови берут 0,1 мл разведенного в 5 раз стандартного раствора глюкозы, добавляют 0,9 мл раствора трихлоруксусной кислоты и с 0,5 мл полученной смеси проводят реакцию с о-толуидиновым реактивом. Фотометрируют опытную и стандартные пробы на ФЭКе при 590-650 нм (красный светофильтр) в кювете с толщиной слоя 0,5 см в сравнении с дистиллированной водой. Расчет. Содержание глюкозы в крови х (моль/л) рассчитывают по формуле Еоп Сст х = ————— , Ест где Еоп – экстинкция опыта, Ест – экстинкция стандарта; Сст – концентрация глюкозы в стандартной пробе, равная 5,55 ммоль/л. Оформление работы. Рассчитать концентрацию глюкозы в крови обследуемого и сделать вывод о причинах возможных изменений ее уровня. Практическое значение работы. Методы, применяемые для определения глюкозы, не всегда дают истинное содержание ее в крови, поэтому существуют понятия – «истинная» глюкоза и сахар крови. Последний показатель включает всю сумму восстанавливающих углеводов и некоторые редуцирующие вещества неуглеводной природы (глутатион, креатин, мочевая кислота). Поэтому содержание сахара в крови выше, чем показатель истинной глюкозы. Среди методов, позволяющих определить концентрацию истинной глюкозы в биологическом материале, следует отметить о-толуидиновый и глюкозооксидазный. В норме содержание сахара в крови составляет 0,8-1,2 г/л, а глюкозы – 2,8-4,0 ммоль/л. Увеличение уровня сахара в крови (гипергликемия) наблюдается при сахарном диабете, при избытке в организме глюкокортикоидов – гормонов коры надпочечников, при стрессовых состояниях, при употреблении с пищей большого количества углеводов и т.д. Низкое содержание сахара в крови (гипогликемия) имеет место при голодании, нарушении всасывания глюкозы в тонком кишечнике (малосорбция), при избытке инсулина в организме (гиперинсулинизм) и т.д. Работа 47. Количественное определение содержания глюкозы в крови глюкозооксидазным методом Реактивы. 5%-ный раствор трихлоруксусной кислоты; натрий фосфат двузамещенный, 0,25 моль/л*; раствор глюкозооксидазы*; фенолфталин 0,5%; рабочий реактив*. Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1,0; 2,0 мл; центрифуга с центрифужными весами; ФЭК. Материал. Кровь, взятая из пальца. Метод основан на способности глюкозооксидазы при определенном оптимуме рН действия катализировать распад глюкозы с образованием перекиси водорода. Образующаяся перекись водорода в присутствии ионов меди окисляет фенолфталин до фенолфталеина, который в нейтральной области бесцветен, а в щелочной области окрашен в красный цвет. Ход определения. 0,03 мл крови выливают в 1,5 мл 5% раствора трихлоруксусной кислоты, перемешивают и центрифугируют. К 1 мл надосадочной жидкости добавляют 2 мл 0,25 моль/л фосфата натрия и 2 капли (приблизительно 0,1 мл) раствора глюкозооксидазы. Перемешивают и оставляют стоять при комнатной температуре на 1 час, затем добавляют 2 мл рабочего реактива и через 30 мин фотометрируют в кювете на 10 мм при длине волны 530 нм (зеленый светофильтр). Одновременно ставят контрольную пробу, в которую берут 1 мл 5% раствора трихлоруксусной кислоты и далее проводят как и опытную пробу. Расчет. Расчет проводят по калибровочному графику. Оформление работы. По экстинкции рассчитывают содержание глюкозы в крови, сравнивают ее содержание с нормой и делают вывод о возможных отклонениях. Практическое значение работы. (См. определение содержания глюкозы в крови орто-толуидиновым методом). Работа 48. Определение содержания молочной кислоты в крови по Баркеру и Саммерсону Реактивы. Трихлоруксусная кислота, 20%-ный раствор; сульфат меди (II), 20%-ный и 4%-ный растворы; оксид кальция, порошок, навеска 0,5 г; серная кислота, конц.; n-гидроксидифенил, свежеприготовленный щелочной раствор (50 мг n-гидроксидифенила растворяют в 3 мл 3%-ного раствора гидроксида натрия). Оборудование. Водяная баня с лабораторным термометром; штатив с пробирками; пипетки на 0,1 и 1 мл; стеклянные палочки; центрифуга с центрифужными весами; ФЭК. Материал. Кровь, взятая из пальца. 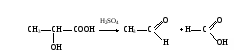 Метод основан на способности молочной кислоты при нагревании с концентрированной серной кислотой переходить в ацетальдегид, дающий с n-гидроксидифенилом характерную фиолетовую окраску, интенсивность которой пропорциональна концентрации молочной кислоты: Метод основан на способности молочной кислоты при нагревании с концентрированной серной кислотой переходить в ацетальдегид, дающий с n-гидроксидифенилом характерную фиолетовую окраску, интенсивность которой пропорциональна концентрации молочной кислоты: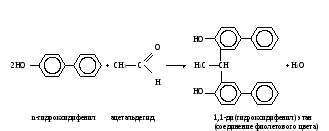 Ход определения. В центрифужную пробирку отмеривают 0,5 мл дистиллированной воды и вносят в нее 0,1 мл крови, взятой микропипеткой из пальца обследуемого. Микропипетку промывают той же водой. К содержимому пробирки добавляют 1 мл раствора уксусной кислоты и помещают ее на 10 мин в лед (для лучшего осаждения белков), после чего центрифугируют 5 мин при 3000 об/мин. Надосадочную жидкость сливают в чистую центрифужную пробирку, добавляют 0,5 мл 20%-ного раствора сульфата меди и 0,5 г порошка оксида кальция и тщательно перемешивают стеклянной палочкой. Появляется голубое окрашивание (если окрашивание зеленоватое, то проба дальнейшей обработке не подвергается). Смесь оставляют стоять на 30 мин, периодически помешивая стеклянной палочкой. Затем ее центрифугируют 5 мин при 100 об/мин. Надосадочную жидкость сливают в чистую пробирку, приливают 1 каплю 4%-ного сульфата меди и осторожно наслаивают 3 мл концентрированной серной кислоты, погрузив при этом пробирку в лед и непрерывно помешивая содержимое стеклянной палочкой. После этого пробирку помещают в кипящую водяную баню на 5 мин и затем охлаждают ее в водяной бане до 20˚С. К охлажденной смеси приливают 1 каплю (0,05 мл щелочного раствора n-гидроксидифенила и ставят пробирку в водяную баню при 30˚С на 30 мин, время от времени взбалтывая содержимое. В пробирке за это время развивается голубое окрашивание. Пробирку помещают на 90 с (точно!) в бурно кипящую водяную баню. За это время голубая окраска переходит в фиолетовую. Затем смесь охлаждают и фотометрируют на ФЭКе при 540 нм (светофильтр зеленый) в кювете с толщиной слоя 1,0 см против воды. Расчет. Содержание молочной кислоты х (ммоль/л) рассчитывают по формуле с1000 х = ————— , 0,1∙1000 где с – количество молочной кислоты в пробе, найденное по калибровочному графику, ммоль; 0,1 – объем крови, взятый на исследование, мл; 1000 в числителе – коэффициент пересчета на 1 л крови; 1000 в знаменателе – коэффициент перевода микромолей в миллимоли. Оформление работы. Рассчитать содержание молочной кислоты в крови обследуемого. В выводе указать на возможные сдвиги концентрации молочной кислоты и их причины. Практическое значение работы. В норме содержание молочной кислоты в крови составляет 0,50-2,0 ммоль/л. Увеличение ее содержания может наблюдаться при усиленной мышечной работе, при заболеваниях, сопровождающихся развитием гипоксии (недостаточность сердечной деятельности, хронические бронхиты, анемия и т.д.). Работа 49. Определение содержания пировиноградной кислоты в крови по Фридеману и Хаугену Реактивы. Трихлоруксусная кислота, 5%-ный раствор; 2,4-динитрофенилгидразин (2,4-ДНФГ), 0,1%-ный раствор в 2 М растворе соляной кислоты; толуол; карбонат натрия, 10%-ный раствор; гидроксид натрия, 1,5 М раствор. Оборудование. Пенициллиновые флакончики с полиэтиленовыми пробками; штатив с пробирками; пипетки вместимостью 1 и 5 мл; бюретка вместимостью 25 мл; пипетка с резиновой грушей; центрифуга с центрифужными весами; ФЭК. Материал. Кровь. Принцип метода см. работу 31. Ход определения. В центрифужную пробирку вносят 1 мл крови, приливают 4 мл раствора трихлоруксусной кислоты, перемешивают встряхиванием и центрифугируют 10 мин при 3000 об/мин. В пенициллиновый флакон отбирают 1 мл центрифугата, прибавляют 2 мл воды и 1 мл раствора 2,4-ДНФГ, перемешивают встряхиванием, закрывают пробкой и ставят в темное место на 20 мин. К содержимому флакона добавляют 5 мл толуола, закрывают флакон пробкой и встряхивают 3 мин. После расслоения фаз отсасывают пипеткой с резиновой грушей нижний слой и отбрасывают его. К оставшемуся во флаконе слою толуола приливают 4 мл раствора карбоната натрия, закрывают флакон пробкой и встряхивают 3 мин. После расслоения жидкостей отбирают из нижнего слоя 3 мл в пробирку и добавляют в нее 3 мл раствора гидроксида натрия (появляется красно-бурое окрашивание). Через 5 мин фотометрируют пробу на ФЭКе при 415 нм (светофильтр синий) в кювете с толщиной слоя 1 см против воды. Расчет. Содержание пировиноградной кислоты х (ммоль/л) рассчитывают по формуле с 1000∙3 х = —————— , 4∙1000 где с – количество пировиноградной кислоты в пробе, найденное по калибровочному графику, мкмоль; 1000 в числителе – коэффициент пересчета на литр крови; 1000 в знаменателе – коэффициент пересчета мкмоль в ммоль; 4 – объем добавленного раствора карбоната натрия, мл; 3 – объем раствора карбоната натрия, отобранного для проведения реакции, мл. Оформление работы. По полученному значению экстинкции рассчитать содержание пировиноградной кислоты в крови и сделать вывод о причине возможных его изменений. Практическое значение работы. В норме содержание пирувата в крови составляет 0,1-0,13 ммоль/л. Его уровень повышается при недостатке в организме тиамина (витамина В1), а также в результате действия ингибиторов пируватоксидантного комплекса (арсенат, люизит и др.). |
