практикум строев. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.74 Mb. Скачать 1.74 Mb.
|
А100————— . х Оформление работы. Провести необходимые расчеты и сделать вывод о причинах спонтанного гемолиза, а также о действии изучаемых прооксидантов и антиоксидантов. Практическое значение работы. По степени гемолиза эритроцитов можно судить о состоянии антиокислительных систем клетки, в частности, об обеспеченности организма витамином Е. При нормальной обеспеченности спонтанный гемолиз, как правило, составляет 2-10%. Недостаток витамина Е резко повышает этот показатель. Имеется соответствие между спонтанным или индуцированным гемолизом и содержанием токоферолов в сыворотке крови. Способность витамина D2 ускорять пероксидное окисление липидов в мембранах эритроцитов и других клеток свидетельствует о его прооксидантных свойствах. Работа 108. Определение скорости пероксидного окисления липидов в биомембранах Реактивы. Трис-HCl буфер, 0,04 М раствор с рН 7,4*; соль Мора – Fe(NH4)2(SO4)2, 4·10-5 М свежеприготовленный раствор; трихлоруксусная кислота, 40%-ный раствор; тиобарбитуровая кислота, 0,8%-ный свежеприготовленный раствор; оксалат натрия, 1,34%-ный раствор; хлорид натрия, 0,9%-ный раствор; хлорид калия, 1,2%-ный раствор. Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1 и 5 мл; пастеровские пипетки; резиновая груша; водяная баня с термометром или водяная баня аппарата Варбурга; аптечные весы с разновесами; спектрофотометр или ФЭК типа КФК-2. Материал.
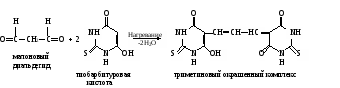 а. Определение скорости пероксидного окисления липидов в мембранах эритроцитов. Метод основан на определении содержания конечного продукта пероксидного окисления липидов – малонового диальдегида, который при взаимодействии с тиобарбитуровой кислотой образует окрашенный в розовый цвет триметиновый комплекс, имеющий максимум поглощения при 530-532 нм: а. Определение скорости пероксидного окисления липидов в мембранах эритроцитов. Метод основан на определении содержания конечного продукта пероксидного окисления липидов – малонового диальдегида, который при взаимодействии с тиобарбитуровой кислотой образует окрашенный в розовый цвет триметиновый комплекс, имеющий максимум поглощения при 530-532 нм:Окраска раствора пропорциональна концентрации малонового диальдегида. Молярный коэффициент экстинкции 1,56·10-5л·моль-1·см-1. Ход определения. Оксалатную кровь центрифугируют 10 мин при 3000 об/мин, осаждая эритроциты. Верхний слой отсасывают, а осадок эритроцитов трижды промывают раствором хлорида натрия и переосаждают при том же режиме центрифугирования. Отбирают 0,5 мл осадка эритроцитов в чистую центрифужную пробирку, приливают равный объем дистиллированной воды и оставляют стоять 30 мин для полного гемолиза. Пробу центрифугируют 30 мин при 3000 об/мин, осторожно отсасывают пастеровской пипеткой надосадочную жидкость с серой прослойкой мембран эритроцитов и переносят в другую пробирку. Берут три чистые пробирки. В первую опытную вносят по 0,3 мл растворов соли Мора, трис-буфера, аскорбиновой кислоты и 0,1 мл полученной взвеси мембран эритроцитов. Во вторую опытную приливают 0,3 мл трис-буфера, 0,1 мл взвеси мембран эритроцитов и 0,6 мл дистиллированной воды. В третью (контроль) добавляют те же реактивы, что и в первую пробирку, после чего сразу приливают 1 мл раствора трихлоруксусной кислоты. Все пробирки помещают в водяную баню (или в баню аппарата Варбурга) и инкубируют пробы 20 мин при 37˚С. Реакцию в опытных пробах останавливают, добавляя в обе пробирки по 1 мл раствора трихлоруксусной кислоты. Все пробы центрифугируют 15 мин при 3000 об/мин. Сливают надосадочную жидкость (ее объем 2 мл) в три другие пробирки, прибавляют по 1 мл раствора тиобарбитуровой кислоты и помещают пробы на 10 мин в кипящую водяную баню. Затем пробирки охлаждают в ледяной воде. Измеряют экстинкцию полученных проб против контроля на спектрофотометре при 532 нм или на ФЭКе (светофильтр зеленый) в кювете с толщиной слоя 1 см. Расчет по формулам Е13∙6 Е23∙6 х1 = ———— и х2 = ———— , 0,156 0,156 где х1 – скорость образования в пробе малонового диальдегида в присутствии прооксидантов (индуцированное пероксидное окисление липидов), нмоль∙ч-1; х2 – скорость образования в пробе малонового диальдегида в отсутствие прооксидантов (спонтанное пероксидное окисление липидов), нмоль∙ч-1; 3 – объем пробы, мл; 6 – коэффициент пересчета на 1 час; 0,156 – экстинкция 1 нмоля при 532 нм; Е1 и Е2– экстинкции соответственно первой и второй проб против контроля. б. Определение скорости пероксидного окисления липидов в гомогенатах тканей. Принцип метода описан выше. Ход определения. Навеску 0,5 г печени гомогенизируют в 19,5 мл охлажденного до 0-4˚С раствора хлорида калия, поместив стакан гомогенизатора в лед или снег. Полученный гомогенат сливают в пробирку. В одну пробирку наливают 2,0 мл гомогената и 0,2 мл дистиллированной воды, во вторую – 2 мл гомогената и по 0,1 мл растворов аскорбиновой кислоты и соли Мора, в третью – те же вещества, что и во вторую, и, кроме того, добавляют 1 мл раствора трихлоруксусной кислоты. Все пробирки помещают на 10 мин в водяную баню при 37˚С, после чего прибавляют в первые две пробирки по 1 мл раствора трихлоруксусной кислоты. Далее все пробы центрифугируют 10 мин при 3000 об/мин. По 2 мл надосадочной жидкости отбирают в три чистые пробирки, приливают по 1 мл раствора тиобарбитуровой кислоты и помещают пробы в кипящую водяную баню на 10 мин. После этого их охлаждают в ледяной воде до комнатной температуры. Измеряют экстинкцию всех проб против контрольного раствора (2 мл раствора хлорида калия, 1 мл раствора трихлоруксусной кислоты и 1 мл раствора тиобарбитуровой кислоты, выдерживают 10 мин на кипящей водяной бане и охлаждают в ледяной воде до комнатной температуры) на спектрофотометре при 532 нм или ФЭКе (светофильтр зеленый) в кювете с толщиной слоя 1 см. Расчет проводят по формулам: Е1(Е2)3∙3,2∙6 Е33∙3,2 х1 (х2)= —————— и х3 = —————— , 0,156∙2 0,156∙2 где х1 – скорость спонтанного пероксидного окисления липидов в гомогенатах, измеряющаяся в наномолях образовавшегося малонового диальдегида в пробе за час инкубации; х2 – скорость аскорбат-зависимого неферментативного пероксидного окисления липидов в наномолях образовавшегося малонового диальдегида в пробе за час инкубации; х3 – содержание малонового диальдегида в исходном гомогенате, нмоль; Е1, Е2 и Е3– экстинкции соответственно первой, второй и третьей проб; 3,2 – общий объем исследуемых проб, мл; 2 – объем надосадочной ждкости, взятой на определение малонового диальдегида, мл; 3 – объем проб, взятых на фотометрию, мл; 0,156 – экстинкция 1 нмоль малонового диальдегида в 1 мл при 532 нм; Оформление работы. Рассчитать полученные результаты, дать сравнительную характеристику скорости спонтанного и индуцированного пероксидного окисления липидов, сделать вывод о возможности использования метода для оценки скорости пероксидного окисления липидов и его применимости на практике. Практическое значение работы. Методы определения скорости пероксидного окисления липидов биомембран важны для оценки действия на эту систему природных веществ и ксенобиотиков, среди которых могут быть как прооксиданты, так и антиоксиданты. Эти исследования дают возможность практически использовать выявленный эффект различных соединений, в том числе лекарственных средств. Увеличение скорости пероксидного окисления липидов возможно при старении, гиповитаминозе Е, дефиците селена, действии ионизирующего облучения, гипербарической оксигенации (действии кислорода под повышенным давлением), при некоторых заболеваниях и патологических состояниях (сердечно-сосудистых заболеваниях, гипоксии, отравлении четыреххлористым углеродом, гипервитаминозах А и D и т.д.). Гемоглобин и кислород, содержащиеся в эритроцитах, ускоряют пероксидное окисление липидов, что вызывает повреждение мембран эритроцитов и их гемолиз. Защита эритроцитарных мембран осуществляется системой антиоксидантов: токоферолами, имеющимися в мембранах и плазме крови, глутатионпероксидазой, обезвреживающей гидропероксиды липидов, и альбумином плазмы, который связывает пероксиды липидов. При недостаточности антиоксидантной системы развиваются гемолитические состояния, которые часто провоцируются некоторыми пищевыми факторами и лекарственными средствами. |
