практикум строев. Практикум по биологической химии, изданный в 1986 году, подвергся существенной переработке, а также дополнен новыми лабораторными работами в разделах белки, липиды,
 Скачать 1.74 Mb. Скачать 1.74 Mb.
|
|
Обе пробирки помещают на 20 мин в водяную баню при 37˚С, после чего в опытной пробе останавливают реакцию, приливая 0,5 мл трихлоруксусной кислоты. Далее обе пробы центрифугируют 10 мин при 3000 об/мин. Отбирают из каждой пробы по 1 мл надосадочной жидкости, переносят их в две другие пробирки. Затем приливают к ним по 0,5 мл карбоната натрия и по 1,5 мл раствора фенола. Перемешивают содержимое встряхиванием. Для развития окраски пробирки помещают на 30 мин в водяную баню при 37˚С. Затем измеряют экстинкцию опытной пробы против контрольной на ФЭКе или СФ при 630 нм (светофильтр красный). Серию растворов для построения калибровочного графика готовят согласно таблице.
Затем пробирки ставят на 30 мин в водяную баню при 37˚С. Измеряют экстинкцию проб против контроля, как описано выше, и строят калибровочный график. Расчет проводят по формуле АV х = ——— , 20m где х – гидроксилазная активность нмоль/(мин∙мг белка); А – содержание 4-аминофенола в пробе, найденное по калибровочному графику, нмоль; V – объем пробы, равный 1,71 мл; 20 – время инкубации, мин; m – содержание белка в пробе, мг. Практическое значение работы. Для изучения функции микросомальной цепи окисления печени в норме и особенно при патологических состояниях используют различные методические подходы. В частности, исследования проводят с разными субстратами, превращение которых происходит на цитохроме Р450. При взаимодействии с цитохромом Р450 разные субстраты дают неодинаковые спектры поглощения. По этому признаку их условно делят на субстраты I типа (к ним относятся, например, амидопирин, бензфетамин, этилморфин и др.) и II типа (анилин), что связано, возможно, с некоторыми различиями в механизме гидроксилирования данных соединений. Скорость реакций гидроксилирования изменяется при действии многих внешних факторов (радиации, гипероксии, гипоксии, интоксикации четыреххлористым углеродом и т.д.), под влиянием ряда регуляторов (витаминов, гормонов). Для получения более полной информации о деятельности гидроксилазной активности микросом печени при действии многих факторов и при патологии используют разные ксенобиотики – субстраты цитохрома Р450. Работа 103. Метод оценки активности монооксигеназ эндоплазматической сети клеток печени по выделению метаболитов амидопирина с мочой по Т.А.Попову и О.Д.Леоненко Метаболизм амидопирина осуществляется с помощью ферментативных реакций окисления и конъюгации. Первая из них (N-деметилирование) катализируется монооксигеназной ферментной системой эндоплазматической сети печени по уравнению 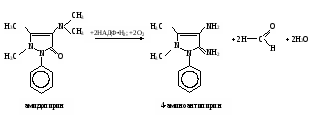 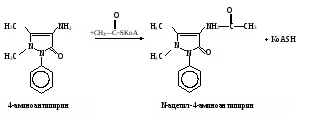 Далее 4-аминоантипирин с участием соответствующей N-ацетилтрансферазы и ацетил-КоА подвергается ацетилированию: Далее 4-аминоантипирин с участием соответствующей N-ацетилтрансферазы и ацетил-КоА подвергается ацетилированию:Реактивы. Фенол перекристаллизованный, 0,02%-ный раствор; аммиачный буфер с рН 10,5-10,6 (20 г хлорида аммония растворяют в 100 мл 25%-ного раствора аммиака); трихлоруксусная кислота, 12,5%-ный раствор; соляная кислота, 36%-ная; гексацианоферрат (III) калия, 1%-ный раствор; 4-аминоантипирин, свежеприготовленный стандартный раствор 1 мг/мл для построения калибровочного графика. Оборудование. Штатив с пробирками; пипетки вместимостью 0,2; 1; 2 и 5 мл; пробирки, обернутые фольгой; воронки с бумажными фильтрами; воронки со стеклянным мелкопористым фильтром; водяная баня; ФЭК или спектрофотометр. Материал. Моча, содержащая метаболиты амидопирина. Для получения мочи белым крысам внутрибрюшинно вводят раствор амидопирина из расчета 20 мг на 1 кг массы тела, затем отсаживают их в стеклянные выделительные воронки и собирают мочу в мерные цилиндры в течение 12 или 24 ч. Перед исследованием мочу фильтруют через бумажные фильтры. Метод основан на способности 4-аминоантипирина, являющегося метаболитом амидопирина, при взаимодействии с фенолом в щелочной среде и в присутствии гексацианоферрата (III) калия образовывать соединение типа индофенола, имеющее розовую окраску. Ход определения. В две пробирки вносят по 1,5 мл профильтрованной мочи. В первую (для определения свободного 4-аминоантипирина) приливают 0,3 мл аммиачного буфера, а во вторую (для определения суммы метаболитов, т.е. 4-аминоантипирина и N-ацетил-4-аминоантипирина) 0,3 мл соляной кислоты. Перемешивают пробы, осторожно встряхивая пробирки. Содержимое первой пробирки через 15 мин фильтруют через бумажный фильтр; вторую пробирку закрывают пробкой, обернутой фольгой, и помещают на 15 мин в кипящую водяную баню, после чего сразу охлаждают пробу в воде со льдом до комнатной температуры. Охлажденный гидролизат фильтруют через мелкопористый стеклянный фильтр в другую пробирку. Отбирают из первой пробы 0,6 мл фильтрата в чистую пробирку и добавляют последовательно 0,5 мл раствора трихлоруксусной кислоты, 2 мл раствора фенола и 0,1 мл раствора гексацианоферрата (III) калия. Содержимое перемешивают и через 10 мин (но не позже чем через час) измеряют экстинкцию опытной пробы на ФЭКе (светофильтр зеленый) или на спектрофотометре при 510 нм в кювете с толщиной слоя 1 см против контрольной, содержащей все компоненты, кроме фенола, который заменяется 2 мл дистиллированной воды. Полученная экстинкция (Е1) соответствует содержанию в моче 4-аминоантипирина. К профильтрованному гидролизату второй пробы приливают 0,6 мл аммиачного буфера, смесь перемешивают и вновь профильтровывают через бумажный фильтр. Отбирают в чистую пробирку 0,8 мл прозрачного фильтрата и добавляют последовательно 0,2 мл дистиллированной воды, 2 мл раствора фенола и 0,1 мл раствора гексацианоферрата (III) калия. Содержимое пробирки перемешивают и через 10 мин (но не позже чем через час) измеряют экстинкцию второй опытной пробы на ФЭКе или на спектрофотометре при тех же условиях, что и для первой пробы. Полученное значение экстинкции (Е2) соответствует содержанию в моче суммы метаболитов (4-аминоантипирин и N-ацетил-4-аминоантипирин). Расчет. Содержание метаболитов амидопирина в моче и показатели активности ферментных систем печени, участвующих в превращении ксенобиотиков, рассчитывают по калибровочному графику. Для его построения в 5 пробирок вносят соответственно 0,05; 0,1; 0,2; 0,3 и 0,4 мл стандартного раствора 4-аминоантипирина. Затем в каждой пробирке доводят общий объем пробы до 5 мл дистиллированной водой и приливают в них по 1 мл аммиачного буфера. Содержимое перемешивают, фильтруют, отбирают в другие пробирки по 0,6 мл фильтрата и обрабатывают его так же, как и при определении свободного 4-аминоантипирина в моче (первая опытная проба). Полученные значения экстинкции соответствуют концентрации 4-аминоантипирина 5, 10, 20, 30 и 40 мкг/л (примерный калибровочный график показан на рис. 13). По Е1 находят общее количество выделенного 4-аминоантипирина, умножая содержание его в пробе на суточный объем мочи (в мл). 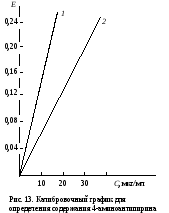 По Е2 определяют аналогичным образом сумму метаболитов амидопирина, выделенных за сутки с мочой. По Е2 определяют аналогичным образом сумму метаболитов амидопирина, выделенных за сутки с мочой.Относительную активность монооксигеназы печени рассчитывают в % от введенного количества амидопирина по формуле А100% —————— , В где А – сумма метаболитов, выделенных с мочой за сутки; В – количество введенного животному амидопирина. Ацетилирующую активность ферментных систем организма х (в %) находят по формуле (Е2 – Е1)100% х = ——————— , Е1 где Е1 и Е2 – соответствующие экстинкции опытных проб. Оформление работы. Рассчитать относительную активность ферментных систем N-деметилирования и ацетилирования у исследуемых животных и сделать вывод о практическом значении данного теста. Практическое значение работы. Обстоятельное изучение ферментов печени, осуществляющих реакции гидроксилирования многих соединений и их конъюгацию, открывает возможности косвенной оценки активности изучения состава и соотношения метаболитов разных ксенобиотиков, поступающих в организм. Демонстративность и относительная простота выполнения позволяют использовать эти тесты не только в эксперименте, но и в клинической практике для выявления ранних нарушений различных токсических веществ, производственных факторов и различных лекарств на ферментативные системы гидроксилирования и ацетилирования ксенобиотиков в организме. Работа 104. Определение активности алкогольдегидрогеназы в сыворотке крови по Шкурски и др. с дополнениями И.В.Бокия, М.С.Усатенко и В.Ф.Трюфанова Реактивы. Пирофосфатный буфер, 0,1 М раствор, рН 8,5*; n-нитрозодиметиланилин, 26 мкМ раствор*; н-бутанол, 0,25 М водный раствор; НАД+, свежеприготовленный раствор (3,3 мг НАД в 1 мл 0,25 М раствора бутанола). Оборудование. Пипетки на 0,1; 1 и 2 мл; стеклянные палочки; секундомер; спектрофотометр. Материал. Сыворотка крови. Метод основан на способности алкогольдегидрогеназы (АДГ) катализировать две последовательные реакции: НАД-зависимое окисление бутанола и восстановление n-нитрозодиметиланилина с участием НАД∙Н2, образовавшимся в ходе первой реакции. При этом n-нитрозодиметиланилин, имеющий в растворе интенсивно желтую окраску, обесцвечивается. Об активности АДГ судят по скорости светопоглощения красителя, которое регистрируют на спектрофотометре при 440 нм. Ход определения. Спектрофотометр подготавливают к работе, устанавливают рабочую длину волны на 440 нм и стрелку шкалы отсчета с помощью рукоятки на «нуль» при закрытой шторке. В кювету спектрофотометра помещают 2 мл раствора n-нитрозодиметиланилина и 0,5 мл сыворотки крови. Против этой кюветы рукояткой «щель» устанавливают шкалу отсчета на 0,300, после чего реакцию запускают добавлением в кювету 0,1 мл раствора НАД в растворе бутанола. Смесь быстро перемешивают стеклянной палочкой. Регистрируют снижение экстинкции инкубационной среды в течение 2 мин при 25˚С. Примечание. Определение активности АДГ в каждом образце сыворотки проводят дважды, а при расхождении результатов измерения более чем на 10% - три раза. После этого вычисляют среднее значение изменения экстинкции за 1 мин. Расчет производится по формуле х = 320,5∆Е , где х – активность АДГ, мкмоль/(мин∙л); 320,5 – коэффициент расчета активности, выраженный в мкмолях превращенного субстрата при указанных условиях инкубации; ∆Е – изменение экстинкции при 440 нм за 1 мин. Если изменение экстинкции при 440 нм превышает 0,050 за 1 мин, то сыворотку крови следует развести натрий-фосфатным буфером в 2-4 раза. Измеренную величину активности умножить на фактор разведения. Для определения активности АДГ рекомендуется брать свежеполученную сыворотку крови. При хранении активность фермента снижается, поэтому значение активности, измеренной после хранения, следует умножить на соответствующий коэффициент, установленный эмпирически:
Оформление работы. Сравнить полученное значение активности АДГ с нормой и сделать соответствующие выводы. Практическое значение работы. Алкогольдегидрогеназа не проявляет абсолютной субстратной специфичности. Этот фермент катализирует окисление, помимо этанола, ряда первичных и вторичных спиртов, этиленгликоля и т.д., причем в некоторых случаях с большей скоростью, чем этанола. АДГ содержится в гиалоплазме клеток многих органов и тканей, но в ткани печени ее активность в 20-40 раз выше, чем в других. В сыворотке крови концентрация фермента у здоровых людей очень низка и традиционными методами практически не выявляется. Описанный метод позволяет определить активность АДГ. У здоровых людей активность АДГ в сыворотке крови регистрируется в пределах 0,32-2,56, а в среднем 1,18 мкмоль/мин∙л. У лиц, злоупотребляющих алкоголем, активность фермента в сыворотке крови повышается в зависимости от длительности приема алкоголя и стадии алкоголизма. Тест на алкогольдегидрогеназу сыворотки крови используется в диагностике алкоголизма и контроля эффективности лечения этого заболевания. Низкая активность АДГ при поражениях печени, в которой окисляется до 90% поступающего в организм этанола и других спиртов, или генетическая недостаточность этого фермента снижает обезвреживание алкоголя и усугубляет его отрицательное действие на функции систем организма. Работа 105. Определение ацетилирующей способности организма по выделению с мочой свободной и ацетилированной форм сульфаниламидов по А.М.Тимофеевой в модификации Г.А.Пономарева Процесс ацетилирования является одной из разновидностей реакций конъюгации ксенобиотиков, происходящих в клетках с участием ферментов. Ариламины, в том числе сульфаниламиды, подвергаются N-ацетилированию в организме и поэтому по выделению свободной и ацетилированной форм этих веществ можно оценить активность процесса ацетилирования. Реактивы. Соляная кислота, 10%-ный раствор; нитрит натрия, 0,5%-ный раствор, свежеприготовленный; ацетат натрия, насыщенный раствор; Н-кислота ацетилированная, свежеприготовленный 0,5%-ный раствор. Оборудование. Водяная баня; штатив с пробирками; пробки, обернутые фольгой; пипетки вместимостью 1 и 5 мл; ФЭК. Материал. Моча, содержащая свободный и ацетилированный сульфаниламиды. (Для получения мочи белым крысам вводят внутрижелудочно с помощью зонда порошок сульфадимезина из расчета 0,5 г на 1 кг массы тела в виде взвеси в 3 мл воды. Животных отсаживают на сутки в стеклянные выделительные воронки для сбора мочи. Собранную мочу доводят дистиллированной водой до объема 25 мл и фильтруют через бумажный фильтр). Метод основан на способности диазотированного сульфаниламида при взаимодействии с ацетилированной Н-кислотой (1,6-аминооксинафталин-3,5-дисульфокислота) образовывать комплекс розового цвета, интенсивность которого пропорциональна концентрации сульфаниламида. Содержание суммы сульфаниламидов (ацетилированных и свободных) в моче устанавливают после гидролиза проб с соляной кислотой, в ходе которого происходит образование свободной формы сульфаниламида из ацетилированной. Ход определения. В две пробирки (одна для определения общего, а другая – свободного сульфадимезина) отмеривают по 1 мл разведенной в 20 раз мочи, по 1,5 мл дистиллированной воды и по 0,25 мл раствора соляной кислоты. В третью пробирку (контрольная) вносят 2,5 мл воды и 0,25 мл раствора соляной кислоты. Одну пробирку (для определения общего сульфадимезина) закрывают пробкой, обернутой фольгой, и ставят на гидролиз в кипящую водяную баню на 15 мин. Затем пробирку охлаждают. Во все три пробирки приливают по 2 капли раствора нитрита натрия, тщательно перемешивают содержимое и оставляют стоять 10 мин. Добавляют во все пробы по 1,5 мл насыщенного раствора ацетата натрия, закрывают пробирки пробками и энергично встряхивают их несколько раз. Прибавляют во все пробирки по 0,25 мл раствора ацетилированной Н-кислоты. Вновь перемешивают содержимое и оставляют стоять пробы на 15 мин для развития окрашивания. Измеряют экстинкцию опытных проб против контроля на ФЭКе при 440 нм (светофильтр синий) в кювете с толщиной слоя 0,5 см. Расчет проводят по формуле (Е2 – Е1)100 х = ——————— , Е2 где х – ацетилирующая способность организма, % ацетилированного сульфадимезина Е1 – экстинкция свободного сульфадимезина, содержащегося в пробе, не подвергшейся гидролизу; Е2 – экстинкция общего сульфадимезина (свободный + ацетилированный), содержащегося в пробе, подвергнутой гидролизу. Оформление работы. Занести значения экстинкции в тетрадь и рассчитать ацетилирующую способность организма по сульфадимезину. Сделать вывод о возможности метаболизма ксенобиотиков посредством ацетилирования и значении этого процесса. Практическое значение работы. По степени ацетилирования сульфаниламидов или других ксенобиотиков, подвергающихся в организме ацетилированию, судят об активности ферментной системы ариламинацетилтрансферазы в клетках, которая катализирует реакции ацетилирования (конъюгации) различных соединений. Для сульфаниламидов реакция ацетилирования является основным ведущим механизмом конъюгации, другие конъюгаты для большинства сульфаниламидов образуются в незначительном количестве. Ацетилирование приводит к инактивации (обезвреживанию) сульфаниламидов и выведению их из организма с мочой. Поэтому степень ацетилирования сульфаниламидов указывает также на соотношение бактериостатически активной и неактивной форм препаратов. Чем быстрее ацетилируется сульфаниламид, тем меньше его бактериостатическая активность Работа 106. Выявление ацетилирования (инактивации) гидразида изоникотиновой кислоты (ГИНК) в организме Реактивы. Реактив метаванадата аммония*; соляная кислота, 0,5 М раствор. Оборудование. Штатив с пробирками; пробки, обернутые фольгой; пипетки вместимостью 1 и 2 мл; водяная баня. Материал. Моча, содержащая свободную и ацетилированную формы ГИНК. (Для получения мочи белым крысам вводят порошок ГИНК в дозе 100 мг на 1 кг массы тела в виде взвеси в 3 мл воды через рот с помощью специального зонда. Крыс отсаживают на 12 ч в стеклянные выделительные воронки для сбора мочи. Объем мочи доводят водой до 10 мл и фильтруют через бумажный фильтр). Метод основан на выявлении свободной формы ГИНК, которая с метаванадатом аммония в кислой среде дает комплексное соединение коричнево-красного цвета. Разница в окраске между пробами мочи до и после гидролиза указывает на степень ацетилирования ГИНК в организме: 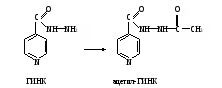 Ход определения. Собранную мочу разводят в 20 раз дистиллированной водой. В две пробирки вносят по 1 мл разведенной мочи; в одну из них (для определения общей ГИНК, т.е. суммы свободной и ацетилированной форм препарата) добавляют 1 мл раствора соляной кислоты, а во вторую (для выявления свободной ГИНК) – 1 мл дистиллированной воды. Первую пробирку закрывают пробкой и ставят на 20 мин на кипящую водяную баню, после чего охлаждают под струей водопроводной воды. В обе пробирки приливают по 2 мл реактива метаванадата аммония и отмечают разницу в окрашивании исследуемых проб мочи. Оформление работы. По разнице в окраске проб мочи дать примерную оценку степени ацетилирования ГИНК в организме и указать на значение этой реакции для практики. Практическое значение работы. Реакция N-ацетилирования ГИНК осуществляется специальной ацетилтрансферазой, содержащейся в различных тканях организма. В зависимости от активности этого фермента у разных людей их делят на быстрых и медленных «инактиваторов» (ацетиляторов) ГИНК, что имеет значение не только для практической фармакогенетики, но и для рациональной терапии. По степени ацетилирования ГИНК устанавливается эффективная индивидуальная доза препарата для конкретного больного.
биологических мемебран Пероксидное (перекисное) окисление липидов молекулярным методом представляет собой цепной свободно-радикальный процесс. Наиболее легко подобным образом окисляются ненасыщенные липиды или свободные жирные кислоты, входящие в состав фосфолипидов биологических мембран. Поэтому скорость пероксидного окисления липидов прежде всего оказывает влияние на функцию мембран и на развитие в них патологических изменений. Зарождение этого процесса связывают с появлением в среде, например, пероксидного радикала НО2˙, возникающего при окислении Fe2+ молекулярным кислородом: Fe2+ + O2 + H+ → Fe3+ + HO2˙ Пероксидный радикал может реагировать с молекулой ненасыщенного липида или свободной жирной кислоты (RH) биомембран. При этом образуется липидный радикал R˙. HO2˙ = RH →H2O2 + R˙ , 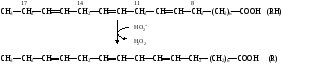 который запускает цепную реакцию окисления липидов (стадия инициирования, или зарождения цепей). Образование R˙ связано с отрывом атома водорода от углерода, находящегося в α-положении к двойной связи, например, в положениях 8, 11, 14 и 17 линоленовой кислоты: который запускает цепную реакцию окисления липидов (стадия инициирования, или зарождения цепей). Образование R˙ связано с отрывом атома водорода от углерода, находящегося в α-положении к двойной связи, например, в положениях 8, 11, 14 и 17 линоленовой кислоты:Если радикал образуется при отрыве атома водорода в положении 11 или 14, то электрон неспаренной валентности делокализуется, что приводит к появлению молекул липида с двумя сопряженными двойными связями (диеновые конъюгаты), имеющих максимум поглощения при 233 нм. В присутствии кислорода радикал R˙ дает новый свободный радикал липида – пероксидный RO2˙. 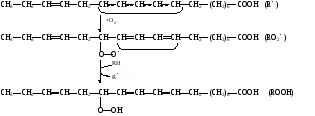 Пероксидный радикал может взаимодействовать с новой молекулой жирной кислоты RH с образованием гидропероксида (гидроперекиси) липида ROOH и очередного липидного радикала R˙; Пероксидный радикал может взаимодействовать с новой молекулой жирной кислоты RH с образованием гидропероксида (гидроперекиси) липида ROOH и очередного липидного радикала R˙;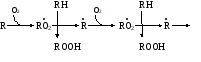 Причем сопряженные двойные связи (диеновая конъюгация), отмеченные в формулах скобкой, сохраняются в гидропероксидах липидов, образующих при свободнорадикальном окислении таких полиненасыщенных жирных кислот, как линолевая, линоленовая, арахидоновая. Две последние реакции сохраняют присутствие радикалов RO2 и R в системе, обеспечивая продолжение цепного окисления липидов: Причем сопряженные двойные связи (диеновая конъюгация), отмеченные в формулах скобкой, сохраняются в гидропероксидах липидов, образующих при свободнорадикальном окислении таких полиненасыщенных жирных кислот, как линолевая, линоленовая, арахидоновая. Две последние реакции сохраняют присутствие радикалов RO2 и R в системе, обеспечивая продолжение цепного окисления липидов:Подобная цепь пероксидного окисления липидов называется неразветвленной. Длина ее зависит от числа радикалов RO2˙, которые «ведут» цепное окисление. Каждый радикал приводит к образованию нескольких молекул ROOH, по числу которых судят о длине неразветвленных цепей пероксидного окисления липидов. Следовательно, первичными продуктами пероксидного окисления липидов являются гидропероксиды липидов, среди которых определенный процент падает на диеновые конъюгаты. При разложении накопившихся гидропероксидов липидов с участием Fe2+ появляется новый радикал – RO (оксидный радикал жирной кислоты, или алкоксидный радикал): ROOH + Fe2+ → RO + OHˉ + Fe3+ 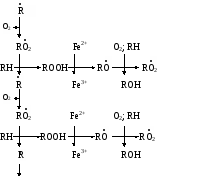 Далее пероксидное окисление липидов развивается по разветвленному механизму: Далее пероксидное окисление липидов развивается по разветвленному механизму:При этом накапливаются другие продукты пероксидного окисления липидов: спирты, кетоны, эпоксиды, альдегиды и диальдегиды и т.д. Среди диальдегидов представляет интерес малоновый диальдегид CH2(CHO)2, который образуется при свободнорадикальном окислении линоленовой и арахидоновой кислот, но не олеиновой или линолевой. Его определение служит одним из методов исследования пероксидного окисления липидов. Пероксидное окисление фосфолипидов и ненасыщенных жирных кислот, входящих в состав биомембраны, может полностью разрушить ее липидную основу. Однако этому препятствует взаимодействие радикалов R˙ и RO2 друг с другом, реакция тех же радикалов с Fe2+ и взаимодействие радикалов с антиоксидантами. При этом в первых двух реакциях образуются молекулярные продукты, а в третьей – малоактивные радикалы антиоксиданта, что вызывает обрыв цепей свободнорадикального окисления. В клетках выделяют два типа пероксидного окисления липидов – ферментный и неферментный, которые отличаются рядом признаков. Ферментная система требует участия ферментного белка (поэтому в отличие от неферментной инактивируется нагреванием), пирофосфата, ионов железа и в качестве восстановителя НАДФ·Н (НАДФ·Н-зависимая ферментная система пероксидного окисления, НЗП). Неферментная система нечувствительна к нагреванию; она требует ионов железа и аскорбата в качестве восстановителя (аскорбат-зависимое неферментное пероксидное окисление, АЗП). Отличительным признаком этих двух систем служит чувствительность к ионам железа, пирофосфата и фосфата. Система НЗП имеет очень высокое сродство к ионам железа, поэтому достаточно следовых количеств их для протекания максимальной скорости реакций. Для тех же условий АЗП требует значительных концентраций ионов железа, которые добавляются в среду при исследовании этого процесса в клетках. Активность НЗП резко усиливается пирофосфатом и угнетается фосфатом, тогда как АЗП ингибируется обоими веществами. Наиболее активны обе системы пероксидного окисления в мембранах микросом. Обнаружено также пероксидное окисление липидов, особенно АЗП, в митохондриях, лизосомах, мембранах эритроцитов и т.д. Накопление таких продуктов пероксидного окисления, как гидропероксиды липидов, приводит к ингибированию многих ферментных белков и нарушает их функцию. Кетоны, альдегиды и диальдегиды образуют ковалентные внутримолекулярные и межмолекулярные связи («сшивки») и с функциональными группами белков и других биомолекул, что также ведет к изменениям клеточных функций. Развитию свободнорадикальных реакций окисления липидов способствуют прооксиданты, а сдерживают его ингибиторы – антиоксиданты. К последним относятся α-токоферол, селен, некоторые гормоны (тироксин, стероидные) и т.д. От вредного действия гидропероксидов липидов клетку защищает ферментная система глутатионпероксидазы, разрушающая эти вещества. Для исследования процессов пероксидного окисления липидов используются методы: а) определения продуктов пероксидного окисления липидов; б) регистрации свободных радикалов в ходе реакции; в) определения антиокислительной (антиоксидантной) активности тканей. Первые два наиболее просты для выполнения и нашли широкое применение, в частности, метод определения наиболее изученного продукта пероксидного окисления – малонового диальдегида. Работа 107. Определение чувствительности эритроцитов к пероксидному гемолизу Реактивы. Фосфатный буфер, 1М раствор с рН 7,4*; хлорид натрия, 170 г/л раствор; рабочий свежеприготовленный раствор хлорида натрия, объем смеси доводят до 1 л и перед употреблением насыщают кислородом воздуха путем встряхивания; фосфатный буфер, 0,17 М раствор с рН 7,4х; раствор гидрохлорида натрия, приготовленный на фосфатном буфере (0,17 М фосфатный буфер и 1%-ный раствор NaCl в соотношении 1:3 по объему); изотонический спиртовой раствор эргокальциферола Д2 (продажный препарат 0,5%-ного спиртового раствора эргокальциферола разбавляют в 50 раз раствором гидрохлорида натрия на фосфатном буфере); аммиачный раствор (растворяют 1 мл концентрированного раствора аммиака в колбе вместимостью 250 мл); ацетат α-токоферола, 5%-ный масляный раствор. Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 5 и 10 мл; стеклянные палочки; центрифуга с центрифужными весами; термостат, отрегулированный на 38˚С; ФЭК или спектрофотометр. Материал. Кровь, взятая из пальца. а. Определение спонтанного гемолиза по Ягеру. Метод основан на определении при 540 нм экстинкции внеэритроцитарного гемоглобина, поступающего в среду вследствие спонтанного лизиса мембран эритроцитов, вызванного пероксидным окислением липидов кислородом воздуха. Ход определения. В пробирку с 7,5 мл рабочего раствора хлорида натрия добавляют 0,1 мл крови. Готовят суспензию эритроцитов, втягивая и выдувая жидкость с помощью пипетки. Центрифугируют взвесь 10 мин при 1000 об/мин, надосадочную жидкость осторожно отсасывают. К осадку эритроцитов добавляют 7,5 мл рабочего раствора хлорида натрия и вновь суспензируют тем же способом. В три центрифужные пробирки наливают по 1 м приготовленной суспензии: в первые две пробирки прибавляют по 4 мл рабочего раствора хлорида натрия; а в третью – 4 мл дистиллированной воды (для полного гемолиза). Пробы перемешивают стеклянной палочкой и ставят на 2 ч в термостат при 38˚С. По окончании инкубации содержимое пробирок перемешивают, центрифугируют 10 мин при 1000 об/мин и измеряют экстинкцию всех проб против дистиллированной воды на ФЭКе или спектрофотометре при 540 нм (светофильтр зеленый) в кювете с толщиной слоя 1 см. Расчет проводят по формуле (Е1 + Е2)100 х = ———————— , 2Е3 где х – степень гемолиза, %; Е1 и Е2 – экстинкции первой и второй проб; Е3 – экстинкция третьей пробы. б. Исследование гемолитического действия витамина D2 (эргокальциферола) по В.Б.Спиричеву и Н.В.Блажеевич. Метод основан на определении при 540 нм экстинкции внеэритроцитарного гемоглобина, выход которого усиливается с помощью витамина D2, запускающего пероксидное окисление липидов в мембранах эритроцитов. α-токоферол как антиоксидант уменьшает гемолитическую активность эргокальциферола. Ход определения. В три пробирки вносят по 0,1 мл крови. В одну предварительно наливают 4 мл изотонического раствора эргокальциферола (прооксидант), а в другую – тот же объем раствора эргокальциферола и 1 каплю раствора ацетата α-токоферола (антиоксидант), в третью – 4 мл раствора хлорида натрия на фосфатном буфере (контроль). Суспензируют эритроциты во всех пробах, втягивая и выдувая жидкость с помощью пипетки, и оставляют стоять при 20-22˚С. Через 30 мин пробы центрифугируют в течение 10 мин при 3000 об/мин, отбирают 0,1 мл надосадочной жидкости в три чистые пробирки и прибавляют в них по 5 мл аммиачного раствора. Осадок эритроцитов в центрифужных пробирках вновь суспензируют, втягивая и выдувая жидкость пипеткой, и оставляют их стоять при 20-22˚С еще на 30 мин. По истечении этого времени пробы вновь центрифугируют в том же режиме, отбирают по 0,1 мл надосадочной жидкости в три чистые пробирки и приливают в них по 5 мл аммиачного раствора. После добавления аммиачного раствора все шесть пробирок закрывают кусочком фольги и энергично встряхивают содержимое 2 мин. Затем измеряют экстинкцию в пробах против контроля на ФЭКе или на спектрофотометре при 540 нм (светофильтр зеленый) в кювете с толщиной слоя 1 см. Расчет проводят по формуле Е3100 Е2100 х = ———— и А = ————— , Е1 Е1 где х – степень гемолиза при добавлении эргокальциферола, %; Е1 – экстинкция пробы с эргокальциферолом; Е3 – экстинкция контрольной пробы; А – степень гемолиза после совместного добавления эргокальциферола и α-токоферола, % Е2 – экстинкция пробы с эргокальциферолом и α-токоферолом. Торможение антиоксидантом пероксидного окисления (в %) рассчитывают по формуле |
