biokhimia_Vosstanovlen (Восстановлен). Предмет и задачи биологической химии. Обмен веществ и энергии, сложная структурная организация, гомеостаз и самовоспроизведение как важнейшие признаки живой материи
 Скачать 2.96 Mb. Скачать 2.96 Mb.
|
Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn2+- или Мn2+-содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам. Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды. В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот. В. Защита клеток от действия протеаз Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что:
В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены 46. Всасывание продуктов переваривания. Транспорт аминокислот в клетки кишечника. Особенности транспорта аминокислот в гепатоцитах. γ-глутамильный цикл. Нарушения переваривания белков и транспорта аминокислот. Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь (рис. 9-4). Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Nа+-зависимых механизмов симпорта, подобно переносу глюкозы (см. раздел 7). Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортных систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот:
Причём к числу Nа+-зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин). Аминокислоты конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина. Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Она получила название γ-глутамильного цикла . 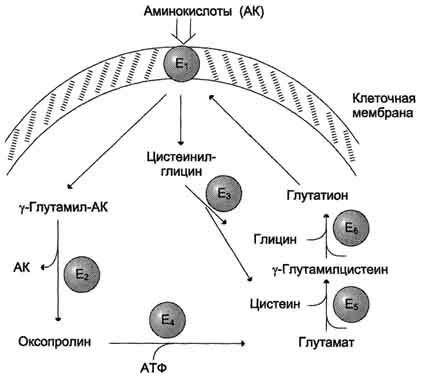 Рис. 9-5. γ-Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Е1 - γ-глутамилтрансфераза; Е2 - у-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза. 47. Витамины. Классификация, номенклатура. Провитамины. Гипо-, гипер- и авитаминозы, причины возникновения. Витаминзависимые и витаминрезистентные состояния. Витамины - низкомолекулярные органические соединения, поступающие в организм с пищей и обеспечивающие нормальное протекание биохимических и физиологических процессов. Витамины не включаются в структуру тканей и не используются в качестве источника энергии. Классификация витаминов. Витамины делятся на две группы: витамины, растворимые в воде и витамины, растворимые в жирах. Водорастворимые витамины - В1, В2, В6, В12, РР, Н, С, фолиевая кислота, пантотеновая кислота. Жирорастворимые витамины - А, Д, Е, К. Для каждого витамина, кроме буквенного обозначения, существует химическое и физиологическое название. Физиологическое название, как правило, состоит из приставки анти- и названия заболевания, развитие которого предупреждает витамин (например, витамин Н - антисеборрейный). Провитамины. Некоторые витамины могут синтезироваться непосредственно в организме человека. Соединения, служащие предшественниками для синтеза витаминов в клетках организма человека, называются провитаминами. Например, провитамином витамина А является каротин, витамина D2 - эргостерол, D3 - 7-дегидрохолестерол. Биологическая роль витаминов. Витамины, попадая в организм, превращаются в свою активную форму, которая и принимает непосредственное участие в биохимических процессах.Биологическая роль водорастворимых витаминов заключается в том, что они входят в состав коферментов, участвующих в метаболизме белков, жиров и углеводов в клетках организма человека. Болезни нерационального потребления витаминов. Для обеспечения нормального протекания биохимических процессов, в организме человека должен поддерживаться определённый уровень концентрации витаминов. При изменении этого уровня развиваются заболевания с симптомами, харктерными для каждого витамина. Гипервитаминозы - заболевания, вызванные избыточным содержанием витаминов в организме. Характерны для жирорастворимых витаминов, способных накапливаться в клетках печени. Чаще всего встречаются гипервитаминозы А и D, связанные с передозировкой их лекарственных препаратов. Гипервитаминоз А характеризуется общими симптомами отравления: сильными головными болями, тошнотой, слабостью. Гипервитаминоз D сопровождается деминерализацией костей, кальцинацией мягких тканей, образованием камней в почках. Гиповитаминозы - заболевания, вызванные недостатком витаминов в организме. Первичные гиповитаминозы связаны с нарушением процессов поступления витаминов в организм при: 1. недостатке витаминов в пище; 2. ускоренном распаде витаминов в кишечнике под действием патогенной микрофлоры; 3. нарушении синтеза витаминов кишечной микрофлорой при дисбактериозе; 4. нарушении всасывания витаминов; 5. приеме лекарственных препаратов - антивитаминов. Вторичные гиповитаминозы связаны с нарушением процессов превращения витаминов в их активные формы в клетках организма человека. Причиной могут служить генетические дефекты или нарушения биохимических процессов при различных заболеваниях органов и тканей. Авитаминозы - заболевания, вызванные полным отсутствием витамина в организме. 48. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
Биологические мембраны представляют собой "ансамбли" липидных и белковых молекул, удерживаемых вместе с помощью нековалентных взаимодействий.Основу мембраны составляет двойной липидный слой,в формировании которого участвуют фосфолштиды и гликолипиды. Липидный бислой образован двумя рядами липидов, гидрофобные радикалы которых спрятаны внутрь, а гидрофильные группы обращены наружу и контактируют с водной средой. Белковые молекулы как бы "растворены" в липидном бислое. Каждая мембрана клетки замкнута, т.е. имеет внутреннюю и внешнюю поверхности, различающиеся по липидному и белковому составам - эту особенность мембран называют трансмембранной(поперечной) асимметрией. Липидная асимметрия возникает прежде всего потому, что липиды с более объёмными полярными "головками" стремятся находиться в наружном монослое, так как там площадь поверхности, приходящаяся на полярную "головку", больше. Фосфатадилхолины и сфингомиелины локализованы преимущественно в наружном монослое, а фосфатидилэтаноламины и фосфатидилсерины в основном во внутреннем. Липиды в некоторых биологических мембранах с довольно большой частотой мигрируют с одной стороны мембраны на другую, т.е. совершают "флип-флоп" (от англ, flip-flop) перескоки. Перемещение липидных молекул затрудняют полярные "головки", поэтому липиды, находящиеся на внутренней стороне мембраны, имеют относительно высокую скорость трансмембранной миграции по сравнению с липидами наружной стороны мембраны, мигрирующих медленнее или вообще не совершающими "флип-флоп" перескоки. 3. Жидкостностъ мембран Для мембран характерна жидкостность (текучесть), способность липидов и белков к латеральной диффузии. Скорость перемещения молекул зависит от микровязкости мембран, которая, в свою очередь, определяется относительным содержанием насыщенных и ненасыщенных жирных кислот в составе липидов. Микровязкость меньше, если в составе липидов преобладают ненасыщенные жирные кислоты, и больше при высоком содержании насыщенных жирных кислот. Ацильные (алифатические) остатки ненасыщенных жирных кислот имеют так называемые "изломы" (. Эти "изломы" препятствуют слишком плотной упаковке молекул в мембране и делают её более рыхлой, а следовательно и более "текучей". На текучесть мембран также влияют размеры углеводородных "хвостов" липидов, с увеличением длины которых мембрана становится более "текучей". Клеточные мембраны обладают избирательной проницаемостью: через них медленно диффундируют глюкоза, аминокислоты, жирные кислоты, глицерол и ионы, причем сами мембраны в известной мере активно регулируют этот процесс — одни вещества пропускают, а другие нет. Существует четыре основных механизма для поступления веществ в клетку или вывода их из клетки наружу: диффузия, осмос, активный транспорт и экзо- или эндоцитоз. Два первых процесса носят пассивный характер, то есть не требуют затрат энергии; два последних — активные процессы, связанные с потреблением энергии.Избирательная проницаемость мембраны при пассивном транспорте обусловлена специальными каналами — интегральными белками. Они пронизывают мембрану насквозь, образовывая своего рода проход. Для элементов K, Na и Cl есть свои каналы. Относительно градиента концентрации молекулы этих элементов движутся в клетку и из неё. При раздражении каналы натриевых ионов раскрываются, и происходит резкое поступление в клетку ионов натрия. При этом происходит дисбаланс мембранного потенциала. После чего мембранный потенциал восстанавливается. Каналы калия всегда открыты, через них в клетку медленно попадают ионы калия. 50. Липидный состав мембран - фосфолипиды, гликолипиды, холестерин. Белки мембран - интегральные, поверхностные, «заякоренные». Роль отдельных компонентов мембран в формировании структуры и выполнении функций. 1. Структура и свойства липидов мембран Мембранные липиды - амфифильные (амфипатические) молекулы, т.е. в молекуле есть как гидрофильные группы (полярные "головки"), так и алифатические радикалы (гидрофобные "хвосты"), самопроизвольно формирующие бислой. В большинстве эукариотических клеток они составляют около 30-70% массы мембраны . В мембранах присутствуют липиды трёх главных типов - фосфолипиды, гликолипиды и холестерол (холестерин). Липидный состав мембран различен, содержание того или другого липида, по-видимому, определяется разнообразием функций, выполняемых этими липидами в мембранах. Фосфолипиды. Все фосфолипиды можно разделить на 2 группы - глицерофосфолипиды и сфингофосфолипиды. Глицерофосфолипиды относят к производным фосфатидной кислоты. Наиболее распространённые глицерофосфолипиды мембран - фосфатидилхолины и фосфатидилэтаноламины. В мембранах эукариотических клеток обнаружено огромное количество разных фосфолипидов, причём они распределены неравномерно по разным клеточным мембранам. Эта неравномерность относится к распределению как полярных "головок", так и ацильных остатков . Каждый глицерофосфолипид, например фосфатидилхолин, представлен несколькими десятками фосфатидилхолинов, отличающихся друг от друга строением жирно-кислотных остатков. На долю глицерофосфолипидов (полярная группа - инозитол) приходится лишь 2-8% всех фосфолипидов, содержащихся в клеточной мембране эукариотов. Инозитол в составе фосфати-дилинозитолов может быть фосфорилирован по С4 (фосфатидилинозитол-4-монофосфат) или С4 и С5(фосфатидилинозитол-4,5-бисфосфат). В состав фосфатидил инозитол-4,5-бисфосфатов входят в основном ацильные остатки стеариновой или пальмитиновой (по первому положению глицерола) и арахидоновой (по второму положению) жирных кислот. Специфические фосфолипиды внутренней мембраны митохондрий - кардиолипины (дифосфатидилглицеролы), построенные на основе глицерола и двух остатков фосфатидной кислоты. Они синтезируются ферментами внутренней мембраны митохондрий и составляют около 22% от всех фосфолипидов мембраны. В плазматических мембранах клеток в значительных количествах содержатся сфингомиелины. Сфингомиелины построены на основе церамида - ацилированного аминоспирта сфингозина. Полярная группа состоит из остатка фосфорной кислоты и холина, этаноламина или серина. Сфингомиелины - главные липиды миелиновой оболочки нервных волокон. Гликолипиды. В гликолипидах гидрофобная часть представлена церамидом. Гидрофильная группа - углеводный остаток, присоединённый гликозидной связью к гидроксильной группе у первого углеродного атома церамида (рис. 5-5). В зависимости от длины и строения углеводной части различают цереброзиды, содержащие моно- или олигосахаридный остаток, и ганглиозиды, к ОН-группе которых присоединён сложный, разветвлённый олигосахарид, содержащий N-ацетилнейраминовую кислоту (NANA). Полярные "головки" гликосфинголипидов находятся на наружной поверхности плазматических мембран. В значительных количествах гликолипиды содержатся в мембранах клеток мозга, эритроцитов, эпителиальных клеток. Ганглиозиды эритроцитов разных индивидуумов различаются строением олигосахаридных цепей, проявляющих антигенные свойства. Холестерол. Холестерол присутствует во всех мембранах животных клеток. Его молекула состоит из жёсткого гидрофобного ядра и гибкой углеводородной цепи, единственная гидроксильная группа является "полярной головкой". Для животной клетки среднее молярное отношение холестерол/фосфолипиды равно 0,3-0,4, но в плазматической мембране это соотношение гораздо выше (0,8-0,9). Наличие холестерола в мембранах уменьшает подвижность жирных кислот, снижает латеральную диффузию липидов и белков, и поэтому может влиять на функции: мембранных белков. В составе мембран растений холестерола нет, а присутствуют растительные стероиды - ситостерол и стигмастерол. Если основная роль липидов в составе мембран заключается в стабилизации бислоя, то белки отвечают за функциональную активность мембран. Одни из них обеспечивают транспорт определённых молекул и ионов, другие являются ферментами, третьи участвуют в связывании цитоскелета с внеклеточным матриксом или служат рецепторами для гормонов, медиаторов, эйкозаноидов, липопротеинов, оксида азота (NO). На долю белков приходится от 30 до 70% массы мембран. Белки определяют особенности функционирования каждой мембраны. Особенности строения и локализации белков в мембранах Мембранные белки, контактирующие с гидрофобной частью липидного бислоя, должны быть амфифильными. Те участки белка, которые взаимодействуют с углеводородными цепями жирных кислот, содержат преимущественно неполярные аминокислоты. Участки белка, находящиеся в области полярных "головок", обогащены гидрофильными аминокислотными остатками. Белки мембран различаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его - интегральные белки, либо разными способами прикрепляться к мембране - поверхностные белки. Поверхностные белки Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя. Белки, образующие комплексы с интегральными белками мембраны Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника. Примерами таких комплексов могут быть са-хараза-изомальтаза и мальтаза-гликоамилаза . Возможно, связь этих пищеварительных ферментов с мембраной позволяет с высокой скоростью гидролизовать субстраты и усваивать продукты гидролиза клеткой. Белки, связанные с полярными «головками» липидов мембран Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными "головками" липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови. Закрепление с помощью мембранного "якоря" "Якорем" может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов , Роль мембранного "якоря" может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой - С14 или пальмитиновой - С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина. Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот "якорь" - часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны. Трансмембранные (интегральные) белки Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой (рис. 5-11). Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы,а неполярные контактируют с мембранными липидами. Такие белки называют "вывернутыми" по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности , Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH2). Гликозилированные белки Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина , Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии. Латеральная диффузия белков Некоторые мембранные белки перемещаются вдоль бислоя (латеральная диффузия) или поворачиваются вокруг оси, перпендикулярно его поверхности. Например, фермент фосфолипаза А2, связываясь с цитоплазматической поверхностью мембраны, может латерально перемещаться по поверхности бислоя и гидролизовать несколько тысяч фосфолипидов в минуту до тех пор, пока не отделится от мембраны. Латеральная диффузия интегральных белков в мембране ограничена, это связано с их большими размерами, взаимодействием с другими мембранными белками, элементами цитоскелета или внеклеточного матрикса. Белки мембран не совершают перемещений с одной стороны мембраны на другую ("флип-флоп" перескоки), подобно фосфолипидам. 51. Механизмы переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы. Любая молекула может пройти через липидный бислой, однако скорость пассивной диффузии веществ, т.е. перехода вещества из области с большей концентрацией в область с меньшей, может сильно отличаться. Для некоторых молекул это занимает столь длительное время, что можно говорить об их практической непроницаемости для липидного бислоя мембраны. Скорость диффузии веществ через мембрану зависит главным образом от размера молекул и их относительной растворимости в жирах. Легче всего проходят простой диффузией через липидную мембрану малые неполярные молекулы, такие как О2, стероиды, тиреоидные гормоны, а также жирные кислоты. Малые полярные незаряженные молекулы - СО2, NH3, Н2О, этанол, мочевина - также диффундируют с достаточно большой скоростью. Диффузия глицерола идёт значительно медленнее, а глюкоза практически не способна самостоятельно пройти через мембрану. Для всех заряженных молекул, независимо от размера, липидная мембрана непроницаема. Транспорт таких молекул возможен благодаря наличию в мембранах либо белков, формирующих в липидном слое каналы (поры), заполненные водой, через которые могут проходить вещества определённого размера простой диффузией, либо специфических белков-переносчиков, которые избирательно взаимодействуя с определёнными лигандами, облегчают их перенос через мембрану (облегчённая диффузия). Кроме пассивного транспорта веществ, в клетках есть белки, активно перекачивающие определённые растворённые в воде вещества против их градиента, т.е. из меньшей концентрации в область большей. Этот процесс, называемый активным транспортом, осуществляется всегда с помощью белков-переносчиков и происходит с затратой энергии. А. Строение и функционирование белковых каналов Каналы в мембране формируются интегральными белками, которые "прерывают" липидный бислой, образуя пору, заполненную водой. Стенки канала "выстилаются" радикалами аминокислот этих белков. Если каналы различают вещества только по размеру и пропускают все молекулы меньше определённой величины, по градиенту концентрации, т.е. служат фильтрами, то их называют"неселективные каналы", или "поры". Такие поры есть в наружной мембране митохондрий, где молекулы белкапорина образуют широкие гидрофильные каналы. Через них могут проходить все молекулы с молекулярной массой 10 кД и меньше, в том числе и небольшие белки. Селективные каналы, как правило, участвуют в переносе определённых ионов. Ионная селективность (избирательность) каналов определяется их диаметром и строением внутренней поверхности канала. Например, катионселективные каналы пропускают только катионы, так как содержат много отрицательно заряженных аминокислотных остатков. Открытие или закрытие селективных каналов регулируется либо изменением концентрации специфических регуляторов, таких как медиаторы, гормоны, циклические нуклеотиды, NO, G-белки, либо изменением трансмембранного электрохимического потенциала. Воздействие регуляторного фактора вызывает конформационные изменения каналообразующих белков, канал открывается и ионы проходят по градиенту концентрации. Транспорт веществ через каналы не приводит к конформационным изменениям белков и зависит только от разности концентраций веществ по обе стороны мембраны. Поэтому скорость транспорта веществ через такие каналы может достигать 106-108 ионов в секунду. Б. Облегчённая диффузия веществ В мембранах клеток существуют белки-транслоказы. Взаимодействуя со специфическим лигандом, они обеспечивают его диффузию (транспорт из области большей концентрации в область меньшей) через мембрану. В отличие от белковых каналов, транслоказы в процессе взаимодействия с лигандом и переноса его через мембрану претерпевают конформационные изменения. Кинетически перенос веществ облегчённой диффузией напоминает ферментативную реакцию. Для транслоказ существует насыщающая концентрация лиганда, при которой все центры связывания белка с лигандом заняты, и белки работают с максимальной скоростью Vmax. Поэтому скорость транспорта веществ облегчённой диффузией зависит не только от градиента концентраций переносимого лиганда, но и от количества белков-переносчиков в мембране. Существуют транслоказы, переносящие только одно растворимое в воде вещество с одной стороны мембраны на другую. Такой простой транспорт называют "пассивный унипорт". Некоторые транслоказы могут переносить два разных вещества по градиенту концентраций в одном направлении - пассивный симпорт, или в противоположных направлениях - пассивный антипорт . В. Строение и функционирование белков-переносчиков, осуществляющих активный транспорт Перенос некоторых лигандов (ионов, глюкозы, аминокислот) через мембраны происходит против градиента концентрации и сопряжён с затратой энергии (активный транспорт). Перенос лигандов через мембрану, связанный с затратой энергии АТФ, называют "первично-активный транспорт". 1. Первично-активный транспорт Перенос некоторых неорганических ионов идёт против градиента концентрации при участии транспортных АТФ-аз (ионных насосов). Все ионные насосы одновременно служат ферментами, способными к аутофосфорилированию и аутодефосфорилированию. АТФ-азы различаются по ионной специфичности, количеству переносимых ионов, направлению транспорта. В результате функционирования АТФ-азы переносимые ионы накапливаются с одной стороны мембраны. Наиболее распространены в плазматической мембране клеток человека Ма+,К+-АТФ-аза, Са2+-АТФ-аза и Н+,К+,-АТФ-аза слизистой оболочки желудка. Na+, К+-АТФ-аза Этот фермент-переносчик катализирует АТФ-зависимый транспорт ионов Na+ и K+ через плазматическую мембрану. Ка+,К+-АТФ-аза состоит из субъединиц α и β; α - каталитическая большая субъединица, a β - малая субъединица (гликопротеин). Активная форма транслоказы - тетрамер (αβ)2 Na+,К+-АТФ-аза отвечает за поддержание высокой концентрации К+ в клетке и низкой концентрации Na+. Так как Na+Д+-АТФ-аза выкачивает три положительно заряженных иона, а закачивает два, то на мембране возникает электрический потенциал с отрицательным значением на внутренней части клетки по отношению к её наружной поверхности. Са2+-АТФ-аза В цитозоле "покоящихся" клеток концентрация Са2+ составляет 10-7 моль/л, тогда как вне клетки она равна 2 10-3 моль/л. Поддерживает такую разницу Са2+-АТФ-аза локализована не только в плазматической мембране, но и в мембране ЭР. Фермент состоит из десяти трансмембранных доменов, пронизывающих клеточную мембрану. Между вторым и третьим доменами находятся несколько остатков аспарагиновой кислоты, участвующих в связывании кальция. Область между четвёртым и пятым доменами имеет центр для присоединения АТФ и аутофосфорилирования по остатку аспарагиновой кислоты. Са2+-АТФ-азы плазматических мембран некоторых клеток регулируются белком кальмодулином. Каждая из Са2+-АТФ-аз плазматической мембраны и ЭР представлена несколькими изоформами. Работа Са2+-АТФ-азы цитоплазматической мембраны по стадиям представлена на рис. 5-20. Нарушение активности Са2+-АТФ-азы при патологии. Одна из причин нарушения работы Са2+-АТФ-азы - активация перекисного окисления липидов (ПОЛ) мембран. Окислению подвергаются как ацильные остатки жирных кислот в составе фосфолипидов, так и SH-гpyппы в активном центре фермента. Нарушение структуры липидного окружения и структуры активного центра приводит к изменению кон-формации АТФ-азы, потере сродства к ионам кальция и способности к аутофосфорилированию. АТФ-аза перестаёт выкачивать ионы кальция из цитозоля клетки, повышается концентрация внутриклеточного кальция, Са2+ усиливает мышечное сокращение, возрастает тонус мышечной стенки, что приводит к повышению АД. Не последнюю роль нарушение функционирования Са2+-АТФ-азы играет в развитии атеросклероза, рака, иммунных патологий. 2. Вторично-активный транспорт Перенос некоторых растворимых веществ против градиента концентрации зависит от одновременного или последовательного переноса другого вещества по градиенту концентрации в том же направлении (активный симпорт) или в противоположном (активный антипорт). В клетках человека ионом, перенос которого происходит по градиенту концентрации, чаще всего служит Na+. Примером такого типа транспорта может служить Na+,Са2+-обменник плазматической мембраны (активный антипорт), ионы натрия по градиенту концентрации переносятся в клетку, а ионы Са2+против градиента концентрации выходят из клетки (рис. 5-21). По механизму активного симпорта происходят всасывание глюкозы клетками кишечника и реабсорбция из первичной мочи глюкозы, аминокислот клетками почек (рис. 5-22). Г. Перенос через мембрану макромолекул и частиц: эндоцитоз и экзоцитоз Траспортные белки обеспечивают перемещение через клеточную мембрану полярных молекул небольшого размера, но они не могут транспортировать макромолекулы, например белки, нуклеиновые кислоты, полисахариды или ещё более крупные частицы. Механизмы, с помощью которых клетки могут усваивать такие вещества или удалять их из клетки, отличаются от механизмов транспорта ионов и полярных соединений. Эндоцитоз Перенос вещества из среды в клетку вместе с частью плазматической мембраны называют"эндоцитоз". Путем эндоцитоза (фагоцитоза) клетки могут поглощать большие частицы, такие как вирусы, бактерии или обломки клеток. Захват больших частиц осуществляется в основном специализированными клетками - фагоцитами. Поглощение жидкости и растворённых в ней веществ с помощью небольших пузырьковназывают "пиноцитоз". Усвоение веществ механизмом эндоцитоза (пиноцитоза) характерно для всех клеток. Цикл эндоцитоза начинается в определённых участках плазматической мембраны, называемых"окаймлённые ямки". На долю окаймлённых ямок приходится всего 1-2% общей площади мембраны. Белок клатрин образует решётчатые структуры, связанные с углублениями на поверхности плазматической мембраны. Окаймлённые ямки втягиваются в клетку, сужаются у основания, отделяются от мембраны, образуя окаймлённые пузырьки (пиноцитозные пузырьки). Время жизни окаймлённых ямок невелико, они формируются в течение минуты, затем совершают цикл эндоцитоза. Вещества в составе пиноцитозных пузырьков не смешиваются с другими макромолекулами клетки. Они заканчивают свой путь в лизосомах, а мембранные компоненты пузырьков, содержащие клатрин, возвращаются в плазматическую мембрану. Эндоцитоз, происходящий с участием рецепторов, встроенных в окаймлённые ямки, позволяет клеткам поглощать специфические вещества. Макромолекулы или частицы связываются рецепторами и накапливаются в окаймлённой ямке. Затем следует погружение в клетку и отделение эндоцитозного пузырька, в составе которого находится поглощённое вещество, мембранные компоненты окаймлённой ямки и рецептор. В разные окаймлённые ямки могут быть встроены разные рецепторы. Экзоцитоз Макромолекулы, например белки плазмы крови, пептидные гормоны, пищеварительные ферменты, белки внеклеточного матрикса, липопротеиновые комплексы, синтезируются в клетках и затем секретируются в межклеточное пространство или кровь. Но мембрана непроницаема для таких макромолекул или комплексов, их секреция происходит путём экзоцитоза. Особенность экзоцитоза в том, что секретируемые вещества локализуются в пузырьках и не смешиваются с другими макромолекулами или органеллами клетки. В ходе экзоцитоза содержимое секреторных пузырьков выделяется во внеклеточное пространство, когда они сливаются с плазматической мембраной. В организме имеются как регулируемый, так и нерегулируемый пути экзоцитоза. Нерегулируемая секреция характеризуется непрерывным синтезом секретируемых белков, упаковкой их в транспортные пузырьки в аппарате Гольджи и переносом к плазматической мембране для секреции. Примером может служить синтез и секреция коллагена фибробластами для формирования межклеточного матрикса. Для регулируемой секреции характерны хранение приготовленных на экспорт молекул в транспортных пузырьках и их слияние с плазматической мембраной только при воздействии на клетку специфического стимула. | ||||||
