biokhimia_Vosstanovlen (Восстановлен). Предмет и задачи биологической химии. Обмен веществ и энергии, сложная структурная организация, гомеостаз и самовоспроизведение как важнейшие признаки живой материи
 Скачать 2.96 Mb. Скачать 2.96 Mb.
|
Мембранные рецепторыОчень часто у белков есть гидрофобные участки, которые взаимодействуют с липидами, и гидрофильные участки, которые находятся на поверхности мембраны клетки, соприкасаясь с водным содержимым клетки. Большинство мембранных рецепторов — именно такие трансмембранные белки. Многие из мембранных белков-рецепторов связаны с углеводными цепями, то есть представляют собой гликопротеиды. На их свободных поверхностях находятся олигосахаридные цепи (гликозильные группы), похожие на антенны. Такие цепочки, состоящие из нескольких моносахаридных остатков, имеют самые различные формы, что объясняется разнообразием связей между моносахаридными остатками и существованием α- и β-изомеров. Функция «антенн» — это распознавание внешних сигналов. Распознающие участки двух соседних клеток могут обеспечивать сцепление клеток, связываясь друг с другом. Благодаря этому клетки ориентируются и создают ткани в процессе дифференцировки. Распознающие участки присутствуют и в некоторых молекулах, которые находятся в растворе, благодаря чему они избирательно поглощаются клетками, имеющими комплементарные распознающие участки (так, например, поглощаются ЛПНП с помощью рецепторов ЛПНП). Два основных класса мембранных рецепторов — это метаботропные рецепторы и ионотропные рецепторы. Ионотропные рецепторы представляют собой мембранные каналы, открываемые или закрываемые при связывании с лигандом. Возникающие при этом ионные токи вызывают изменения трансмембранной разности потенциалов и, вследствие этого, возбудимости клетки, а также меняют внутриклеточные концентрации ионов, что может вторично приводитъ к активации систем внутриклеточных посредников. Одним из наиболее полно изученных ионотропных рецепторов является н-холинорецептор. Метаботропные рецепторы связаны с системами внутриклеточных посредников. Изменения их конформации при связывании с лигандом приводит к запуску каскада биохимических реакций, и, в конечном счете, изменению функционального состояния клетки. Основные типы мембранных рецепторов:
Рецепторы, связанные с G-белками, представляют собой трансмембранные белки, имеющие 7 трансмембранных доменов, внеклеточный N-конец и внутриклеточный C-конец. Сайт связывания с лигандом находится на внеклеточных петлях, домен связывания с G-белком — вблизи C-конца в цитоплазме. Активация рецептора приводит к тому, что его α-субъединица диссоциирует от βγ-субъединичного комплекса и таким образом активируется. После этого она либо активирует, либо наоборот инактивирует фермент, продуцирующий вторичные посредники. Рецепторы с тирозинкиназной активностью фосфорилируют последующие внутриклеточные белки, часто тоже являющиеся протеинкиназами, и таким образом передают сигнал внутрь клетки. По структуре это — трансмембранные белки с одним мембранным доменом. Как правило, гомодимеры, субъединицы которых связаны дисульфидными мостиками 52. Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Дегидрирование субстратов и окисление водорода как основной источник энергии для синтеза АТФ. 3.Эндергонические и экзергонические реакции Направление химической реакции определяется значением ΔG. Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими. Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую. Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими. Если абсолютное значение ΔG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии . 4. Сопряжение экзергонических и эндергонических процессов в организме В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора. Б. Характеристика высокоэнергетических фосфатов. Цикл АТФ-АДФ В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами . Разные фосфорилированные соединения обладают разным запасом свободной энергии. К группе высокоэнергетических фосфатов, помимо АТФ, относят енолфосфаты, ангидриды и фосфогуанидины. АТФ - молекула, богатая энергией, поскольку она содержит две фосфоангидридные связи (β, γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (рН 7,0, температура 37 °С), фактическое значение ΔG0' для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ) и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ. Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч. Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений . Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта". Г. Основные этапы трансформации энергии катаболических процессов Энергия освобождается в процессе ферментативного окисления метаболитов специфическими дегидрогеназами. В реакциях дегидрирования электроны и протоны переходят от органических субстратов на коферменты NAD- и FAD-зависимых дегидрогеназ. Электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных коферментов NADH и FADH2 к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. Восстановление молекулы О2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О. Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) - дыхательной цепью. Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в форме АТФ, а часть энергии рассеивается в вице тепла. Кроме того, электроны с высоким энергетическим потенциалом, возникающие при окислении различных субстратов, могут быть использованы в реакциях биосинтеза, для которых помимо АТФ требуются восстановительные эквиваленты, например NADPH. 53. Строение митохондрий и структурная организация дыхательной цепи. НАД-зависимые и флавиновые дегидрогеназы. Комплексы дыхательной цепи: НАДН-дегидрогеназа, убихинол-дегидрогеназа (цитохром C редуктаза), цитохром C оксидаза. 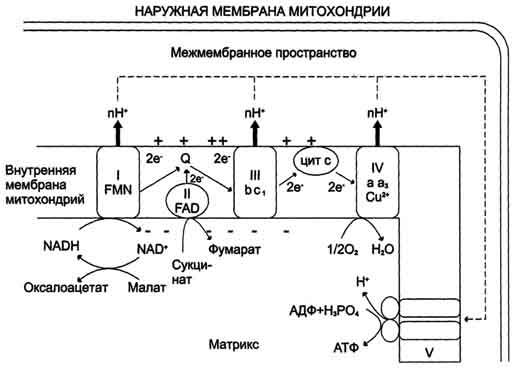 Рис. 6-13. Сопряжение дыхания и синтеза АТФ в митохондриях. I - NADH-дегидрогеназа; II - сукцинат дегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза; V - АТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ΔμН+ используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы. 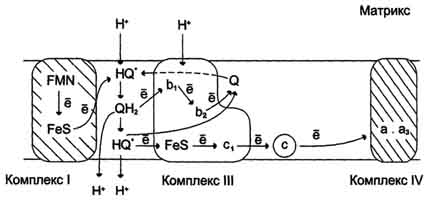 освобождает протон в водную фазу, превращаясь в семихинон (нq•). электрон от тема b1 переносится на fe3+ тема b2. hq• отдаёт второй электрон на fes-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передаётся на цитохром с1, а далее на цитохром с. окисленный q диффундирует к внутренней стороне мембраны, где получает электрон от тема b2 и протон из матрикса, превращаясь в нq•. нq• получает электрон от комплекса i и протон из матрикса; в мембране образуется qн2, и весь процесс повторяется сначала." align=bottom width=429 height=200 border=0> освобождает протон в водную фазу, превращаясь в семихинон (нq•). электрон от тема b1 переносится на fe3+ тема b2. hq• отдаёт второй электрон на fes-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передаётся на цитохром с1, а далее на цитохром с. окисленный q диффундирует к внутренней стороне мембраны, где получает электрон от тема b2 и протон из матрикса, превращаясь в нq•. нq• получает электрон от комплекса i и протон из матрикса; в мембране образуется qн2, и весь процесс повторяется сначала." align=bottom width=429 height=200 border=0>Рис. 6-14. Сопряжение переноса электронов через дыхательный комплекс III с транспортом Н+ через мембрану. Восстановленный убихинон (QH2) взаимодействует с Fе3+ гема b1 и, восстанавливая его, освобождает протон в водную фазу, превращаясь в семихинон (НQ•). Электрон от тема b1 переносится на Fe3+ тема b2. HQ• отдаёт второй электрон на FeS-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передаётся на цитохром с1, а далее на цитохром с. Окисленный Q диффундирует к внутренней стороне мембраны, где получает электрон от тема b2 и протон из матрикса, превращаясь в НQ•. НQ• получает электрон от комплекса I и протон из матрикса; в мембране образуется QН2, и весь процесс повторяется сначала. Таблица 6-4. Компоненты митохондриальной цепи переноса электронов
54. Окислительное фосфорилирование, сущность процесса, схема, субстраты, коэффициент Р/О. Трансмембранный электрохимический потенциал как промежуточная форма энергии при окислительном фосфорилировании. Теория Митчелла. Н+-АТФ-синтаза: роль, локализация, строение, механизм синтеза АТФ. Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием. А. Механизм сопряжения окисления и фосфорилирования Каким же образом осуществляется сопряжение этих двух процессов? Наиболее обоснованный ответ на этот вопрос даёт хемиосмотическая теория Митчелла, предложенная им в 1961 г. Основные положения были подтверждены и разработаны детально совместными усилиями многих исследователей в последующие годы.  Рис. 6-13. Сопряжение дыхания и синтеза АТФ в митохондриях. I - NADH-дегидрогеназа; II - сукцинат дегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза; V - АТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ΔμН+ используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.  Рис. 6-14. Сопряжение переноса электронов через дыхательный комплекс III с транспортом Н+ через мембрану. Восстановленный убихинон (QH2) взаимодействует с Fе3+ гема b1 и, восстанавливая его, освобождает протон в водную фазу, превращаясь в семихинон (НQ•). Электрон от тема b1 переносится на Fe3+ тема b2. HQ• отдаёт второй электрон на FeS-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передаётся на цитохром с1, а далее на цитохром с. Окисленный Q диффундирует к внутренней стороне мембраны, где получает электрон от тема b2 и протон из матрикса, превращаясь в НQ•. НQ• получает электрон от комплекса I и протон из матрикса; в мембране образуется QН2, и весь процесс повторяется сначала. В мембране существует стационарный общий фонд Q/QH2, из которого каждая молекула QH2 в одном цикле обеспечивает перенос протонов из матрикса в межмембранное пространство и электронов, которые в конечном итоге поступают на кислород. На работу, совершаемую при выкачивании протонов, расходуется часть свободной энергии, которая освобождается при переносе электронов по градиенту редокс-потенциала. Энергия электрохимического потенциала (∆μH+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы. 2. Строение АТФ-синтазы и синтез АТФ АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1 (рис. 6-15). 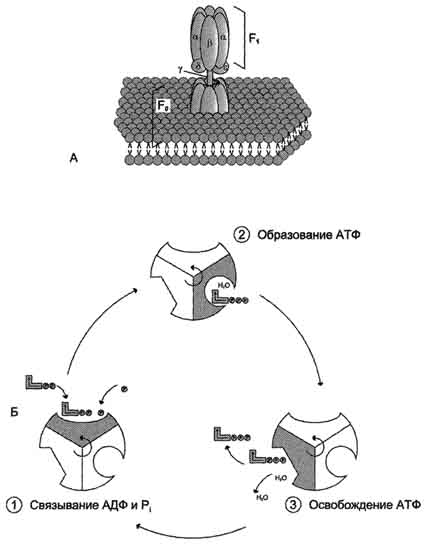 |
