biokhimia_Vosstanovlen (Восстановлен). Предмет и задачи биологической химии. Обмен веществ и энергии, сложная структурная организация, гомеостаз и самовоспроизведение как важнейшие признаки живой материи
 Скачать 2.96 Mb. Скачать 2.96 Mb.
|
Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей. Таким образом, биохимия состоит как бы из трех частей: 1) статическая биохимия (это анализ химического состава живых организмов); 2) динамическая биохимия (изучает совокупность превращения веществ и энергии в организме); 3) функциональная биохимия (исследует процессы, лежащие в основе различных проявлений жизнедеятельности). Главным для биохимии является выяснение функционального, то есть биологического назначения всех химических веществ и физико-химических процессов в живом организме, а также механизм нарушения этих функций при разных заболеваниях. Современная биохимия решает следующие задачи: 1. Биотехнологическую, т.е. создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок. 2. Проводит разработку новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков. 3. Проводит разработку методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками. 4. Изучает молекулярные основы памяти, психики, биоэнергетики, питания и целый ряд других задач. Рассматривая процессы, протекающие в живых организмах, следует обратить внимание на отличия этих организмов от неживых тел. Таких важнейших отличий несколько:
Биологическая химия изучает молекулярные процессы, лежащие в основе разви тия и функционирования организмов. Биохимия использует методы «молекуляр ных» наук — химии, физической химии, молекулярной физики, и в этом отноше нии биохимия сама является молекулярной наукой. Однако главные конечные задачи биохимии лежат в области биологии: она изучает закономерности биоло гической, а не химической формы движения материи. С другой стороны , «молекулярные изобретения» природы , открываемые биохимиками, находят приме нение в небиологических отраслях знания и в промышленности (молекулярная бионика, биотехнология). В таких случаях биохимия выступает в роли метода, а предметом исследований и разработок являются проблемы, выходящие за пре делы биологии. Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ включает 3 этапа: поступление веществ в организм, метаболизм и выделение конечных продуктов из организма. Поступление веществ в организм происходит в результате дыхания (кислород) и питания. В ЖКТ продукты питания перевариваются (расщепляются до простых веществ). При переваривании происходит гидролиз полимеров (белков, полисахаридов и других сложных органических веществ) до мономеров, всасывающихся в кровь и включающихся в промежуточный обмен. Промежуточный обмен (внутриклеточный метаболизм) включает 2 типа реакций: катаболизм и анаболизм. Катаболизм- процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека - СО2, Н2О и мочевина. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток. Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции). Анаболизмобъединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции). Практически любое заболевание начинается с по вреждения (нарушения) одной реакции в метабо лизме клетки, а затем оно распространяется на ткань, орган и целый организм. Нарушение метабо лизма ведет к нарушению гомеостаза в биологичес ких жидкостях организма человека, что сопровож дается изменением биохимических показателей. Большое значение клинико-биохимических методов исследования био логических жидкостей велико в медицине и важно для подготовки медицинских лаборатор ных техников. Достаточно напомнить, что только в крови человека можно определить современными методами биохимических исследований около 1000 показателей метаболизма. Биохимические показа тели биологических сред организма человека широко используются при: 1. постановке диагноза заболевания, особенно дифференциального диагноза; 2. выборе метода лечения; 3.контроле за правильностью назначенного ле чения; 4.результаты биохимических анализов служат одним из критериев излеченности патологическо го процесса; 5.скрининге (выявлении болезни на доклини ческой стадии); 6.мониторинге (контроле за течением заболе вания и результатом лечения); 7. прогнозе (информации о возможном исходе заболевания). 3. Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды. Биологическая роль аминокислот и пептидов. 1. Общие структурные особенности аминокислот, входящих в состав белков Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же ?-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение. В водных растворах при нейтральном значении рН ?- аминокислоты существуют в виде биполярных ионов. В отличие от 19 остальных ?-аминокислот, пролин - иминокислота, радикал которой связан как с ?-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру. 19 из 20 аминокислот содержат в ?-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного ?-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот. Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментативно превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к ?-углеродному атому. 2. Классификация аминокислот по химическому строению радикалов По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NH2), тиольная (-SH), амидная (-CO-NH2), гидроксильная (-ОН) и гуанидиновая группы. 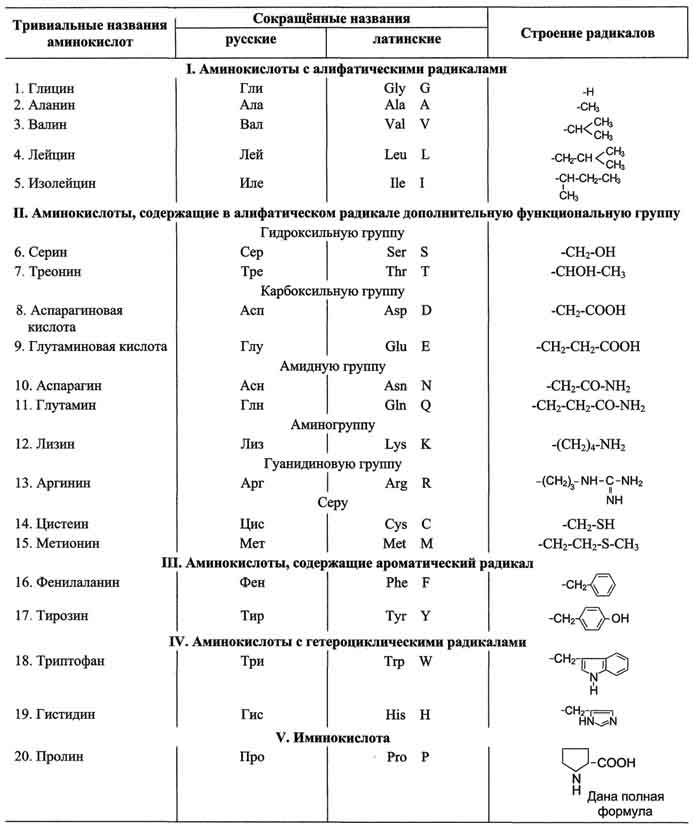 Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы 3. Классификация аминокислот по растворимости их радикалов в воде Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными. Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают). Аминокислоты с неполярными радикалами К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается. Аминокислоты с полярными незаряженными радикалами Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой. Аминокислоты с полярными отрицательно заряженными радикалами К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО- и Н+. Следовательно, радикалы данных аминокислот - анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом. Аминокислоты с полярными положительно заряженными радикалами Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, способная присоединять Н+, располагается в ?-положении алифатической цепи, а у аргинина положительный заряд приобретает, гуанидиновая группа, Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп - отдавать протон, теряя положительный заряд радикала. Положительно заряженные радикалы - катионы .Наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот. 4. Изменение суммарного заряда аминокислот в зависимости от рН среды При нейтральных значениях рН все кислотные (способные отдавать Н+) и все основные (способные присоединять Н+) функциональные группы находятся в диссоциированном состоянии. Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, - положительный заряд Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н+) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд. Напротив, увеличение концентрации ОН- групп вызывает отщепление Н+ от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд. 5. Модифицированные аминокислоты, присутствующие в белках Непосредственно в синтезе белков организма человека принимают участие только 20 перечисленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты - производные одной из этих 20 аминокислот. Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только после окончания их синтеза. Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства, необходимые для выполнения ими специфических функций. 6. Химические реакции, используемые для обнаружения аминокислот Для обнаружения и количественного определения аминокислот, находящихся в растворе, можно использовать нингидриновую реакцию. Эта реакция основана на том, что бесцветный нингидрин, реагируя с аминокислотой, конденсируется в виде димера через атом азота, отщепляемый от ?-аминогруппы аминокислоты. В результате образуется пигмент красно-фиолетового цвета. Одновременно происходит декарбоксилирование аминокислоты, что приводит к образованию СО2 и соответствующего альдегида. Нингидриновую реакцию широко используют при изучении первичной структуры белков Так как интенсивность окраски пропорциональна количеству аминокислот в растворе, её используют для измерения концентрации ?-аминокислот. Специфические реакции на отдельные аминокислоты Качественное и количественное определение отдельных аминокислот возможно благодаря наличию в их радикалах особенных функциональных групп. Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SH-группу данной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина - с помощью реакции Миллона. Б. Пептидная связь. Строение и биологические свойства пептидов 3.Биологическая роль пептидов В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью. Функции пептидов зависят от их первичной структуры. Ангиотензин I по структуре очень похож на ангиотензин II (имеет только две дополнительные аминокислоты с С-конца), но при этом не обладает биологической активностью. Изменение в аминокислотном составе пептидов часто приводит к потере одних и возникновению других биологических свойств. Так как пептиды - мощные регуляторы биологических процессов, их можно использовать как лекарственные препараты. Основное препятствие для терапевтического использования - их быстрое разрушение в организме. Одним из важнейших результатов исследований является не только изучение структуры пептидов, но и получение синтетических аналогов природных пептидов с целенаправленными изменениями в их структуре и функциях. Открытые и изученные в настоящее время пептиды можно разделить на группы по их основному физиологическому действию:
4.Первичная структура белков. Пептидная связь, ее характеристика. Зависимость биологических свойств белков от первичной структуры. Нарушение первичной структуры и функции гемоглобина А ( на примере гемоглобина S). Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура - простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты Если в образовании пептидной связи участвует иминогруппа пролина или гидроксипролина, то она имеет другой вид . При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов. Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи:
Исключение составляют пептидные группы с участием аминогруппы пролина или гидроксипролина. Они способны образовывать только одну водородную связь . Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью. Особенности первичной структуры белка. В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные группы) с относительно подвижными участками (—СНR), которые способны вращаться вокруг связей. Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве. 2.Характеристика пептидной связи Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу . Связь между ?-углеродным атомом и ?-аминогруппой или ?-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации. Пептидные связи обычно расположены в транс-конфигурации, т.е. ?-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве. Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки. В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein - белок, lysis - разрушение), называемых также протеазами, или пептидгидролазами. Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей). Химическая природа каждого белка уникальна и тесно связана с его биологической функцией. Способность белка выполнять присущую ему функцию определяется его первичной структурой. Даже небольшие изменения в последовательности аминокислот в белке могут привести к серьезному нарушению в его функционировании, возникновению тяжелого заболевания. Болезни, связанные с нарушениями первичной структуры белка, получили название молекулярных. К настоящему времени открыто несколько тысяч таких болезней. Одной из молекулярных болезней является серповидноклеточная анемия, причина которой кроется в нарушении первичной структуры гемоглобина. У людей с врожденной аномалией структуры гемоглобина в полипептидной цепочке, состоящей из 146 аминокислотных остатков, в шестом положении находится валин, тогда как у здоровых людей на этом месте — глутаминовая кислота. Аномальный гемоглобин хуже транспортирует кислород, а эритроциты крови больных имеют серповидную форму. Заболевание проявляется в замедлении развития, общей слабости организма. |
