Шпора по термодинамике. Предмет термодинамики. Химическая термодинамика
 Скачать 53.98 Kb. Скачать 53.98 Kb.
|
|
Предмет термодинамики. Химическая термодинамика. Термодинамика – это наука изучающая взаимный переход различных форм энергии. Предметом Т. является термодинамическая система. Химическая термодинамика изучает переходы энергии в химических реакциях. Термодинамика имеет дело только с макроскопическими объектами и нет понятия времени. А изучает только состояние системы. Понятие термодинамической системы. Наиболее общие характеристики системы. Термодинамическая система- это выбранная часть окружающего мира, имеющая реальные или условные границы, наполненная одним или несколькими веществами. Параметрысистемы: Объем, масса, температура, давление, концентрация компонентов. Классификация термодинамических систем. Изолированная- система, которая не отлает и не принимает энергию и вещество из окружающей среды. (идеальный термос) Закрытая – Система которая обменивается энергией, но не обменивается вещество с окружающим миром. (батарея, закрытая колба) Открытая- обменивается с окружающим миром и веществом, и энергией. (стакан с водой, открытая колба) Дать понятие о состояние системы. Равновесное, неравновесное, стационарное. Равновесная – система не обменивается с окружающей средой ни веществом, ни энергией и ее параметры не изменяются. Стационарное – когда система обменивается и веществом, и энергией, и ее параметры не изменяются Неравновесное - когда параметры изменяются. Системы гомогенные, гетерогенные. по структуре различают: - гомогенныесистемы, в которых структурные элементы распределены равномерно (свойства одинаковы в любой точке) ПР: плазма крови - гетерогенныесистемы, в которых структурные элементы распределены неравномерно и выделяют «фазы» и «границы раздела фаз» вода со льдом, масло и вода. 6. Дайте определение понятию фаза. Примеры однофазной и многофазной системы. Фаза – это та часть системы, в которой все ее элементы однородны в любой точке. Однофазные системы те, которые полностью однородны, например, вода, графит, пар. Многофазная система — это система которая содержит несколько фаз, и имеет границу раздела фаз. Например, вода и масло, вода и лёд, вода и камень. Переход из одной фазы в другую сопровождается выделением энергии. 7. Дайте определение функция системы. Примеры основных функций Это энергетические параметры, которые зависят от параметров системы, и не зависят от способа достижения состояния. Внутренняяэнергия–Е (U-в методичке). Складывается из кинетической энергии движения частиц в системе. из потенциальной энергии между частицами. И потенциальной движения химических связей. (в методички из Теплоты минус работа.). Е=Е2-Е1 Энтальпия - Н. Разница энтальпий является тепловой эффект. Складывается из внутренней энергии и работы (давление на разницу объемов). Энтропия–S. Состоит из теплоты, деленной на температуру. И энергияГиббса - G. Состоит из Энтальпия минус Энтропия, умноженная на температуру. 8. Полная энергия системы Это энергия движения частицы как целого. Складывается из Потенциальной (выстрел и притяжение к земле патроны) - обусловлено положением системы в каком-либо внешнем месте. И из Внутренней (атомы молекулы самой патроны) – которой обладают атомы и молекулы самой системы, и освобождающиеся при физической или химической процессах. 9. Внутренняя энергия системы. Внутренняяэнергия–Е (U-в методичке). Складывается из -кинетической энергии движения частиц в системе. -из потенциальной энергии между частицами. -И потенциальной- движения химических связей. (в методички из Теплоты минус работа.). Е=Е2-Е1 единицы размерности: ккал/мол; Дж/моль. Можно определить только изменение внутренней энергии. 10.Формы обмена энергии между системами. Работа–упорядоченная форма передачи энергии, сопровождающаяся переносом частиц в определенном направление (работа расширения). A=p∆V p-внешние давление Теплообмен- неупорядоченная форма передачи энергии. Происходит в результате хаотичного движения молекул и не сопровождается переносом вещества. 11. Работа. Определение и математическое выражение. Работа–упорядоченная форма передачи энергии, сопровождающаяся переносом частиц в определенном направление (работа расширения). A=p∆V p-внешние давление 12. Термодинамические процессы. Самопроизвольные и не самопроизвольные обратимые и не обратимые. Для закрытых и открытых систем. Самопроизвольный процесс идет без воздействия внешних сил. Как правило произвольность процесса можно вычислить, зная энергию Гиббса. Если энергия меньше 0, то реакция может идти самопроизвольно. Для изолированных систем нужно знать энтропию S. Если она больше нуля, то может идти самопроизвольно. При нуле она обратима. Обратимая– в которой может происходить явление возникновения обратного превращения масс вещества и обратного изменения внутренней энергии без ее потери во внешнюю среду. Необратимость- это невозможность после реакции получить исходные продукты реакции без дополнительных затрат. Все процессы в организме не обратимые так как идет обмен с окружающей средой. 13.14. Изохорные.Изобарные.Изотерм процессы. Тепловой эффект изохорных и изобарных процессов. Изохорный – объем постоянен. Q = U+ A; A=p∆V; V=0; p∆V=0; Q=∆U; Визохорном процессе тепловой эффект будет зависеть от разности внутренней энергии системы. Изобарный – постоянно давление. Тепловой эффект зависит от энтальпии. Q = U + A = U2- U1+ рV = U2- U1+ рV2- рV1 = (U2+ рV2)- (U1+ рV1) = Н2- Н1= Н Изотермический – температура постоянна. Зависимость давления от объема при постоянной температуре будет равно константа. Адиабатический процесс, происходящий без обмена энергии с окружающей средой. Q=0 15. первый закон термодинамики/ 16. термохимические уравнения их особенности примеры Разные формы энергии ни исчезают и не возникают из ничего, а лишь переходят из одной формы в другую в эквивалентных соотношениях. Для изолированной системы общий запас внутренней системы постоянен ∆U=0 Для закрытых систем энергия, полученная системой в форме теплоты, расходится на увеличение внутренней энергии и на работу.Q=∆E+A Особенности таких уравнений в том, что они содержат информацию о агрегатном состояние вещества, тепловой эффект реакции. 17.18. Энтальпия. Энтальпия - Н. это функция состояния системы, увеличение которой равна теплоте полученной системы при изобарном процессе. Разница энтальпий является тепловой эффект. Складывается из внутренней энергии и работы (давление на разницу объемов). при изобарном процессе система совершает работу расширения A = р V, поэтому Q = U + A = U2- U1+ р V = U2- U1+ р V2- р V1 = (U2+ р V2)- (U1+ р V1) = Н2- Н1= Н выражение Н = U + р V есть энтальпия Стандартная энтальпия образования ∆Н298 Энтальпия образования в стандартных условиях простого вещества равна нулю = 0. Энтальпия образования сложного вещества в стандартных условиях равна энтальпии реакции образования его из простых веществ обращенный к 1 молю вещества. 19. Закон Гесса Суммарный тепловой эффект системы не зависит от промежуточных состояний системы и путей переходов, а лишь от начального и конечного состояния системы. ПР: последовательная реакция 2С(т)+ О2(г) 2СО(г); 2СО + О2 2СО2 и простая реакция С + О2 СО2 ПР: реакции нейтрализации имеют один тепловой эффект для всех кислот и оснований (реакция Н++ ОН- Н2О) 20. Следствия законов Гесса 1) Тепловой эффект равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходных веществ. ∆Н=∑Нпрод.обр.-∑Нисход.обр 2) Тепловой эффект равен разности сумм теплот сгорания исходных веществ и сумм теплот сгорания продуктов реакции. ∆Н=∑Нисход.сгор. -∑Нпрдуктов.сгор. 3) Тепловой эффект вещества равен тепловому эффекту разложения с обратным знаком. ∆Нобраз=--∆Нразлож 4) Если протекает 2 реакции которые имеют одинаковые исходные вещества, но различные конечные продукты. То разница этих тепловых эффектов реакций будет равна тепловому эффекту перехода одного конечного вещества в другое. 5) различие энтальпий двух хим. реакций с разными конечными в-вами и одинаковыми исходными в-вами есть энтальпия перехода одних конечных в-в другие 21. Окисление БЖУ ккал и Дж
22. Применение первого закона термодинамики для живых систем 1) Живой организм является открытой системой - Энергия с– термодинамические процессы в живых организмах необратимые, многоступенчатые-последовательные -когда параметры системы не меняются, система находится в равновесии, -но равновесие динамическое - есть приток энергии и приток расходуемых исходных в-в потери энергии(теплоты) и удаление продуктов обмена в-в, на поддержание равновесия(гомеостаза) расходуется энергия Гиббса («свободная энергия») системы - приток энергии обеспечен притоком питательных в-в, которые подвергаются окислению часть энергии, выделяемой при окислении питательных в-в, превращается в энергию хим. Связей ПР: АТФ - живые организмы совершают работу, расходуя энергию Гиббса («свободную энергию») виды работы в живом организме – активный транспорт в-в ч/з клеточную мембрану, сокращение мышц, синтез белков. - энтропия живых организмов не максимальная (максимальная энтропия у мертвых организмов) 23.термодинамичское определение энтропии Энтропия – это функциональная характеристика системы, которая говорит о мере хауса т.е. о той энергии которая не может быть включена в упорядоченную работу при данной температуре. Энтропия — это количество приращенного тепла (т.е. получено-отданного тепла) относящиеся к температуре данной системы. 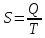 Энтропия – это мера связанной энергии, не вступающей в работу. Энтропия – это мера связанной энергии, не вступающей в работу. 24. Молекулярно- кинетическое определение энтропии. Уравнение Больцмана. Система стремится в самопроизвольных процессах к неупорядоченному состоянию. (т.о. энтропия есть мера вероятности пребывания системы в не упорядоченном состояние). Уравнение Больцмана: S=KlnW (S – абсолютное значение энтропии. K=R/Na=1.38*10-23 Дж- константа Больцмана W – число микросостояний) уравнение показывает чем больше включено микросостояний в систему тем выше энтропия. 25. 26, Изменение энтропии в процессах полимеризации и дезагрегации. И в общее ее изменение. Сумма энтропии мономеров больше чем у суммы полимеров. Так как при увеличении числа микросистем энтропия возрастает. Например, при употреблении в пищу белков, ни распадаются на мономеры во время переваривания и энтропия возрастает. Энтропия будет возрастать при переходе из твердого состояния в жидкое, и будет еще больше при переходе жидкости в пар(газ). Так же энтропия увеличивается при усложнение химического вещества. Так у метана энтропия меньше чем у этана. Еще энтропия возрастает при протекании в изолированных системах. Приводя систему из мало вероятной в более вероятную. 27. Следствие из закона Гесса для изменения энтропии. Изменение энтропии можно высчитать, используя первое следствие из закона Гесса. ∆S=∑Sпродуктов-∑Sисход. = KlnWпродуктов/Wисходных 28. Возможные формулировки второго закона термодинамики. -Любая изолированная система, предоставленная сама себе, изменяется в направление состояния обладающего максимальной вероятностью. -Энтропия изолированной системы возрастает в необратимом процессе и остается неизменной в обратимом. ОНА НИКОГДА НЕ УБЫВАЕТ. -Теплота может самопроизвольно передаваться только от более нагретого тела к менее нагретому. При передаче тепла в противоположном направление необходимо затратить работу. -Второй закон термодинамики позволяет предсказать в каком направление пойдет реакции, и какое будет конечное состояние. 29.Критерий самопроизвольного протекания процесса в изолированной системе. Самопроизвольно будут протекать те реакции, у которых энтропия будет больше нуля. Т.е. самопроизвольные процессы идут в направление от менее вероятного процесса к более вероятному. 30. Энергия Гиббса. Энтальпийная и Энтраопийная составляющая функции. Энергия Гиббса — это мера свободной энергии, превращающейся в работу. Энергия Гиббса свойственна для закрытых и открытых систем. G=H-TS ∆G=∆H-T∆G формула для изобарно-изотермического процесса. Самопроизвольная реакция в таких системах идет только при ∆G <0 H = U + рV U = H - рV H = TS + G G = H - TS в выражении G = H - TS различают энтальпийный и энтропийный факторы: - H есть энтальпийныйфактор энергии Гиббса G характеризует движение системы к состоянию с минимальной энтальпией - TS есть энтропийныйфактор энергии Гиббса G 31.ФормулировкавторогозаконатермодиннаосновеЭнергииГиббса. изменение энтропии S является критерием самопроизвольных процессов в изолированных системах: самопроизвольный термодинамический процесс идет, если энтропия системы увеличивается S > 0 самопроизвольный термодинамический процесс не идет, если энтропия системы уменьшается S < 0 в закрытых-открытых системах S не является критерием самопроизвольных процессов более общим критерием самопроизвольных процессов является энергия Гиббса энергияГиббса есть выражение G = H - TS энергия Гиббса G – функция термодинамического состояния изменение энергии Гиббса – критерий направления самопроизвольных процессов во всех системах 32. Соотношение энтальпийного и энтропийного факторов. характеризует движение системы к состоянию с максимальной энтропией соотношения этальпийного и энтропийного факторов в самопроизвольно протекающих процессах: самопроизвольный термодинамический процесс идет, если энергии Гиббса системы уменьшается G < 0 самопроизвольный термодинамический процесс не идет, если энергии Гиббса системы увеличивается G > 0 33. следствие закона Гесса на основе энергии Гиббса (для изобарно-изотермных процессов). Энергия Гиббса вычисляется по закону Гесса. По первому следствию. ∆G=∑∆Gпродуктов-∑∆Gисходных 34.Особенности термодинамики живых организмов. 1) организм обменивается с окружающей средой веществом и энергией 2) все живые организмы гетерогенные и многофазные 3) процессы в живых системах конечны и необратимы 4) живые системы находятся не в равновесном, а в стационарном состояние. Стационарное – это когда тело обменивается веществом и энергией, но ее параметры при этом не меняется. 5) приток энергии – это приток питательных веществ, она окисляется и часть энергии превращается в энергию химических связей 6) живые организмы расходуют энергию Гиббса 35.Энтропия в живых организмах При употреблении пищи мономеры распадаются на мономеры, что способствует увеличению энтропии. Но организм является открытой системой. Поэтому он обменивается с окружающей средой веществом и энергией. Тем самым уменьшая энтропию в своем организме (связанной энергии не способной работать). Синтез ВМВ в организме понижают энтропию. Энтропия увеличивается при старении. 36. экзергонических эндергонических химические реакции при экзергоническихпроцессах энергия Гиббса системы уменьшается, и система совершает работу ПР: при эндергонических процессах энергия Гиббса системы увеличивается, и над ней совершается работа для эндергонических процессов нужен внешний источник энергии 37. Понятие о стационарном состояние живого организма. Это состояние системы при котором она обменивается веществом и энергией, но ее параметры со временем не изменяются. В живом организме – это гомеостаз. 38. Принцип Пригожина о стационарном состояние живого организма. В стационарном состояние скорость возрастания энтропии, обусловленная протеканием необратимых процессов, имеет положительное и минимальное значение. Этот принцип применим для зрелого возраста. 39. Обратимые химические реакции. Понятие о химическом равновесии. обратимые – хим.р-ции, которые в данных условиях идут самопроизвольно и в прямом, и в обратном направлениях  А + В АВ «прямая» АВ А + В «обратная» А + В АВ Обратимость химической реакции зависит от химических параметров системы. При увеличении энергии Гиббса будет увеличивается вероятность обратимости. Химическоеравновесие – возникает тогда, когда скорость прямой реакции будет равна скорости обратной реакции. Но реакция не останавливается, и продолжает протекать из одной в другую. Энергия Гиббса равна нулю. Наступает при равновесной концентрации продуктов и исходных веществ. Признаки химического равновесия: 1) Состояние системы не зависит от того с какой стороны она подходит к равновесию – со стороны исходных веществ или со стороны продуктов реакции. 2) состояние системы остается неизменным при отсутствие внешних воздействий. 3) оно изменяется при изменение внешних воздействий, на сколько бы малы они не были. 40. Изменение скорости прямой и обратной реакции во времени. Скорость прямой реакции описывается уравнением: Скорость обратной реакции описывается уравнением: По мере того как концентрации веществ C и D возрастают, скорость обратной реакции растет Через некоторое время скоростипрямойиобратнойреакцийстановятсяравными 41. Условия протекания обратимых реакций почти до конца. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. 1) при увеличении давление равновесие будет смещаться в сторону образования веществ с меньшим объемом реакций. Например, N2+3H22NH3 из реакции следует что при увеличение будет смещаться сторону продуктов реакции, а при понижениидавлениесмещениеравновесиябудетвсторонуисходныхвеществ 2) при увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении в сторону экзотермической. При повышении температуры наша реакция сместиться в сторону исходных веществ. 3) при увеличении концентрации одного из исходных веществ равновесие смещается в сторону продуктов, при увеличении концентрации продуктов равновесие сместиться в сторону исходных веществ. 42.константа химического равновесия K=k1/k2 ∆G=-2.3RTlgK R=8.314Dg/moll*K T=298K K-константа равновесия КР- определяет полноту протекания реакции достижения равновесного состояния т.е. чем больше значение константы равновесия, тем в большей степени в равновесной реакционной смеси преобладают продукты реакции. Тем больше выход реакции. Константа равновесия связана с энергией Гиббса. 43. Уравнениеизотермыхим. Реакции. G =-RTlnK =-2,3RTlgK =-1,418TlgK самопроизвольный термодинамический процесс пойдет в сторону уменьшения энергии Гиббса G <0: если G <0, то идет хим. реакция если G = 0, то есть хим. равновесие если G> 0, то хим. реакция самопроизвольно идет в обратном направлении или хим. реакция идет в прямом направлении, но требует внешнего источника энергии 44. Принцип смещения равновесия Ле Шателье влияние различных факторов принципа Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие». 1) при увеличении давление равновесие будет смещаться в сторону образования веществ с меньшим объемом реакций. Например, N2+3H22NH3 из реакции следует что при увелиение будет смещаться сторону продуктов реакции, а при понижениидавлениесмещениеравновесиябудетвсторонуисходныхвеществ 2) при увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении в сторону экзотермической. При повышении температуры наша реакция сместиться в сторону исходных веществ. 3) при увеличении концентрации одного из исходных веществ равновесие смещается в сторону продуктов, при увеличении концентрации продуктов равновесие сместиться в сторону исходных веществ. |
