ЗадачиТ20 КоличАнализ(примеры №311-320). Примеры решения задач Пример 20. 1
 Скачать 71.19 Kb. Скачать 71.19 Kb.
|
|
Примеры решения задач Пример 20.1. К 15 мл 0,03 М раствора муравьиной кислоты добавили 12 мл 0,15 М формиата калия. Вычислить рН раствора (КHCOOH = 1,8 · 10–4; рКHCOOH = 3,75). Решение. Растворы слабых кислот или оснований в присутствии их солей проявляют буферное действие. Для буферного раствора, содержащего слабую кислоту и ее соль рН = рКа + lgсоли – lg Cкислоты , а для смеси из слабого основания и его соли рН = 14 – рКв + lg Соснования – lg Cсоли . Найдем концентрацию кислоты и ее соли после смешивания растворов. Vобщ. = 12 + 15 = 27 мл; Ссоли = 12 · 0,15 / 27 = 0,066 M; Cкислоты = 15 · 0,03 / 27 = 0,017 M; pH = 3,75 + lg 0,066 / 0,017 = 4,35. Пример 20.2. На титрование навески 0,3000 г химически чистого оксалата натрия (Na2C2O4) в кислой среде затрачено 37,8 мл раствора перманганата калия (KMnO4). Найти нормальную концентрацию раствора перманганата калия и титр этого раствора. Решение. В кислой среде идет реакция: 5Na2C2O4+ 2KMnO4 + 8H2SO4 = 2MnSO4+K2SO4+5Na2SO4 + 10CO2 + 8Н2О Соответствующие полуреакции можно записать следующим образом: MnO-4 + 5е + 8H+ → Mn2+ + 4Н2О C2O42- - 2е →2CO2 Массу титруемого вещества (прямое титрование) рассчитывают по формул 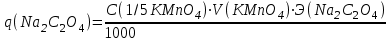 е: 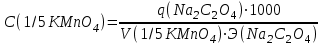 Молярная масса определяемого вещества (Na2C2O4) равна 133,98 г/моль, молярная масса эквивалента: Э (Na2C2O4) = 133,98/2 = 66,99 г/моль. Молярная масса перманганата калия: М (KMnO4) = 150,04 г/моль, молярная масса эквивалента: Э (KMnO4 ) = 150,04/5 = 31,61 г/моль. Молярные массы эквивалентов веществ в окислительно-восстановительных реакциях определяются с учетом числа электронов, принимающих участие в окислительно-восстановительном процессе. Подставив данные, делаем расчет: 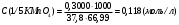 Т 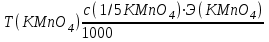 итр раствора KMnO4 можно рассчитать по формуле: 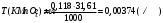 Пример 20.3. Вычислить потенциал медного электрода, помещенного в раствор, содержащий 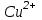 -ионы, относительно насыщенного хлорсеребряного электрода при 25С, если концентрация меди в растворе равна 0.5 моль/л. (Стандартный потенциал медного электрода равен 0.345 В; потенциал хлорсеребряного электрода (насыщенного) равен 0.201 В). -ионы, относительно насыщенного хлорсеребряного электрода при 25С, если концентрация меди в растворе равна 0.5 моль/л. (Стандартный потенциал медного электрода равен 0.345 В; потенциал хлорсеребряного электрода (насыщенного) равен 0.201 В). Решение. Потенциал медного электрода связан с концентрацией ионов меди уравнением Нернста: 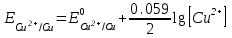 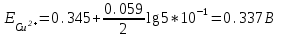 Потенциал одного электрода относительно другого определяют как разность потенциалов этих двух электродов, причем, всегда от большей величины вычитают меньшую. Следовательно, электродвижущая сила (ЭДС) элемента, составленного из медного и хлорсеребряного электродов, равна: 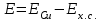 = 0.337-0.201=0.136 В = 0.337-0.201=0.136 В Пример 20.4. При полярографическом анализе сплава железа использовали стандартный раствор соли железа() с концентрацией 10-3 моль/л, при этом были получены следующие данные:
Определить массовую долю (%) железа в сплаве, если для анализа брали навеску 0.25 г сплава, которую после растворения перевели в мерную колбу вместимостью 100 мл. Для полярографирования использовали 10 мл полученного раствора; высота волны оказалась равной 18 мм. Решение. По приведенным данным для стандартного раствора соли железа строят градуировочную кривую в координатах h- v . По графику определяют, что волне высотой 18 мм соответствует объем раствора 2.2 мл; содержание железа в этом объеме равно 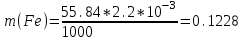 мг мгТак как анализу подвергали 10 мл, а всего было 100 мл исследуемого раствора, то 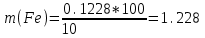 мг мгМассовая доля железа равна 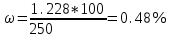 . .Пример 20.5. Для определения меди навеску сплава 0.6578 г после растворения подвергли электролизу в течение 20 минут при постоянном токе 0.2 А. Определить массовую долю (%) меди в сплаве, если учесть, что выход по току составляет 80%. Решение. В соответствии с законом Фарадея масса выделенной на катоде меди равна 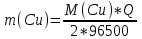 где Q – количество электричества (Кл), равное при постоянной силе тока Q=. Следовательно, 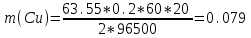 г. г.Массовая доля меди с учетом 80% выхода по току составляет:  Пример 20.6. Оптическая плотность (A) раствора бихромата калия в кювете с толщиной слоя L=3 см равна 0.750. Стандартный раствор этого вещества, содержащий 5 мг/л, имеет оптическую плотность А = 0.550 в кювете с толщиной 5 см. Найти концентрацию анализируемого раствора в мг/л и моль/л. Решение. Основной закон светопоглощения имеет форму: А = .L.С или A = lg l / T, где Т – коэффициент пропускания. Для нахождения концентрации С можно использовать метод стандарта. В соответствии с основным законом светопоглощения можно записать 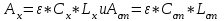 , где индексы «х» и «ст» относятся к анализируемому и стандартному растворам, соответственно. Т. к. коэффициент молярного поглощения (ε) для раствора бихромата калия величина постоянная в этих условиях, то из пропорции , где индексы «х» и «ст» относятся к анализируемому и стандартному растворам, соответственно. Т. к. коэффициент молярного поглощения (ε) для раствора бихромата калия величина постоянная в этих условиях, то из пропорции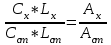 можно найти концентрацию анализируемого раствора 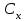 : :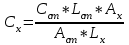 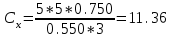 мг/л мг/лДля того чтобы выразить эту концентрацию в моль/л, необходимо найти молярную массу бихромата калия: М( 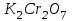 )=294.2 г/моль. Следовательно, концентрация моль/л равна: )=294.2 г/моль. Следовательно, концентрация моль/л равна:С( 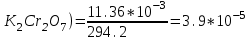 (моль/л) (моль/л)Пример 20.07.
Для анализируемого раствора после растворения пробы в мерной колбе вместимостью 1000 мл показание прибора составило 38 единиц. Найти массовую долю калия в пробе. Решение. Строим градуировочную зависимость в координатах = f(С) или вычисляем К - коэффициент линейности графика (К=/С). Находим концентрацию ионов калия (С=/К), которой соответствует показание прибора. Эта величина составляет 9.3 мг/л или 0.0093 г/л. Тогда 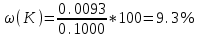 Задачи для самостоятельного решения 311. Вычислить рН буферных растворов, полученных при сливании растворов: а) 60 см3 0,01 М CH3COOH и 40 см3 0,05 М CH3COOK. б) 70 см3 0,01 М NH4Cl и 30 см3 0,05 М NH4OH. 312. На нейтрализацию 50 мл раствора щелочи израсходовано 30 мл 0,2 н. раствора Н2SO4. Какова нормальность раствора щелочи? Сколько 0,1 н. раствора HCl потребовалось бы для той же цели? 313. Навеску технического образца буры массой 10,938 г растворили в мерной колбе вместимостью 250,0 мл. На титрование затрачено 10,0 мл раствора HCl с концентрацией 0,420 моль/л. Рассчитать массовую долю (%) химически чистой буры (Na2B4O7 · 10H2O) в образце. 314. При построении градуировочного графика для определения марганца использовали стандартный раствор МnSO4 с концентрацией 1,2 . 10-3 моль/л, аликвотные части которого разбавляли буферным раствором в мерной колбе и полярографировали; при измерении высоты волны получили следующие результаты:
Рассчитать массовую долю (%) марганца в пробе, если навеска 0,1300 г вначале была переведена в мерную колбу емкостью 100 мл, а для анализа отбирались аликвотная часть 10 мл и полярографировалась; высота волны получилась 45,5 мм. 315. При анализе никелевой руды навеска пробы 2,2555 г после соответствующей обработки подвергалась электролизу при силе тока 1,25А в течение 20 мин. Определить массовую долю (%) никеля в руде при выходе по току 90%. 316. Молярный коэффициент поглощения водорастворимого комплекса никеля с диметилглиоксимом при 470 нм равен 1·104. Рассчитайте: а) оптическую плотность раствора комплекса, в 1 мл которого содержится 1 мкг никеля, при толщине поглощающего слоя L = 1,00 см; б) его пропускание; в) концентрацию никеля в растворе (мкг/ мл), если оптическая плотность раствора, содержащего диметилглиоксимат никеля, и помещенного в кювету с L = 3,00 см, равна 0,190 при 479 нм. Атомная масса никеля 58,69. 317. При определении железа в виде моносульфосалицилатного комплекса пропускание раствора, содержащего 0,115 мг металла в 25,00 мл раствора, равно 54,5 % при толщине поглощающего слоя L = 2,00 см. Рассчитайте молярный коэффициент поглощения комплекса. Атомная масса железа 55,85. 318. Для определения натрия в цеолитах навеску цеолита с массой 0,5000 г сплавили с содой, растворили в HCl и перенесли в мерную колбу вместимостью 1000 мл и измерили интенсивность сигнала (,усл.ед.=40). Натрий определяли методом градуировочного графика. Данные фотометрирования для стандартных растворов приведены ниже. Построить градуировочный график и определить массовую долю натрия в пробах. Результаты фотометрирования стандартных растворов
319. Для определения калия в стекле три его навески по 0,1000 г растворили в смеси Н2SO4 и HF, растворы упарили, остатки обработали разбавленной HCl и перенесли в мерные колбы объемом 250,0 мл. Во вторую и третью колбы добавили, соответственно, 10,00 мл и 20,00 мл стандартного раствора калия (С = 250 мкг/мл). Растворы разбавили водой до метки и фотометрировали в пламени светильный газ – воздух. Соответствующие значения интенсивностей (у.е.) равны 17,0, 26,0 и 35,0. Определите массовую долю (%) калия в стекле? 320.Смешаны равные объемы 0,001 М BaCl2 и 1,5·10–3 М Na2SO4. Вычислить концентрацию [Ba2+] в растворе, если ПР (Ba SO4 )= 1,1 · 10 –10. Как изменится растворимость BaSO4 в этой смеси по сравнению с растворимостью в воде? |
