реферат практики хирургии. Профилактика синдрома диабетической стопы
 Скачать 41.99 Kb. Скачать 41.99 Kb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего образования «Ставропольский государственный медицинский университет» Министерства здравоохранения РФ Кафедра факультетской хирургии с курсом урологии Заф. кафедрой: д.м.н., профессор Чумаков Петр Ильич Руководитель : Францев Роман Сергеевич Реферат на тему : Профилактика синдрома диабетической стопы Выполнил: Алавнех Момен Студент лечебного факультета Группа 413И Ставрополь , 2022 Синдром диабетической стопы (СДС) – это комплекс анатомо–функциональных изменений стопы у больного сахарным диабетом, связанный с диабетической нейропатией, ангиопатией, остеоартропатией, на фоне которых развиваются гнойно–некротические процессы [1]. В настоящее время выделяют три клинические формы синдрома диабетической стопы: нейропатическая, ишемическая, смешанная (нейроишемическая). Наиболее часто встречается нейропатическая форма СДС (60%). Окончательные цифры распространенности СДС не известны, так как это гетерогенное в патофизиологическом смысле осложнение [2]. Тем не менее установлено, что у 15% больных диабетом развиваются патологические изменения в стопах или голеностопном суставе за время болезни [3]. Анализ обращаемости больных сахарным диабетом за помощью в амбулаторных условиях показал, что частота встречаемости язв в зависимости от того, к какой категории сложности относится язва, колеблется от 57 до 94% [4,5]. Факторы риска развития СДС, по мнению ведущих специалистов, в настоящее время выглядят следующим образом: – периферическая сенсомоторная и автономная нейропатия; – хроническая артериальная недостаточность нижних конечностей; – деформации стоп; – предшествующие язвы и/или ампутации; – травма; – неправильно подобранная обувь; – социально–психологические факторы; – расовая принадлежность [6–8]. Факторы, предрасполагающие к язвообразованию у больных диабетом, можно представить следующим образом [9]: а) Факторы, снижающие сопротивляемость тканей травме: – патология крупных сосудов: атеросклероз, мужской пол, курение; – патология мелких сосудов; – автономная нейропатия; б) Факторы, увеличивающие вероятность травмы: – моторная нейропатия; – сенсорная нейропатия; – ограничение подвижности суставов; – другие осложнения диабета, включая нарушение остроты зрения; – осложнения, связанные с возрастом: шаткость походки, малоподвижность. Нейропатия Изменения в магистральных сосудах и наличие инфекционного процесса в стопе/стопах встречаются не только у больных сахарным диабетом. Именно наличие периферической сенсомоторной и автономной нейропатии делает проблему патологии стоп характерной для больных диабетом [10]. Такие состояния, как пожилой возраст, недостаток питания, воздействие токсинов, наличие нео– и паранеопластических процессов нервной системы, отягощенной наследственности и ряда заболеваний, также приводят к развитию нейропатии [11], но наиболее частой причиной анестезии с последующим язвообразованием является сахарный диабет [10]. Диабетическая нейропатия (ДН) – это симптомокомплекс, «вызванный дегенерацией периферических и автономных нервов у больных сахарным диабетом» [12,13]. Наличие тех или иных признаков нейропатии колеблется от 7% при стаже диабета 1 год до 50% с продолжительностью заболевания > 25 лет [14]. А если к числу пациентов, имеющих явные клинические признаки диабетической нейропатии, прибавить пациентов с субклиническими формами, то частота нейропатии может достичь 90% [14]. Многие симптомы и признаки нейропатии значительно снижают качество качество жизни больных сахарным диабетом [15]. Большинство периферических нервов содержат пять ветвей: мышечные, кожные, суставные, сосудистые и терминальные. Все ветви содержат чувствительные и автономные нейроны. Мышечные ветви всегда содержат только двигательные нейроны. В свою очередь, нервные волокна (нейроны) классифицируются на типы в зависимости от диаметра и характеристики проводимых импульсов (табл. 1) [7]. 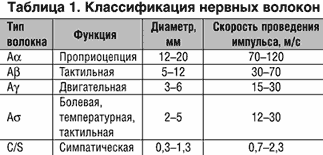 Каждый аксон покрыт оболочкой Шванновской клетки (в этом случае волокно называется немиелинизированным), либо окружен концентрически лежащими мембранами Шванновских клеток (в этом случае волокно называется миелинизированным). Нерв содержит как миелинизированные, так и немиелинизированные волокна. Только немиелинизированные волокна содержат автономные эфферентные и часть чувствительных афферентных волокон. Основной функцией нервного волокна является проведение импульса. По немиелинизированным волокнам импульс проводится медленнее. Для достижения основной цели необходима четкая интегративная связь между аксоном и электрохимическим градиентом клеточной мембраны аксона [10]. Патогенез ДН гетерогенен и мультифакториален. В основе лежит прогрессивная потеря волокон – демиелинизация и эндоневральная микроангиопатия [15]. Выделяют два основных этиологических механизма, ведущих к развитию ДН: метаболические и сосудистые изменения. Среди метаболических факторов, приводящих к развитию нейропатии, одним из основных считается активация полиолового пути обмена глюкозы [16,17]. Глюкоза превращается в сорбитол (полиол) при помощи альдозоредуктазы, используя в качестве коэнзима НАДФ. Аккумуляция сорбитола при гипергликемии приводит к дисбалансу в метаболизме фосфоинозитида и повреждению коэнзимов, что оказывает решающее влияние на развитие ДН [18,19]. Другим важным метаболическим фактором является нарушение обмена мио–инозитола. Мио–инозитол является одним из белков, поддерживающих стабилизацию клеточных мембран и принимающих участие в скорости проведения импульса по нервной ткани,т.к. играет важнейшую роль в аксональной дисфункции [10]. Снижение содержания мио–инозитола в аксональной ткани даже на 10% приводит к значительному снижению использования энергии нейроном. Кроме того, дефицит нейронного мио–инозитола приводит к нарушению ряда функций мембраны клетки, снижению активности Na–K АТФ–азы [10]. Этот фермент необходим для проведения импульса по нервной ткани и транспорту мио–инозитола в аксон. Таким образом, конечным итогом дефицита содержания мио–инозитола является замедление проведения импульса по нервному волокну [10]. Кроме того, важным механизмом в развитии ДН является повышенное неферментное гликирование структурных белков [20,21]. Мишенями гликирования невральных протеинов, потенциированного длительной гипергликемией, являются компоненты периферической нервной ткани: периневральная базальная мембрана, эндоневральные микрососуды, аксональный цитоскелет, миелиновые протеины [22,23]. Механизмы, приводящие к снижению кровотока в нервное волокно, недостаточно ясны, но в экспериментальном диабете показано, что истощение запасов оксида азота (NО), который обладает вазодилатирующими свойствами, и дисбаланс в отношении тромбоксана к простациклину приводят к преимуществу вазоконстрикторов, которые потенциально влияют на сосудистый тонус и приводят к снижению эндоневрального кровотока [24–26]. Одним из биохимических механизмов, играющих важную роль в развитии ДН и других осложнений диабета, является повышенная продукция свободных радикалов. Генез увеличенной прооксидантной активности у больных сахарным диабетом мультифакториален и недостаточно ясен. Теоретически гипергликемия приводит как к повышенной продукции свободных радикалов, так и к снижению антиоксидантных факторов [27]. В этом аспекте для профилактики и лечения нейропатии особо эффективны препараты антиоксидантного действия. Среди препаратов антиоксидантного действия приоритет остается за a–липоевой (тиоктовой) кислотой, которая является универсальным природным антиоксидантом. Спектр ее активности широк. Широкое применение препарата при диабетической нейропатии обосновано большим количеством исследований (ALADIN, DEKAN), подтверждающих его эффективность как препарата с патогенетической направленностью (уменьшение сенсомоторного дефицита, улучшение электрофизиологических показателей при приеме в дозе от 600 мг до 1800 мг в сутки), так и симптоматического действия (быстрый обезболивающий эффект при внутривенном капельном введении в дозе 600 мг 1 раз в сутки в течение месяца). Кроме того, применение a-липоевой кислоты сопровождается редукцией неврологических нарушений без существенного влияния на другие симптомы, связанные с нейропатией. Особенно эффективен прием a-липоевой кислоты при обратимом состоянии дисфункции нерва. Общепризнано, что в основе всех метаболических нарушений, приводящих (в данном случае) к нарушению функциональных и структурных особенностей нервных волокон, лежит длительная гипергликемия. Но, помимо гипергликемии, существенный вклад в поражение нервной ткани принадлежит гипогликемии [28,29]. Утилизация энергии периферическим нервом, зависящая от уровня глюкозы крови, нарушается во время гипогликемии. Предполагается, что в основе нейропатии, вызванной гипогликемией, лежит эффект острого кислородного голодания [30]. Следствием сенсомоторных расстройств является потеря защитной чувствительности и формирование деформаций по типу когтевидных пальцев. По мнению многих авторов, именно диагностика потери защитной чувствительности является основным предиктором последующего развития язвы [31–33]. Пациенты с периферической нейропатией имеют в 7 раз больше «шансов» возникновения язвы, чем пациенты без нейропатии [11]. Демиелинизация дистальных моторных волокон проявляется в атрофии и слабости мелких мышц стопы, результатом чего является нестабильность в плюснефаланговых суставах. Потеря функции мелких внутренних мышц стопы и антеролатеральной группы мышц нижних конечностей приводит к доминирующему влиянию длинных флексоров–сгибателей пальцев, подошвенных флексоров и лодыжечных экстензоров. В результате формируется классическая деформация под названием «когтевидные пальцы». Кроме того, именно благодаря нейропатии у больных сахарным диабетом нетипичное распределение зон повышенного давления на стопу и само давление выше, чем у не страдающих сахарным диабетом или больных сахарным диабетом без нейропатии [34–36]. Автономные расстройства Вегетативная нейропатия включает эфферентную систему иннервации гладких мышц внутренних органов, артериол, некоторых эндо– и экзокринных желез и сопутствующие висцеральные чувствительные волокна [37]. Считается, что автономная нейропатия (АН) встречается достаточно редко [38], а клинические проявления практически не поддаются фармакологической терапии. Но, как показали недавние исследования, автономные волокна вовлекаются в процесс достаточно рано и гораздо чаще, чем принято считать [10,38]. АН играет важную роль в регуляции периферического кровотока. Симпатические нервные волокна влияют на периферический кровоток, регулируя артериолярный вазомоторный тонус [39,40], и отвечают за автономный контроль сосудов нижних конечностей [10]. У больных сахарным диабетом с АН происходит аутосимпатэктомия, вызывающая потерю вазомоторного тонуса, увеличивая таким образом кровоток и приводя к образованию артерио–венозных шунтов. В результате увеличения давления на венозные капилляры возникает нейропатический отек [10]. Еще одним феноменом нарушения вегетативной регуляции сосудистого тонуса является ортостатическая гипотония. Генез многие авторы связывают с выпадением симпатического сосудосуживающего рефлекса спланхнического ложа внутренних органов, мышц и кожи в результате поражения афферентных волокон вазомоторной дуги. Одной из возможных причин может являться снижение ответа плазменного ренина на принятие вертикального положения тела вследствие нарушения симпатической иннервации юксто–гломерулярного аппарата (ЮГА), а также снижение базального и стимулированного уровня плазменного норадреналина и ангиотензина II. Предполагается возможное участие снижения чувствительности барорецепторов, а также нарушения центральной регуляции сосудистого тонуса [37]. Микротравма При рассматрении вопросов этиопатогенеза проблемы диабетической стопы указывалось на то, что ведущими факторами риска являются сенсомоторные и автономные расстройства в сочетании с микротравмой. В свою очередь, большую часть механических травм составляет неправильно подобранная обувь. В частности, узкая обувь увеличивает давление и может привести к ишемическому некрозу мягких тканей, соприкасающихся с обувью в течение нескольких часов; использование толстых прокладок может превратить удобную обувь в опасно–узкую. Дистальные (акральные) поражения пальцев обычно связаны с неподходящей по длине обувью [32]. Поэтому очень важно обучать пациентов правильно выбирать обувь и ежедневно осматривать стопы, чтобы вовремя заметить возникшую потертость. Другими причинами микротравм могут являться порезы как инородными предметами, так и вследствие обработки стоп острыми предметами, ожоги и т.д. Патология периферических сосудов Патология крупных артерий нижних конечностей является одним из факторов риска возникновения язвенных дефектов и ведущим фактором риска ампутаций нижних конечностей [1]. В большинстве случаев проявлениями патологии периферических сосудов (ППС) у больных сахарным диабетом являются атеросклероз и склероз средней части артериальной стенки (кальцификация медии, склероз Moenckeberg). Кальцификация медии приводит к ригидности артериальной стенки, не являясь, как правило, непосредственной причиной ишемии конечности. Диагностируется при проведении ультразвуковой допплерографии артерий нижних конечностей: артериальное давление в соответствующей артерии либо невозможно измерить, либо оно более чем в 1,5 раза превышает системное артериальное давление. Течение атеросклероза у больных сахарным диабетом в целом не отличается от такового в общей популяции, но имеет ряд особенностей: встречается чаще, поражает людей более молодого возраста, не зависит от половой принадлежности, преобладает дистальный тип поражения [41]. Пациенты с патологией артерий нижних конечностей, в классическом варианте, предъявляют жалобы на боли в икроножных мышцах, появляющиеся при нагрузке (ходьба) и проходящие через несколько минут отдыха – так называемый синдром перемежающейся хромоты. В основе лежит неадекватное кровоснабжение мышц обструктивно измененными артериями нижних конечностей, в результате чего в мышечной массе накапливается молочная кислота – следствие анаэробного гликолиза в условиях аноксии [42]. Боль в покое указывает на далекозашедшую стадию процесса и постоянную недостаточность кровоснабжения. Обычно боль локализована в стопе, усиливается ночью и носит жгучий характер [42]. Пациент не может уснуть без использования анальгетиков. Самым доступным способом диагностики нарушения кровообращения является использование УЗ допплерографии с измерением плече–лодыжечного индекса (ПЛИ–отношение АД на плечевой артерии к АД на тибиальных артериях). В норме ПЛИ равен 1,0. Индекс < 0,8 считается признаком наличия патологии артерий нижних конечностей [39,40]. В случаях медиакальциноза (ПЛИ>1,15) рекомендуется определять АД на большом пальце. Предшествующие язвы и ампутации По данным разных авторов, частота больных сахарным диабетом, имеющих в анамнезе язвы и ампутации, составляет от 5% до 10% [2]. Чаще всего повторные язвы возникают в местах бывших язв благодаря наличию двух факторов: во–первых, вновь образованный эпителий очень тонок и рубцовая ткань, образующаяся на месте бывшего поражения, как правило, несостоятельна; во–вторых, давление, которое испытывает подошвенная поверхность стопы в данных нетипичных условиях, оказывает прямое повреждающее действие в области вновь образованного шрама [32]. В таких случаях особое внимание должно уделяться пациентам с язвенными дефектами, находящимися в стадии неполного заживления, для предотвращения повторного язвообразования. В ряде случаев имеют место ятрогенные поражения, возникающие в основном после хирургических вмешательств. Например, удаление большого пальца часто приводит к возникновению язвенного дефекта в области головки 1 метатарзальной кости (мтк), так как нагрузка, которая распределялась ранее на большой палец и 1 мтк, концентрируется после вмешательства только в области головки 1 мтк. Из вышеописанного можно сделать вывод о том, что тщательное планирование хирургических манипуляций и обеспечение больных ортопедическими корректорами (стельками) после операции может помочь свести к минимуму возможность подобных ятрогенных поражений [32]. Социально–психологические факторы Социально–психологические факторы также считаются потенциальными факторами риска в развитии синдрома диабетической стопы, так как профессия, экономические и культурные факторы определяют обычно социальный статус человека, возможность получать квалифицированную медицинскую помощь и выбирать удобную обувь, что косвенно может определять более высокую частоту ампутаций и язв у людей, находящихся на низкой ступени социальной лестницы [6,36]. Формирование групп повышенного риска и проведение профилактических мероприятий Первым шагом превентивных мероприятий являются вовремя обнаруженные дерматологические, мускуло–скелетные, сосудистые и неврологические изменения, то есть основа профилактики синдрома диабетической стопы – внешний осмотр [45]. На основании клинического осмотра пациента можно отнести к той или иной категории группы риска. В разных странах существуют свои собственные модели градаций пациентов по группам риска. Предлагается выделять две большие группы пациентов: 1 – пациенты, не входящие в группу риска; 2 – пациенты, имеющие риск возникновения язв. Ко второй группе относятся пациенты, имеющие: – признаки периферической соматической и автономной нейропатии; – признаки нарушения магистрального кровотока; – предшествующие язвы и/или ампутации; – деформации стоп, такие как когтевидные пальцы; – мозоли; – частичную или полную слепоту; – нефропатию, особенно с признаками ХПН. Вторым звеном, не уступающим по значимости внешнему осмотру, является обучение – краеугольный камень профилактики первичного и повторного образования язв. Обучающие программы содержат специальные занятия по уходу за стопой с конкретным перечнем мероприятий, которые должен выполнять пациент [46,47]. В последнее время большой акцент делается на немаловажную роль медицинских сестер. Как известно, тяжелейшие осложненные формы диабетической стопы, как правило, начинаются с очень незначительных нарушений, которые должны быть вовремя замечены и ликвидированы. Специально подготовленные по уходу за такими больными медицинские сестры эффективно работают во многих странах. Литература: 1. Международное Соглашение по Диабетической стопе, 2000 г. 2. Reiber G.E.: Epidemiology of the diabetic foot. In The Diabetic Foot, Levin M., O’Neal L., Bowker H. Mosby Year Book, 1993. 3. Palumbo P.L., Melton L.J.: Peripheral vascular disease and diabetes. In Diabetes in America, Harris M.I., Hamman R.F., 1985, p. xv 1–21. 4. Apelqvist J., et al:Wound classification is more imortant that side of ulceration in the outcome of diabetic foot ulcers. Diabetic Medicine 1989;6:526–530. 5. Crausaz S., et al: Additional factors associated with plantar ulcers in diabetic neuropathy. Diabetic Medicine, 1988;5:771–775. 6. Assal J.Ph, Alivisatos I.J., Halimi D.: Foot Care. The Teaching Letters. pg 50–53. |
