Ацетатальдегид. ацетальдегид курсовая работа. Производство ацетальдегида из этилена
 Скачать 298.89 Kb. Скачать 298.89 Kb.
|
Институт тонких химических технологий им. М.В. Ломоносова Кафедра Общей химической технологии Курсовая работа на тему: «Производство ацетальдегида из этилена» Вариант 1 Выполнила: студентка группы ХЕБО-06-17 Прадед Ангелина. Преподаватель: Егорова Е.В. Москва 2020 Содержание 1. Введение………………………………………………………………………...3 2. Способы получения ацетальдегида…………………………………………...4 3. Характеристика сырья. ………………………………………………………...6 4. Характеристика целевого продукта……………………………………………………………………………7 5. Технология процесса…………………………………………………….…....10 6. Конструкция основного аппарата. ………………………………………..…12 7. Технологическая схема процесса..…………………………………...………13 8. Расчет материального баланса.………………………………………………17 9. Расчет основных технологических показателей процесса…………………19 10. Выводы. ……………………………………………………………………...22 11. Список литературы. …………………………………………………………23 Введение Ацетальдеги́д (у́ксусный альдегид, этана́ль, метилформальдегид) — органическое соединение класса альдегидов с химической формулой CH3-CHO, является альдегидом этанола и уксусной кислоты. Это один из наиболее важных альдегидов, широко встречающийся в природе и производится в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма. Впервые ацетальдегид был обнаружен шведским фармацевтом-химиком Карлом Вильгельмом Шееле (1774); затем его исследовали французские химики Антуан Франсуа, граф де Фуркруа и Луи Николя Воклен (1800), и немецкие химики Иоганн Вольфганг Доберейнер (1821, 1822, 1832) и Юстус фон Либих (1835). В 1835 году Либих назвал его «альдегидом», позднее название было изменено на «ацетальдегид». В печени фермент алкогольдегидрогеназа окисляет этанол в ацетальдегид, который затем дополнительно окисляется в безвредную уксусную кислоту ацетальдегиддегидрогеназой. Эти две реакции окисления связаны с восстановлением NAD + до NADH. В головном мозге, фермент каталаза в основном отвечает за окисление этанола в ацетальдегид, а алкогольдегидрогеназа играет незначительную роль. Последние стадии алкогольной ферментации у бактерий, растений и дрожжей включают превращение пирувата в ацетальдегид и диоксид углерода ферментом пируватдекарбоксилазой с последующим превращением ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, которая работает в обратном направлении. Традиционно ацетальдегид использовали, в основном, в качестве предшественника уксусной кислоты. Этот метод больше не используется, потому что уксусная кислота более эффективно производится из метанола в процессах Monsanto и Cativa. Ацетальдегид является важным предшественником производных пиридина, пентаэритрита и кротонового альдегида. Мочевина и ацетальдегид образуют полезную смолу. Уксусный ангидрид реагирует с ацетальдегидом с образованием этилидендиацетата, предшественника винилацетата, который используется для производства поливинилацетата. Мировой рынок ацетальдегида сокращается. На спрос повлияли изменения в производстве пластификаторов, которые сместились из-за того, что н-бутиральдегид реже производится из ацетальдегида, а не образуется при гидроформилировании пропилена. Аналогично, уксусная кислота, однажды произведенная из ацетальдегида, производится преимущественно с помощью более дешевого процесса карбонилирования метанола. Влияние на спрос привело к росту цен и, следовательно, замедлению процессов на рынке. Китай является крупнейшим потребителем ацетальдегида в мире, на его долю пришлось почти половина мирового потребления в 2012 году. Основное использование - производство уксусной кислоты. Ожидается, что другие области применения, такие как пиридины и пентаэритритол, будут расти быстрее, чем уксусная кислота, но объемы не достаточно велики, чтобы компенсировать снижение уксусной кислоты. Как следствие, общее потребление ацетальдегида в Китае может немного вырасти до 1,6% в год до 2018 года. Западная Европа является вторым по величине потребителем ацетальдегида в мире, на долю которого приходится 20% мирового потребления в 2012 году. Как и в случае с Китаем, западноевропейский рынок ацетальдегида будет расти очень незначительно - 1% в год в течение 2012–2018 гг. Однако, Япония может стать потенциальным потребителем ацетальдегида в течение следующих пяти лет из-за нового использования в промышленном производстве бутадиена. Способы получения ацетальдегида До 1962 года этанол и ацетилен были основными источниками ацетальдегида. С тех пор этилен является доминирующим сырьем. Основным методом производства является окисление этилена в процессе Вакера, который включает окисление этилена с использованием гомогенной системы палладий / медь: 2CH2=CH2 + O2 → 2CH3CHO. Меньшие количества могут быть получены путем частичного окисления этанола в экзотермической реакции. Этот процесс обычно проводится на серебряном катализаторе при температуре около 500–650 °C. CH3CH2OH + 1⁄2O2 → CH3CHO + H2O. Этот метод является одним из старейших способов промышленного получения ацетальдегида. Другие методы Гидратация ацетилена До процесса Вакера и доступности дешевого этилена, ацетальдегид производился путем гидратации ацетилена. Эта реакция катализируется солями ртути (II): C2H2 + Hg2 + + H2O → CH3CHO + Hg. Механизм включает промежуточный виниловый спирт, который таутомеризуется в ацетальдегид. Реакцию проводят при 90–95 ° С, а образовавшийся ацетальдегид отделяют от воды и ртути и охлаждают до 25–30 ° С. В процессе мокрого окисления, сульфат железа (III) используется для повторного окисления ртути обратно в соль ртути (II). Полученный сульфат железа (II) окисляется в отдельном реакторе азотной кислотой. Окисление этанола Традиционно ацетальдегид получают частичным дегидрированием этанола: CH3CH2OH → CH3CHO + H2 В этом эндотермическом процессе пары этанола пропускаются при температуре 260–290 ° C через катализатор на основе меди. Этот процесс когда-то был привлекателен из-за ценности побочного продукта водорода, но в наше время экономически невыгоден. Гидроформилирование метанола Гидроформилирование метанола с помощью катализаторов, таких как соли кобальта, никеля или железа, также приводит к получению ацетальдегида, хотя этот процесс не имеет промышленного значения. Ацетальдегид образуется из синтез-газа с небольшой селективностью. Реакции Как и многие другие карбонильные соединения, ацетальдегид таутомеризуется с образованием энола (винилового спирта; название IUPAC: этенол): CH3CH = O⇌CH2 = CHOH ∆H298, г = +42,7 кДж / моль. Константа равновесия составляет 6×10−7 при комнатной температуре, поэтому относительное количество энольной формы в образце ацетальдегида очень мало. При комнатной температуре ацетальдегид (CH3CH = O) более стабилен, чем виниловый спирт (CH2 = CHOH), на 42,7 кДж / моль: В целом, кето-энольная таутомеризация происходит медленно, но катализируется кислотами. Фотоиндуцированная таутомеризация кето-энола является жизнеспособной в атмосферных или стратосферных условиях. Эта фототавтомеризация имеет отношение к атмосфере Земли, поскольку считается, что виниловый спирт является предшественником карбоновых кислот в атмосфере. Реакции конденсации Ацетальдегид является распространенным электрофилом в органическом синтезе. В реакциях конденсации, ацетальдегид является прохиральным. Он используется главным образом в качестве источника синтона «CH3C + H (OH)» в альдоле и связанных с ним реакциях конденсации. Реагенты Гриньяра и литийорганические соединения реагируют с MeCHO с образованием гидроксиэтильных производных. В одной из наиболее впечатляющих реакций конденсации, три эквивалента формальдегида добавляют к MeCHO с получением пентаэритрита, C (CH2OH) 4. В реакции Штрекера ацетальдегид конденсируется с цианидом и аммиаком, давая после гидролиза аминокислоту аланин. Ацетальдегид может конденсироваться с аминами с образованием иминов; например, с циклогексиламином с получением N-этилиденциклогексиламина. Эти имины могут быть использованы для направления последующих реакций, таких как альдольная конденсация. Это вещество также является строительным блоком в синтезе гетероциклических соединений. В одном примере он превращается после обработки аммиаком в 5-этил-2-метилпиридин («альдегид-коллидин»). Характеристика сырья В качестве сырья в производстве ацетальдегида используется этилен. Этилен — самое производимое органическое соединение в мире; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год. Основным промышленным методом получения этилена является пиролиз жидких дистиллятов нефти или низших насыщенных углеводородов. Реакция проводится в трубчатых печах при +800-950 °С и давлении 0,3 МПа. При использовании в качестве сырья прямогонного бензина выход этилена составляет примерно 30 %. Одновременно с этиленом образуется также значительное количество жидких углеводородов, в том числе и ароматических. При пиролизе газойля выход этилена составляет примерно 15-25 %. Наибольший выход этилена — до 50 % — достигается при использовании в качестве сырья насыщенных углеводородов: этана, пропана и бутана. Их пиролиз проводят в присутствии водяного пара. При выпуске с производства, при товарно-учётных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб этилена по процедуре, описанной в ГОСТ 24975.0-89 «Этилен и пропилен. Методы отбора проб». Отбор пробы этилена может производиться и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921. Физические свойства этилена Этилен – бесцветный газ со слабым сладким запахом плотностью 1,178 кг/м³ (легче воздуха), его вдыхание оказывает наркотическое действие на человека. Этилен растворяется в эфире и ацетоне, значительно меньше — в воде и спирте. При смешении с воздухом образует взрывоопасную смесь. Затвердевает при –169,5°C, плавится при таких же температурных условиях. Кипит этен при –103,8°C. Воспламеняется при нагревании до 540°C. Газ хорошо горит, пламя светящееся, со слабой копотью. Округленная молярная масса вещества — 28 г/моль. Физические свойства кислорода O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен. Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород). Характеристика целевого продукта Уксусный альдегид является органическим соединением класса альдегидов. Его могут называть и по-другому: ацетальдегидом, этаналем или метилформальдегидом. Формула уксусного альдегида - CH3-CHO. Рассматриваемое вещество имеет вид бесцветной жидкости с резким удушливым запахом, которая хорошо растворима водой, эфиром и спиртом. Так как температура кипения обсуждаемого соединения низкая (около 20 оС), хранить и перевозить можно только его тример - паральдегид. Ацетальдегид имеет следующие свойства: Таблица 1. Свойства ацетальдегида.
ГОСТ 9585-77: Настоящий стандарт распространяется на технический уксусный альдегид (технический ацетальдегид), получаемый методом жидкофазной и парофазной гидратации ацетилена и методом окисления этилена на катализаторе, содержащем хлориды металлов, и предназначенный для производства уксусного ангидрида, уксусной кислоты, бутиловых спиртов, бутадиена, альдегидных синтетических смол и других продуктов. Химические свойства ацетальдегида По своим химическим свойствам уксусный альдегид является типичным алифатическим альдегидом, и для него характерны реакции этого класса соединений. Его реакционная способность определяется двумя факторами: активностью карбонила альдегидной группы и подвижностью атомов водорода метильной группы, вследствие индуктивного эффекта карбонила. Подобно другим карбонильным соединениям с атомами водорода у α-углеродного атома, ацетальдегид таутомеризируется, образуя енол — виниловый спирт, равновесие почти полностью смещено в сторону альдегидной формы (константа равновесия — только 6⋅10−5 при комнатной температуре):  Реакция конденсации Из-за небольших размеров молекулы и доступности в виде безводного мономера (в отличие от формальдегида) ацетальдегид является широко распространённым электрофильным агентом в органическом синтезе. Что касается реакций конденсации, альдегид прохирален. Он используется, в основном, как источник синтона «CH3C+H(OH)» в альдольной и соответствующих реакциях конденсации. Реактив Гриньяра и литий-органические соединения реагируют с MeCHO, образуя производные гидроксиэтила. В одной из реакций конденсации, три эквивалента формальдегида присоединяются, а один восстанавливает образующийся альдегид, образуя из MeCHO пентаэритрит (C(CH2OH)4.) В реакции Штрекера ацетальдегид конденсируется с цианидом и аммиаком, образуя после гидролиза аминокислоту — аланин. Ацетальдегид способен конденсироваться с аминами образуя имины, так как конденсация циклогексиламина даёт N-этилиден циклогексиламин. Эти имины могут быть использованы для прямой последующей реакции, таких, как альдольная конденсация. Ацетальдегид также — важный строительный блок для синтезов гетероциклических соединений. Выдающийся пример — конверсия под действием аммиака до 5-этил-2-метилпиридина («альдегид-коллидин»). Реакция альдольной конденсации обусловлена подвижностью водорода в альфа-положении в радикале и осуществляется в присутствии разбавленных щелочей. Её можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой: CH3-CHO + CH3-CHO = CH3-CH(OH)-CH2-CHO Производные ацеталя Три молекулы ацетальдегида конденсируются, образуя «паральдегид» — циклический тример, содержащий одиночные С-О связи. Конденсация четырёх молекул даёт циклическое соединение, называемое метальдегид. Ацетальдегид образует стабильные ацетали при реакции с этанолом в условиях дегидратации. Продукт CH3CH(OCH2CH3)2 называется «ацеталь», хотя термин используется для описания более широкой группы соединений с общей формулой RCH(OR')2. Применяют уксусный альдегид для получения уксусной кислоты, бутадиена, некоторых органических веществ, альдегидных полимеров. Традиционно ацетальдегид, в основном, использовался в качестве прекурсора к уксусной кислоте. Такое применение было отвергнуто ввиду того, что уксусная кислота более эффективно производится из метанола с помощью процессов Монсанто и Катива. В терминах реакции конденсации, ацетальдегид — важный прекурсор к пиридиновым производным, пентаэритролу и кротональдегиду. Мочевина и ацетальдегид конденсируются, образуя смолы. Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат, из которого получают винилацетат — мономер поливинилацетата. Технология процесса Более эффективный способ – окислением этилена был разработан в конце 50-х почти одновременно группой Смидта, Хафнера и др. (Консорциум электрохимической промышленности) и И.И. Моисеевым, М.Н. Варгафтиком и Я.К. Сыркиным (МИТХТ им. М.В. Ломоносова). Метод был основан на трех стехиометрических реакциях, которые в совокупности складывались в каталитический цикл. Химизм процесса Вакер-процесс основан на реакции окисления этилена дихлоридом палладия: CH2=CH2 + PdCl2 + H2O = CH3CHO + Pd + 2HCl (1) Выделяющийся палладий окисляют введением хлорида меди (II): Pd + 2CuCl2 = PdCl2 + 2CuCl (2) который регенерируют путём окисления кислородом: 4CuCl + 4HCl + O2 = 4CuCl2 + 2H2O (3) Таким образом, суммарно реакцию можно представить в виде: 2CH2=CH2 + O2 = 2CH3CHO Основная реакция протекает при температуре 90–100°С и давлении 0,8–1,0 МПа. Процесс проводят при недостатке кислорода – соотношение СH2=СН2: О2 = 2,2÷3, 0:1. Одновременно протекает побочная реакция образования кротонового альдегида: 2СН3СНО = СН3СН=СНСНО + Н2О, а также ряд реакций, приводящих к образованию небольших количеств хлорацетальдегида, уксусной и муравьиной кислот. Механизм Вакер-процесса тщательно изучался. В растворе, содержащем хлориды меди, палладия и соляную кислоту, всегда присутствует некоторое количество тетрахлоропалладата(II). На первой стадии один из атомов хлора в [PdCl4]2- замещается на молекулу этилена, при этом образуется комплекс, аналогичный соли Цейзе. Дальнейший ход процесса предполагает замещение хлора с транс-положении к этилену (вторая стадия), так как этилен обладает более сильным транс-влиянием, чем хлорид. На третьей стадии координированная молекула этилена подвергается атаке молекулы воды, что приводит к образованию оксиэтильной группы, связанной с атомом палладия σ-связью. Внутримолекулярная перегруппировка (четвертая стадия) сопровождается восстановлением палладия и образованием протонированной формы ацетальдегида. Термодинамический и кинетический анализ Основная реакция процесса – экзотермическая, сопровождающаяся выделением значительного количества тепла (–∆Н=+221,5 кДж/моль). Превращение этилена в ацетальдегид происходит уже при 20°С, но скорость реакции очень мала. Сравнительно интенсивно реакция протекает при 100–130°С. В этом случае для поддержания реакционной массы в жидком состоянии требуется повышенное давление 0,3–1,11 МПа, которые способствует также ускорению процесса за счет улучшения растворимости газов. Так как реакция экзотермическая, поднимать температуру выше указанной не рекомендуется – реакция идет с выделением тепла, и, следовательно, рост температуры будет отрицательно сказываться на выходе продукта. Поскольку активность катализатора со временем падает, применяются сокатализатооры – соли меди в солянокислой среде, играющие роль переносчиков кислорода (реакция 2). Существенное влияние на скорость реакции оказывает содержание ионов Cl-. По кинетическому уравнению скорости реакции окисления этилена хлоридами палладия скорость реакции обратно пропорциональна квадрату концентрации ионов хлора, поэтому уменьшение концентрации ионов приводит к увеличению скорости реакции. 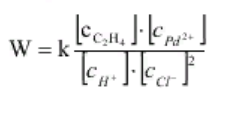 В катализаторном растворе солей [PdCl2, CuCl2, Cu(OAc)] концентрация ионов должна быть [Cu-]: [Pd]>100 и 1≤ Cl:Cu ≤ 2. Таким образом, данная реакция является сложной, экзотермической, необратимой, гетерогенно-каталитической. Конструкция основного аппарата Существует два технологических варианта проведения этого процесса – двухреакторный и однореакторный. В случае двухреакторной схемы в одном реакторе проводят первую и вторую реакции из вышеприведенных трёх, а во втором реакторе - реакцию реокисления меди кислородом воздуха. В случае однореакторной схемы все три реакции протекают в одном аппарате. Трубчатые реакторы В аппаратах этого типа поверхности охлаждения расположены параллельно движению реагентов и таким образом отвод или подвод тепла осуществляется по мере его выделения или поглощения. Конструктивно реакторы могут быть выполнены в виде трубчатого аппарата с охлаждающей рубашкой около каждой трубки. Могут быть трубчатые реакторы с общей охлаждающей рубашкой (реактор кожухо-трубного типа с размещением катализатора в трубках или межтрубном пространстве). Могут быть аппараты с двойными трубками, когда слой катализатора имеет кольцевое сечение. Аппарат состоит из отдельных секций. Их может быть до 12. Процессы, происходящие в данном реакторе, могут иметь температуру до 2600С, давление 7 МПа. Внутренний диаметр трубы составляет 150 мм. Высота отдельного элемента 14 м. Достоинством такого аппарата является возможность применения хладоагента, высокого давления (кипящая вода под давлением). Недостатком является его малая производительность, большая занимаемая площадь, неудобство выгрузки катализатора.  1 – корпус; 2 – рубашка. Рис. 1. Схема реактора типа «труба в трубе». Технологическая схема процесса В России была реализована только двухреакторная схема (рис.2). Процесс в этом случае проводят при 100-110º и 1 МПа. Этилен и водный раствор солей палладия и меди подают в реактор типа «труба в трубе» 3 (рис. 1), который содержит инертную насадку для увеличения межфазной поверхности газ-жидкость. После реактора 3 контактный раствор вместе с реакционными газами поступает в отпарную колонну 4. Газовая фаза из колонны 4 (органические продукты) попадает в ректификационную колонну 5. Кубовый продукт колонны 5 используют для орошения колонны 4. Жидкую фазу из колонны 4 (водный слой) перекачивают в реактор 1, в котором происходит реокисление солей меди воздухом. Регенерированный каталитический раствор через фазовый сепаратор 2 поступает в реактор 3. Часть раствора из фазового сепаратора 2 отводится в регенератор 10, в котором под воздействием хлористого водорода при 150ºС происходит разложение труднорастворимых оксалатов меди и палладия (щавелевая кислота – один из побочных продуктов). Это необходимо для поддержания активности катализатора. Газовая фаза из сепаратора 2 поступает в скруббер 7, орошаемый, как и скруббер 6, кубовым продуктом из колонны 5. В скруббере 6 промывается несконденсировавшийся газ с верха колонны 5. Конденсат из колонны 5, содержащий ацетальдегид, через холодильник поступает на ректификацию в колонну 8 для отделения лёгких побочных продуктов (диоксид углерода, хлористый метил, хлористый этил), а затем в колонну 9 для отделения более высококипящих продуктов (хлорацетальдегид, уксусная и щавелевая кислоты). Тепло реакции (52 ккал/моль) используется для обогрева колонны 4.  Рис 2. Двухреакторная схема Вакер-процесса. 1 – трубчатый реактор для повторного окисления Cu+; 2 – фазовый сепаратор; 3 – трубчатый реактор образования ацетальдегида; 4 – испарительная колонна; 5,9 – перегонка; 6,7 – скрубберы; 8 – обезгаживание; 10 – регенератор. Мною рассмотрена альтернативная схема (рис. 3), где используется один реактор, содержащий контактный раствор, в который подают высокочистые этилен и кислород. Процесс проводят при 90-100ºС и 0,8 МПа. Тепловой эффект снимают за счет испарения части воды. Убыль воды восполняется. Газообразные продукты, пройдя фазовый сеператор 2 и холодильник 3, поглощаются в скрубберах 4. Непрореагировавший этилен в избытке которого проводят процесс (выше верхнего предела взрываемости) рециркулируют обратно в реактор 1. Ацетальдегид очищают ректификацией в колоннах 5. 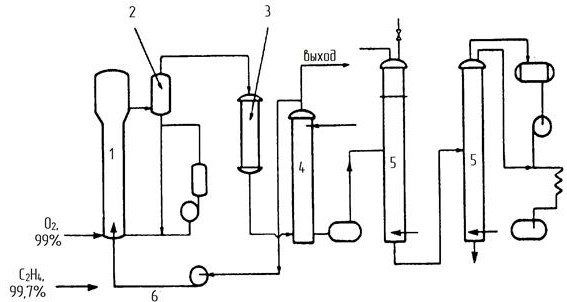 Рис.3. Однореакторная схема Вакер-процесса. 1 – реактор; 2 – фазовый сепаратор; 3 – конденсатор; 4 – скруббер; 5 – перегонка; 6 – газ повторного цикла. Проанализировав два технологических варианта проведения этого процесса, были сделаны следующие выводы: Основной проблемой двухреакторной схемы является большое количество аппаратов, через которые циркулирует коррозионноактивный контактный раствор. Реакторы 1, 3, 10, сепаратор 2, насосы, коммуникации необходимо изготавливать из дорогих коррозионностойких материалов (титановых сплавов). Еще одним недостатком двухреакторной схемы является низкая производительность (7 г/л·час). Преимущество двухреакторной схемы над однореакторной – безопасность, поскольку этилен и кислород не контактируют между собой. После рассмотрения мною однореакторной схемы, были определены ее следующие достоинства: мало аппаратов соприкасается с контактным раствором, производительность выше, чем в двухреакторном варианте. Также были выявлены следующие недостатки: необходимость использования чистого кислорода и этилена из-за рециркуляции газа, большой расход энергии на рециркуляцию, взрывоопасность и потери части этилена из-за отдувки газа из рецикла. Таким образом, сравнив показатели двух технологических схем, можно сделать вывод о том, что однореакторная схема обладает существенными преимуществами перед двухреакторным вариантом и в отношении капитальных вложений, и по себестоимости ацетальдегида. Только потенциальная взрывоопасность ставит под сомнение целесообразность использования однореакторной схемы. Структурная блок-схема ХТС    N011 N31 N403 N12 N23 1 2 3 4  N34 N34     N012     N030 N401 N402 N010 Блоки: 1 – смешение 2 – синтез 3 – отпарка 4 – разделение Потоки: 011 – свежий этилен 012 – свежий кислород 010 – свежий этан (инерт) 12 – парогазовая смесь 23 – продукты реакции 030 – инертные газы (этан) 31 – возвратная смесь этилена 34 – конденсат 401– ацетальдегид 402 – кротоновый альдегид 403 – вода Операторная схема ХТС 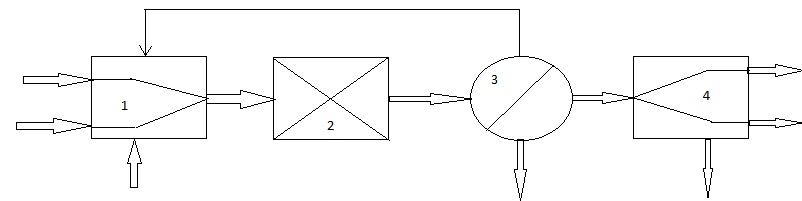 Блоки: 1 – смешение 2 – синтез 3 – отпарка 4 – разделение Расчёт материального баланса ХТС Таблица 2. Исходные данные для расчета
Составление системы уравнений: 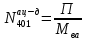 N402кр. а. = 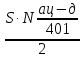 N402кр.а = N403H2O N12эт ∙ χэт = 2∙N402кр.а.+ N401ац-д N12O2 = N12эт ∙χэт*∙0.5 N012O2=N12O2 N12эт ∙(1-χэт) = N31эт N011эт = N12эт- N31эт N011C2H6 = 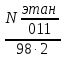 N030этан = N012этан Таблица 3. Соответствие переменных потоков
Переименование и упорядочивание переменных:   - 0,016 ∙ - 0,016 ∙ 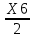 = 0 = 0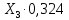 - 2∙ - 2∙ - -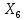 = 0 = 0X7=X8 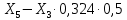 = 0 = 0X4=X5 X3 ∙ (1-0,324) - X2 =0 X1-X3+X2 = 0 X9 - X1 / 98∙2 =0 X9 = X10 Таблица 4. Матрица коэффициентов
Таблица 5. Материальный баланс химико-технологической системы производства ацетальдегида из этилена на 600000 кг ацетальдегида.
Расчет основных технологических показателей процесса Степень превращения этилена: 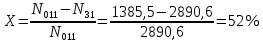 Выход ацетальдегида на этилен:  Селективность образования ацетальдегида: 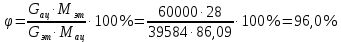 Расходные коэффициенты по сырью: 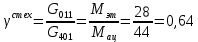 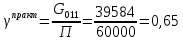 Проверка: η = χ∙φ χ = 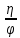 = =  = 0,50 ≈0,52 = 0,50 ≈0,52Поточная диаграмма 1 блок - смешение Потоки: 010 – свежий этилен, 011 – свежий кислород, 010 (инерт) – входящий инерт этан 2 блок – синтез Потоки: 12 – синтез этилена и кислорода 3 блок – отпарка Потоки: 31 – непрореагировавший этилен, поступающий на рецикл, 30 – выводимый инерт, 34 – продукты реакции 4 блок – разделение Потоки: 040 – продукт ацетальдегид, 041- побочный продукт кротоновый альдегид, 042 – вода. 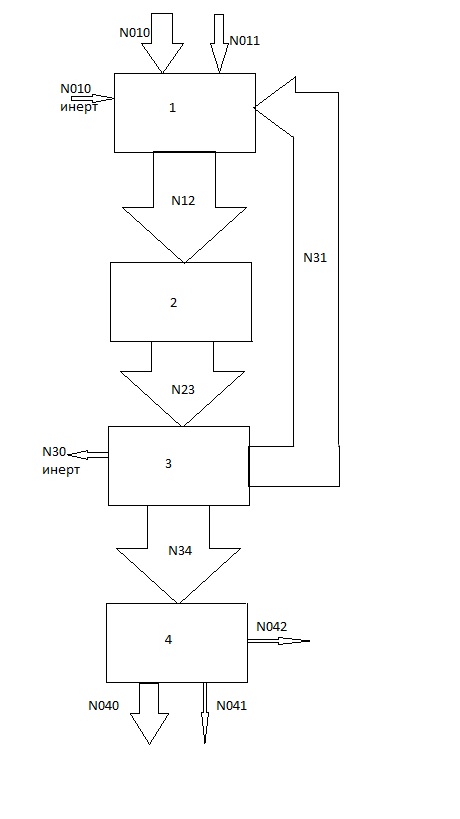 Выводы Ацетальдегид используется полупродуктом многочисленных промышленных синтезов (уксусного ангидрида, производства уксусной и надуксусной кислот, этилацетата, кротонового альдегида, хлораля, пиридинов, 2-этилгексанола, 1-бутанола, и др.) Окислением этилена получают 85% мирового ацетальдегида, это основной промышленный способ его синтеза. Поскольку большую часть ацетальдегида используют для получения уксусной кислоты и ее ангидрида, необходимых для получения искусственного волокна, нужда в ацетальдегиде постоянно увеличивается. Но не так давно единственными источниками сырья для производства ацетальдегида были карбид кальция и этиловый спирт, которые требовали больших затрат энергии и пищевых продуктов. Из-за этого промышленность часто отказывалась от процессов, где исходным сырьем является ацетальдегид, и заменяла их на другие. Скорее всего эти тенденции исчезнут, когда разовьется наиболее прогрессивный метод получения ацетальдегида — окисление газов углеводорода. В настоящее время разработка ХТС базируется на следующих основных технологических принципах: - принцип наилучшего использования сырья; - принцип наилучшего использования энергии; - принцип наибольшей интенсивности процессов; - принцип экологической безопасности. В данном процессе вышеупомянутые принципы соблюдаются следующим образом: 1) Принцип наилучшего использования сырья реализуется при использовании рецикла непрореагировавшего этилена, а также при использовании недостатка кислорода; 2) Принцип наилучшего использования энергии и принцип интенсивности процессов реализуется при производстве по однореакторной схеме, так как логично, что два реактора используют больше энергии, чем один. Плюс ко всему, как было упомянуто выше, при использовании однореакторной схемы производительность больше, чем при использовании двухреакторной схемы. 3) Принцип экологической безопасности реализуется при использовании в дальнейшем производстве побочного продукта реакции - кротонового альдегида. Кротоновый альдегид является важным прекурсором для синтеза многих химических веществ. Из кротонового альдегида синтезируют сорбиновую кислоту — пищевой консервант, а также триметилгидрохинон, предшественник витамина Е. Другими производными альдегида являются кротоновая кислота и 3-метоксибутанол. Список литературы Гутник С.П., Сосонко В.Е., Гутман В.Д. Расчёты по технологии органического синтеза. – М.: Химия, 1988. [04.04.2020] Адельсон С.В., Вишнякова Т.П., Паушкин Я.М. Технология нефтехимического синтеза. – М.: Химия, 1985. [07.04.2020] Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1988. [08.04.2020] Клименко А.П. Получение этилена из нефти и газа. – М.:Химия,1962 [15.04.2020] Основные процессы и аппараты химической технологии: Пособие по проектированию./ Ю.И. Дытнерский. – М.: Химия,1991. [15.04.2020] Справочник нефтехимика./ С.К. Огородников. В 2-х т. – Л.: Химия,1978 [06.05.2020] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


