овр. ОВР. Исследование окислительновосстановительных реакций
 Скачать 151.89 Kb. Скачать 151.89 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра общей химии ОТЧЁТ лабораторная работа №5 «Исследование окислительно-восстановительных реакций» Выполнил: студент гр. ТОА-22 (подпись) (Ф.И.О.) Проверил руководитель работы: _______ (должность) (подпись) (Ф.И.О.) Цель работы: познакомиться с наиболее распространёнными окислителями и восстановителями, с продуктами их взаимодействия между собой и научится составлять уравнения окислительно-восстановительных реакций. Общие сведения Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов. Степень окисления – это гипотетический заряд, который был бы на атомах данного элемента, если бы соединение было построено из ионов. Высшая степень окисления элемента равна номеру группы Периодической системы, в которой данный элемент расположен. Низшая степень окисления равна числу электронов, который может принять данный элемент на застраивающейся np-подуровень: zmin =N-8 , где N – номер группы. Например, у серы высшая степень окисления равна 6, а низшая: 6-8=-2. В простых веществах степень окисления равна нулю. Многие элементы проявляют в соединениях постоянные значения степени окисления: Фтор –1 Кислород –2, кроме перекиси и пероксидов, в которых степень окисления кислорода –1 Щелочные металлы +1 Щелочноземельные металлы +2 Водород кроме гидридов и органических соединений, +1 Степени окисления переменно-валентных элементов рассчитывают по правилу баланса зарядов: «Сумма степеней окисления всех элементов в соединения равна нулю, а в многоатомном ионе - заряду иона» Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления. Окислитель при этом принимает электронына валентную оболочку, а восстановитель отдаёт электроны. Глубина восстановления перманганата зависит от кислотности среды. В кислой среде перманганат восстанавливается до степени окисления +2 согласно полуреакции: 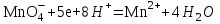 . .В нейтральной среде, ввиду недостатка ионов Н+, восстановление идет до MnO2 по приведенной в примере полуреакции. В щелочной среде восстановление заканчивается уже на стадии образования Mn(6+) в форме манганат-иона 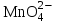 . Уравнение полуреакции: . Уравнение полуреакции: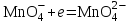 . .От кислотности среды зависит также состояние в растворе хрома (VI) вследствие протекания реакций: 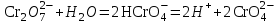 . .Согласно принципу Ле-Шателье, в кислой среде, при избытке ионов Н+, равновесие смещается влево, и хром находится в растворе в форме оранжевого дихромата. В щелочной среде, когда ионы Н+ в недостатке, равновесие смещено вправо, и хром переходит в форму желтого хромата. Окислительная способность хрома (VI) выше в кислой среде. Дихромат – сильный окислитель, восстанавливающийся по полуреакции: 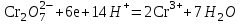 . .Хромат – слабый окислитель, поэтому хром (VI) получают обычно окислением хрома (3+) в щелочной среде по полуреакции: 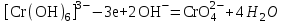 . .Ход работы Опыт №1. Окислительные свойства пероксида водорода H2O2+H2SO4+2KI=I2↓+K2SO4+2H2O  2O-+2ē→2O2- 1 2I--2ē→I20 1 Раствор стал коричневого цвета, после добавления крахмал – почернел, что указало на содержание йода. Опыт №3. Восстановительные свойства сульфидов. 2KMnO4+H2SO4+H2S=K2SO4+MnSO4+S↓+H2O S-2 -2ē→S0 5 восстановитель MnO4- +8H++5ē→Mn+2 +4H2O 2 окислитель 2MnO4- +16H++5S2-→2Mn+2 +8H2O + 5S0 Появление жёлтого осадка Опыт№5:Восстанавительные свойства сернистой кислоты Na2SO3 + I2 + H2O = Na2SO4 + 2HI Сера - восстановитель: S (+4) - 2e = S +6 Иод - окислитель: I2 (0) + 2e = 2I -1 Опыт №6-7. Окислительные_и_восстановительные_свойства_нитритов.'>Окислительные и восстановительные свойства нитритов. 6 опыт: 6KI+4H2SO4+2NaNO3= 2NO+ I2↓+K2SO4+Na2SO4+2H2O I--ē→I20 1 N5++3ē→N2+ 1 7 опыт: 2KMnO4+5NaNO2+3H2SO4=2MnSO4+5NaNO3+K2SO4+3H2O MnO4- +8H++5ē→Mn+2 +4H2O 2 NO2-+ H2O -2ē→NO3-+2H+ 5 2MnO4- +16H++5NO2-+5H2O →2Mn+2 +8H2O + 5NO3-+10H+ Опыт №8. Окислительные свойства дихромата калия 1) K2Cr2O7+4H2SO4+3Na2SO3=Cr2(SO4)3 +3Na2SO4+K2SO4+H2O Cr2O72-+14H++3ē→Cr3++7H2O 2 SO32-+ H2O -2ē→SO4+2H+ 3 Cr2O72-+14H++4SO3+4H2O →2Cr3++7H2O Cr2O72-+4H++3SO3→2Cr3++H2O+SO4 раствор стал зеленого цвета. 2)K2Cr2O7+7H2SO4+ 6KI=Cr2(SO4)3+4K2SO4+7H2O+3I2 Cr2O72-+14H++6ē →2Cr3++7H2O 1 2I--2ē→ I20 3 Cr2O72-+7H++6I-→2Cr3++7H2O+3I20 Cr2O72-+7H++6I-→2Cr3++7H2O+5I20 помутнение раствора и выпадение осадка. 3) K2Cr2O7+7H2SO4+6Fe2SO4= Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O Cr2O72-+14H++6ē →2Cr3++7H2O 1 2Fe+2-2ē→2Fe+3 3 Cr2O72-+14H++6Fe2+ →2Cr3++7H2O+6Fe3+ Cr2O72-+14H++6Fe2+ →2Cr3++7H2O+6Fe3+ раствор стал голубоватого цвета. Опыт №9. Окислительные свойства перманганата калия в различных средах (А)Кислая среда 1) 2KMnO4+8H2SO4+10KI=5I2+2MnSO4+6K2SO4+8H2O MnO4- +8H++5ē→Mn+2 +4H2O 2 2I--2ē→I20 5 2MnO4- +16H++10I-→2Mn+2 +8H2O + 5I20 раствор тёмно-оранжевого цвета 2) 2KMnO4+8H2SO4+10Fe2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O MnO4- +8H++5ē→Mn+2 +4H2O 2 2Fe+2-2ē→2Fe+3 5 2MnO4- +16H++10Fe2+→2Mn+2 +8H2O +10Fe2+ раствор обесцветился 3) 2KMnO4+3H2SO4+5Na2SO3=5Na2SO4+2MnSO4+K2SO4+3H2O MnO4- +8H++5ē→Mn+2 +4H2O 2 SO32-+ H2O -2ē→SO42-+2H+ 5 2MnO4- +8H++5SO32-+5H2O →2Mn+2 +8H2O+5SO42- 2MnO4-+5SO32-→2Mn+2 +3H2O+5SO42-+2H+ раствор обесцветился (Б) Нейтральная среда 1) 2KMnO4+3Na2SO3+H2O =2MnO2 +3Na2SO4+2KOH MnO4- +4H++3ē→Mn+2 +2H2O 2 SO32-+ 2OH- -2ē→SO42-+H2O 3 2MnO4--+3SO32-+H2O →2Mn+2 +3SO42-+2OH- выпал бурый осадок. 2) 2KMnO4+3MnSO4+2H2O→5MnO2+K2SO4+2H2SO4 MnO4- +8H++3ē→MnO2 +2H2O 2 Mn+2 -2ē +2H2O→MnO2 +4H+ 3 2MnO4- +16H++3Mn2++6H2O →2MnO2 +4H2O +3MnO2+12H+ 2MnO4-+3Mn2++2H2O →5MnO2+4H+ раствор стал бурого цвета. (В) 2KMnO4+KOH +Na2SO3 =Na2SO4 +2K2MnO4 +H2O MnO4- +ē→ MnO4- 2 SO32-+ 2OH- -2ē→SO42-+H2O 1 2MnO4-+SO32-+2OH- →2MnO4-+SO42-+ H2O раствор стал изумрудного цвета. Заключение: из проведенных реакции следует, что перманганат калия обладает наибольшими свойствами окислителя в кислой среде. Вывод: В ходе данной лабораторной работы я познакомился с наиболее распространенными окислителями, восстановителями и продуктами их взаимодействия между собой, а также научился составлять уравнения ОВР. Санкт-Петербург 2021 |
