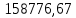Производство сульфата аммония. Расчет материального и теплового баланса установки G=2 тч продукта. Производство сульфата аммония. Расчет материального и теплового баланса установки G2 тч продукта
 Скачать 236.54 Kb. Скачать 236.54 Kb.
|
|
4.2. Тепловой баланс Исходные данные: Температура газов на входе в контактный аппарат Твх. =30 0С; Температура газов на выходе из контактного аппарата Твых. = 55 0С; Решение. Реакция протекает по уравнению:  Схема тепловых потоков веществ: Контактный аппарат   NH3 NH3 (ост.) NH3 NH3 (ост.)   H2SO4 H2SO4 (ост.) H2SO4 H2SO4 (ост.)  (NH4)2SO4 (кр.) (NH4)2SO4 (кр.)Уравнение теплового баланса  где    ; ;  . .Так как реакция образования сульфата аммония экзотермическая, то  . Тогда уравнение теплового баланса будет выглядеть: . Тогда уравнение теплового баланса будет выглядеть: Из справочника физико-химических величин, выписываем необходимые для расчета данные (табл. 4). Таблица 4 Термодинамические свойства веществ
Находим Q1 – физическое тепло, вносимое входящими жидкостями. Для этого определяем количество теплоты, вносимое каждой жидкостью при температуре 30 0С. 1.1. Переводим температуру на входе из 0С в К: Твх.= 30 + 273 = 303 К. 1.2. Рассчитываем мольную теплоемкость для каждого вещества при 303 К:    1.3. Переводим мольную теплоемкость в удельную:   1.4. Количество теплоты, вносимое каждой жидкостью:  ; ; = 63,70 МДж. = 63,70 МДж.1.5. Теплосодержание входящих веществ:  = 63,70 МДж. = 63,70 МДж.2. Находим  - теплоту экзотермической реакции. Для этого рассчитываем тепловой эффект реакции по уравнению Кирхгоффа при температуре в аппарате. - теплоту экзотермической реакции. Для этого рассчитываем тепловой эффект реакции по уравнению Кирхгоффа при температуре в аппарате.2.1. Определяем тепловой эффект реакции при стандартных условиях:   2.2. Переводим температуру на выходе из 0С в К: Твых.= 55 + 273 = 328 К. 2.3. Рассчитываем температуру в аппарате:  2.4. Вычисляем коэффициенты, необходимые для решения уравнения Кирхгоффа:  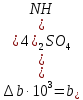  2.5. Определяем тепловой эффект реакции при температуре 316 К по уравнению Кирхгоффа:  = =  2.6. Определяем количество теплоты, выделяемое в результате протекания реакции:  2.7. Определяем количество теплоты, отнесенное к 2 молям аммиака:  2.8. Рассчитываем количество тепла, выделяемое из 1 кг аммиака:  2.9. Находим сколько аммиака прореагировало в результате реакции:  . .2.10. С учетом прореагировавшего аммиака, теплота экзотермической реакции:  3. Определяем количество тепла, поступившего в контактный аппарат:  = 3858,42 МДж. 4. Находим Q4 – физическое тепло, уносимое выходящими газами. Для этого определяем количество теплоты, уносимое каждым газом при температуре 328 К. 4.1. Рассчитываем мольную теплоемкость для каждого вещества при температуре 328 К:  0 0     4.2. Переводим мольную теплоемкость в удельную:    4.3. Количество теплоты, уносимое каждым газом:  = ==0 МДж;  = ==11,99 МДж;   = 146,79 МДж. = 146,79 МДж.4.4. Теплосодержание выходящих газов:  =0 =0 5. Таким образом, Qприх.  ( ( МДж) – тепла расходуется меньше, чем подводится в контактный аппарат, поэтому необходимо отвести тепло из системы. МДж) – тепла расходуется меньше, чем подводится в контактный аппарат, поэтому необходимо отвести тепло из системы. 6. В результате проведенных расчетов видно, что: 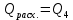 . .7. Уравнение теплового баланса в конечном итоге имеет вид:   . .8. Все данные сводим в таблицу теплового баланса (табл. 5). Таблица 5 Тепловой баланс контактного аппарата
Таким образом Qприх. = Qрасх. . Заключение В данной работе рассчитаны материальный и тепловой балансы установки производства сульфата аммония 2 т/ч. Основным элементом технологической схемы является сатуратор, в котором происходит насыщение маточного раствора аммиачным газом. Обосновали выбор основного оборудования в производстве сульфата аммония. Рассмотрели физические, химические свойства сульфата аммония. В сухом состоянии обладает хорошими физическими свойствами и при хранении сохраняет рассыпчатость. Производится в крупнокристаллическом виде. Сульфат аммония является наиболее важным и распространенным азотно-минеральным удобрением, которое применяется в сельском хозяйстве. Поэтому необходимо соблюдать условия хранения сульфата аммония и создавать новые технологические решения. В промышленности сульфат аммония получают в виде кристаллов при взаимодействии аммиака и серной кислоты. Самый распространенный и наиболее выгодный метод получения сульфата аммония – полупрямой. Полупрямой метод наиболее распространен, так как надежен, удобен в управлении, сравнительно прост по технологической схеме и экономичен. Список использованной литературы 1. Химия - Основные процессы и аппараты химической технологии / А.Г. Касаткин - М.,2014.-784 с. 2. Улавливание и переработка химических продуктов коксования / Л.Я. Коляндр – Харьков: Металлургиздат, 2013. – 468 с. 3. Пути улучшения показателей сатураторной схемы получения сульфата аммония / Ахременко А.В., Гребенюк А.Ф. /Донецкий национальный технический университет, 2013. 4. Способ выделения аммиака из коксового газа/ Назаров В.Г. Зелинский К.В. Галкин А.П.; / Восточный научно-исследовательский углехимический институт, 27.06.2011. 5. Совершенствование технологии улавливания химических продуктов коксования за рубежом / В.В. Антипов - М.: Черная металлургия, 2013 № 21. с.36-49. 6. Технология коксохимического производства / Р.Е. Лейбович, Е.И. Яковлева, А.Б. Филатов – М.: Металлургия, 2013. – 360 с. 7. Справочник коксохимика. Т. ΙΙΙ / А.К. Шелкова. – М.: Металлургия, 2012. – 348 с. 8. Основы конструирования и расчеты химической аппаратуры. Справочник / А.А. Лащинский, В.А. Толчинский – М., 2014. – 752 с. 9. Расчеты аппаратуры для улавливания химических продуктов коксования. 2-е изд., перераб. и доп. / И.Е. Коробчанский, М.Д. Кузнецов – М.: Металлургия, 2014. – 296 с. 10. Справочник химика. Т. V / Б.П. Никольский – М.: Химия, 2012. – 976 с. 11. Обработка коксового газа: Справочник инженера-технолога. Часть 2 / В.Г. Назаров – ВУХИН. Екатеринбург. 1977. – 281 с. 12. Производство сульфата аммония / Д.С. Петренко – М.: Металлургия, 2013. – 142 с. 13. Общая химическая технология: Важнейшие химические производства/И.П.Мухленов.-4-е изд.-М.:Высш.шк.,2012.- 263с. 14. Основные процессы и аппараты химической технологии: Пособие по проектированию. Под ред.Ю.И.Дытнерского,2-е изд.,М.: Химия,2013.-496 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||