бх 1 вопрос. Протеиногенные аминокислоты подразделяют
 Скачать 159.46 Kb. Скачать 159.46 Kb.
|
|
Строение и свойства аминокислот. Роль первичной структуры в строении и свойствах белков. Факторы устойчивости белков в растворе. Растворимость белков. Денатурация, высаливание. Методы разделения белков сыворотки крови. Аминокислоты – низкомолекулярные органические соединения, состоящие из одной или двух аминогрупп (- NH2) и одной или двух карбоксильных групп (- COOH), которые определяют соответственно их щелочные или кислотные свойства. Большинство аминокислот находятся в организме в свободном состоянии, но лишь 20 из них являются структурными элементами белков. Такие аминокислоты называют протеиногенными (которые образуют протеины, то есть белки). Все аминокислоты – растворимые в воде кристаллические вещества, не имеющие цвета. Протеиногенные аминокислоты подразделяют: • По строению бокового радикала – неполярные (алифатические, ароматические) и полярные (незаряженные, отрицательно и положительно заряженные); • По кислотно-основным свойствам – электрохимическая. Подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты. • По необходимости для организма (физиологическая классификация) – незаменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две аминокислоты являются условно незаменимыми (Арг. Гис). Все они содержат аминогруппу (- NH2), имеющую щелочные свойства, и карбоксильную группу (- COOH), имеющую кислотные свойства. Основные аминокислоты содержат более одной аминогруппы, а кислые – больше одной карбоксильной группы. Аминокислоты соединяются в молекуле белка с помощью пептидной связи, которая возникает между карбоксильной группой одной аминокислоты и аминогруппой другой с выделением молекулы воды. При соединении большого количества аминокислот образуется полипептид. Белковая молекула может состоять из одной или нескольких полипептидных цепей. Аминокислоты отличаются по строению боковых цепей, которые отмечаются буквой R (радикал). 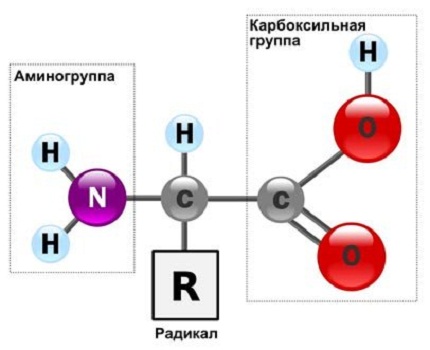 ЗАМЕЧАНИЕ 1 Благодаря наличию радикалов аминокислоты могут вступать в разнообразные химические реакции, в том числе и после того, как они войдут в состав белковой молекулы. В связи с этим белкам присуща высокая реакционная способность. Значение аминокислот У растений все необходимые аминокислоты синтезируются из углекислого газа, воды и аммиака. Человек и много других животных потеряли способность синтезировать некоторые протеиногенные аминокислоты, которые незаменимыми в питании. Они обязательно должны получать эти аминокислоты с пищей. К ним относятся лейцин, изолейцин, лизин, треонин, валин, фенилаланин, аланин, триптофан, метионин, гистидин. 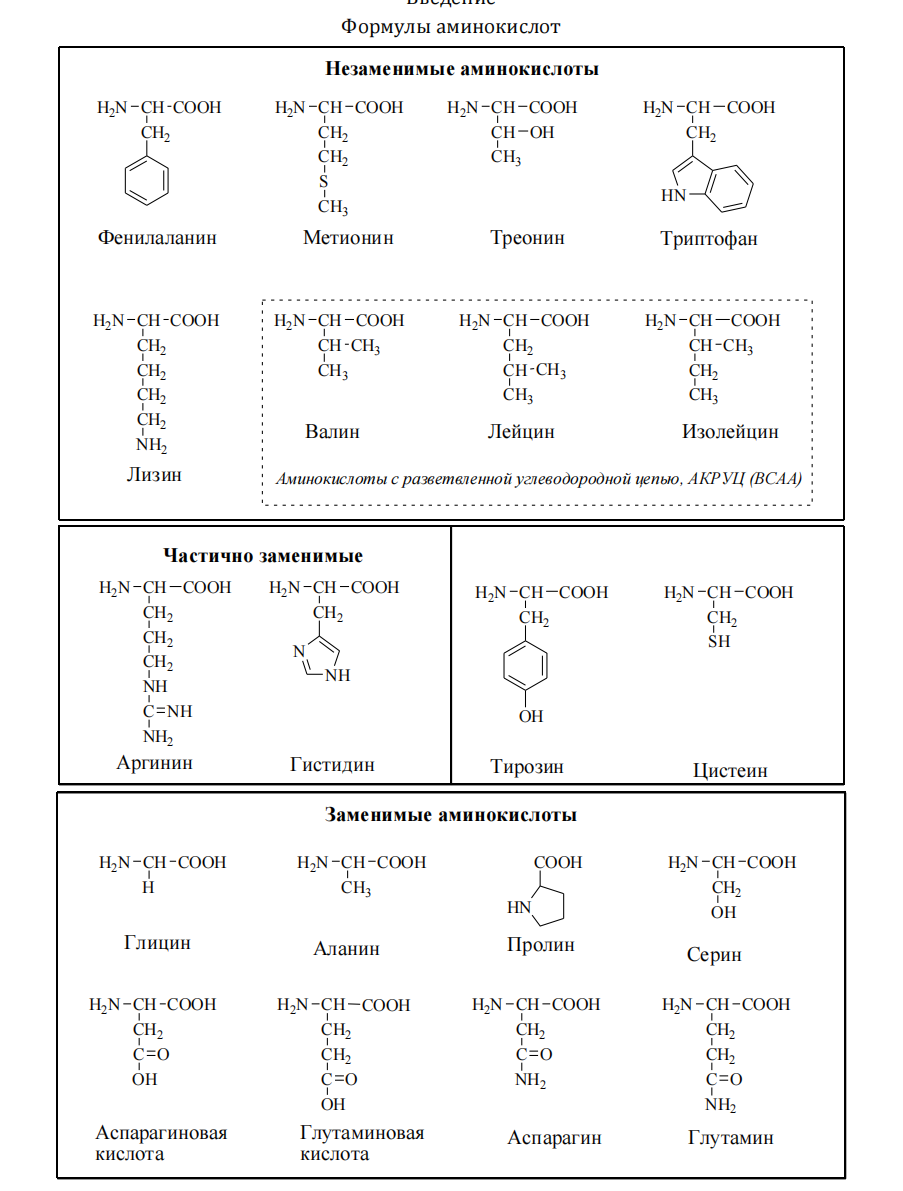 СТРОЕНИЕ БЕЛКОВ Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок. Пептидная связь — это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты. При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс ,,-ил", только последняя аминокислота сохраняет свое название неизменным. Например, аланил-серил-триптофан или γ-глутаминил-цистеинилглицин, по-другому называемый глутатион. СВОЙСТВА ПЕПТИДНОЙ СВЯЗИ 1. Копланарность Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы Н и О расположены по разные стороны от пептидной связи, 2. Транс-положение заместителей (радикалов) аминокислот по отношению к C-N связи, 3. Наличие кето- и енольной форм. 4. Способность к образованию двух водородных связей с другими группами, 5. Пептидная связь имеет частично характер двойной связи. В результате она является жесткой структурой и вращение вокруг нее затруднено. Но, благодаря тому, что кроме пептидной в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов). ФУНКЦИИ БЕЛКОВ 1. Структурная: • в соединительной ткани – коллаген, эластин, кератин • построение мембран и формирование цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин, гликофорин. • построение органелл – рибосомы 2. Ферментативная –Практически все ферменты являются белками. Хотя в последнее время обнаружили существование рибозимов, т.е. РНК, обладающих каталитической активностью. 3. Гормональная.Регуляция и согласование обмена веществ в разных клетках организма – инсулин, гормон роста. 4. Рецепторная.Избирательное связывание гормонов, медиаторов. 5. Транспортная Перенос веществ в крови (липопротеины, гемоглобин, трансферрин) или через мембраны (Na+,К+-АТФаза, Сф2+-АТФаза) 6. Пищевая и резервная – яичный альбумин, казеин молока. 7. Защитная – иммуноглобулины, белки свертывания крови. Существуют белки, которые являются предметом особого изучения: Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению Резилин – почти идеальная эластичность, составляет „шарниры" в местах прикрепления крыльев насекомых Белки со свойствами антифриза – обнаружены у антарктических рыб, предохраняют кровь от замерзания П ЕРВИЧНАЯ СТРУКТУРА Это последовательность аминокислот в полипептидной цепи. Учитывая, что в синтезе белов принимает участие 20 аминокислот можно сказать о невообразимом количестве возможных белков. Например, 2 аминокислоты (аланин и серин) образуют 2 пептида Ала-Сер и Сер-Ала; 3 аминокислоты дадут уже 6 вариантов трипептида; 20 аминокислот – 1018 различных пептидов длиной всего 20 аминокислот (при условии, что каждая аминокислота используется только один раз). У человека обнаружено около 100 тысяч различных белков. Первичная структура белков задается последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка. Например, при серповидно-клеточной анемии в 6 положении b-цепи гемоглобина происходит замена Глу на Вал. Это приводит к синтезу Hb S - такого гемоглобина, который в дезоксиформе полимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа (банана), теряют эластичность и при прохождении через капилляры разрушаются. Этов итоге приводит к анемии, снижению оксигенации тканей и их некрозу. Если изменение последовательности аминокислот носит не летальный характер, а приспособительный или хотя бы нейтральный, то такой белок может передаться по наследству и остаться в популяции. В результате возникают новые белки и новые качества организма. такое явление называется полиморфизм Например, возникновение групп крови АВ0 связано с тремя вариантами белка, осуществляющего присоединение к олигосахариду мембран эритроцитов либо N-ацетилгалактозы (группа А), либо галактозы (группа В), либо белок вообще не имеет ферментативной активности (группа 0). Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичной и четвертичной структур. Факторы стабилизации белка в растворе.ГИДРАТНАЯ ОБОЛОЧКА- это слой молекул воды, определенным образом ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами . +Чем больше гидрофильных свойств у белковой молекулы, чем больше в ее составе и на ее поверхности аминокислот с полярными (гидрофильными) радикалами, тем сильнее выражена и прочнее удерживается гидратная оболочка и тем больше в ней слоев. Вода гидратной оболочки обладает особыми свойствами: она не является свободной, а связана с белковой молекулой. Это - “связанная” вода. Она принадлежит белку, и поэтому имеет особые свойства. РАСТВОРИМОСТЬ Так как белки несут много заряженных групп, то они водорастворимы. Растворимость связана: • со взаимоотталкиванием молекул • с гидратацией белков – чем больше полярных аминокислот, тем больше гидратная оболочка (на 100 г белка может быть 30-50 г воды) Таким образом, растворимость белков зависит от заряда и наличия гидратной оболочки. Исчезновение одного или обоих этих факторов ведет к осаждению белков. Методы осаждения белков 1. Высаливание — добавление солевых растворов (Na2SO4, (NH4)2SO4). Анионы и катионы соли взаимодействуют с зарядами белка и, в результате, заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно пропадает гидратная оболочка. Это ведет к «слипанию» молекул и осаждению. Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены. Например, таким способом можно определять соотношение альбумины/глобулины. Альбумины, как более полярные молекулы, остаются в растворенном состоянии при 50% насыщении раствора нейтральными солями, в то время как глобулины в этих условиях уже осаждаются. В норме соотношение равно 1,5-2,3. Однако, не следует забывать, что при низких концентрациях соли способны взаимодействовать с ионными группами белков, отвечающих за внутримолекулярные взаимодействия, приводить к их раскрытию и повышать растворимость. 2. Осаждение водоотнимающими средствами (ацетон, этанол) При этом происходит лишение белка гидратной оболочки, но не заряда, растворимость несколько снижается, но денатурации не наступает .Например, антисептическое действие этанола. 3. Изменение рН ведет к исчезновению заряда в изоэлектрической точке, исчезновению гидратной оболочки и снижению растворимости белков. ДЕНАТУРАЦИЯ Это разрыв связей, стабилизирующих четвертичную, третичную, вторичную структуры. 1. Физическая: повышение температуры, ультрафиолетовое и микроволновое излучение, механические воздействия, ионизация заряженными частицами. 2. Химическая: • Кислоты и щелочи образуют водородные связи с пептидными группами • Органические растворители образуют водородные связи и вызывают дегидратацию • Алкалоиды и тяжелые металлы образуют связи с полярными группами и разрывают систему водородных и ионных связей Белки плазмы крови. Кровь состоит из плазмы и взвешенных в ней форменных элементов. Плазма составляет около 55% от объема крови. Эритроциты составляют основную массу форменных элементов – 44%. Из 9-10% сухого остатка плазмы крови на болю белков приходится 6,5-8,5%. Общее содержание белков составляет 60 – 80 г/л. Для разделения белков плазмы крови используют следующие методы: Высаливание. Разделение белков проводят с использованием солей щелочных и щелочноземельных металлов. Наиболее часто используют сульфат аммония. Различные белки высаливаются из растворов при разных концентрациях растворов сульфата аммония: альбумины выпадают при 100% насыщении, глобулины при 50%. При действии сульфата аммония, ацетона, спирта белки теряют гидратную оболочку, утрачивают устойчивость и выпадают в осадок. В результате высаливания получают 2 фракции: Альбумины – 40 – 50 г/л Глобулины – 20 – 30 г/л На долю фибриногена приходится – 2 – 4 г/л. Плазма, лишенная фибриногена, называется сывороткой. В условиях клинических лабораторий для разделения белков сыворотки крови применяют метод электрофореза. Сыворотка – плазма, не содержащая фибриноген и др. факторы свертывания (т.е. жидкость, которая остается после формирования сгустка крови). Высаливание. Для высаливания применяют соли в разных концентрациях. При малой концентрации солей осаждаются наиболее крупные, тяжелые и обладающие наименьшим зарядом частицы. При повышенной концентрации солей выпадают все более мелкие частицы и устойчивые белковые фракции. При использовании 33%-ного раствора (NH4)2SO4выпадают белки сыворотки крови, имеющие наибольший молекулярный вес – эйглобулины, при 50%-ной концентрации – псевдоглобулины, при 100%-ной – самые «легкие» альбумины. Белки, осажденные сульфатом аммония, почти не денатурируются; после удаления соли из белкового осадка (диализом через целлофановую мембрану) ее растворяют и используют для различных целей. Чтобы лишить высокомолекулярные частицы устойчивости, необходимо удалить их водные оболочки и снять электрический заряд. При электрофорезе в поддерживающих средах имеет значение размер пор геля (молекулярно-ситовой эффект геля) и размеры молекул белка. Электрофорез на бумаге. Сыворотку крови наносят на бумажную полоску, смоченную буфером. Концы бумажной полосы опущены в раствор электролита, где находятся электроды источника постоянного тока. При замыкании электрической цепи белковые молекулы движутся со скоростью. Пропорциональной величине заряда. За единицу времени проходят разные расстояния, т.е. оказываются на разных участках бумажной полосы. Электорфорез основан на передвижении заряженной частицы в электрическом поле. Белки сыворотки крови различаются по молекулярной массе, заряду и изоэлектрической точке. На основании этих различий белки разделяются в электрическом поле. В зависимости от условий проведения разделения различают электрофорез на бумаге, в растворе и в геле: крахмала, целлюлозы и полиакриламидном геле. а) Электрофорез на бумаге позволяет получить 5 белковых фракций: 1. Альбумины. 2. 1-глобулины. 3.2-глобулины. 4.-глобулины. 5.-глобулины. б) Электрофорез в крахмальном геле позволяет получить 10 фракций. в) Электрофорез в полиакриламидном геле позволяет получить до 18 фракций. При электрофорезе в полиакриламидном геле используют пары буферных растворов с различными значениями рН и различной степени пористости гель. Изоэлектрофокусировние – проведение электрофореза в поддерживающих средах с градиентом рН. Нахождение белка определяется его изоэлектрической точкой. Иммунофорез представляет собой комбинацию электрического и иммунологического методов. Происходит электрофорез и реакция преципитации в одной среде. Иммуноэлектрофорез – сочетание электрофореза в агаровом геле и иммунодиффузии. После электрофоретического разделения белков в канавку, идущую параллельно пути движения антигенов, вносят перциптирующую иммунную сыворотку. Антигены и антитела диффундируют на месте встречи дугообразные полосы преципитации. 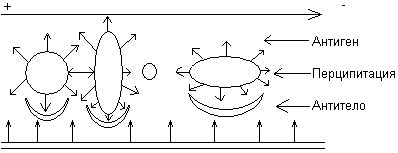 Электрофорез основан на способности белков перемещаться в электрическом поле. Для функционирования белков сыворотки крови чаще всего используют веронал-мединаловый буфер с рН 8,6. При этом значении рН белки заряжаются отрицательно и движутся к аноду. В связи с различием в размерах молекул и в величине заряда скорость движения белков самые малые и имеющие наибольший заряд альбумины, затем -,-, и-глобулины. +Скорость передвижения белка в электрическом поле зависит от его электрофоретической подвижности. |
