КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ. Протоколы диагностики и лечения острого панкреатита
 Скачать 442.5 Kb. Скачать 442.5 Kb.
|
Рекомендации Эндоскопическое транспапиллярное стентирование панкреатического протока пластиковым стентом диаметром 10 Fr показано при наличии одиночной стриктуры с увеличением диаметра протока более 6 мм и отсутствием множественного вирсунголитиаза. Замена стента должна выполняться в течение года с момента установки даже при отсутствии симптомов окклюзии стента (уровень доказательности C). Эндоскопическое устранение билиарной гипертензии при хроническом панкреатите показано при клинически значимом холангите и механической желтухе. Стентирование желчных протоков проиводится множественными билиодуоденальными пластиковыми стентами. Каждые 3 месяца требуется замена стентов. Курс лечения составляет 1 год (уровень доказательности А). Эндоскопическое внутреннее дренирование постнекротической кисты ПЖ показано в случаях прилежания полости кисты к стенке желудка или двенадцатиперстной кишки, размере кисты более 5 см, отсутствии в ее просвете крупных секвестров (уровень доказательности В). Цистопанкреатоеюностомия «открытым» способом или через мини-доступ показана при постнекротических кистах большого размера любой локализации с наличием хорошо сформированной капсулы, крупными секвестрами в полости (уровень доказательности В). Показанием для наружного дренирования постнекротической кисты является абсцедирование, отсутствие сформированной капсулы или возможности выполнить более сложное вмешательство из-за тяжести состояния больного или технических причин (уровень доказательности А). Продольная панкреатоеюностомия показана при наличии протоковой гипертензии и расширении ГПП за счет его стриктур или камней на уровне перешейка, тела и хвоста ПЖ и отсутствии фиброзного перерождения головки и крючковидного отростка ПЖ (уровень доказательности С).
Резекционные вмешательства на ПЖ в настоящее время хорошо разработаны и являются приоритетными, поскольку позволяют радикально устранить осложнения ХП, обусловленные фиброзно-кистозным перерождением головки или дистального отдела органа [44]. Существует несколько вариантов резекции головки ПЖ, каждый из которых имеет строгие показания [15, 52]. Резекция головки ПЖ с продольным панкреатоеюноанастомозом (операция Фрея) обеспечивает надежное устранение панкреатической гипертензии и удаление большей части фиброзно измененной ткани головки ПЖ, как предложено в модифицированном в 2003 году варианте операции [26,60]. ПП вскрывают на всем протяжении. Ткань головки и крючковидного отростка иссекают, с сохранением не более 5 мм паренхимы, прилежащей к стенке двенадцатиперстной кишки, интрамуральной части общего желчного протока и воротной вене. С краями образовавшейся полости в головке ПЖ и вскрытого ПП формируют анастомоз с Ру-петлей тощей кишки непрерывным обвивным швом рассасывающейся монофиламентной нитью. Ру-петлю длиной не менее 60 см проводят через брыжейку поперечной ободочной кишки. Эта операция не обеспечивает полного обнажения из ткани ПЖ терминального отдела общего желчного протока и воротной вены. За счет большой раневой поверхности в зоне резекции головки, крючковидного отростка и рассеченного ГПП в ближайшем послеоперационном периоде высока вероятность возникновения раннего кровотечения в просвет анастомоза. Субтотальная резекция головки ПЖ (бернский вариант резекции головки ПЖ). При этом варианте резекции объем удаляемой ткани ПЖ увеличивается за счет полного иссечения паренхимы, прилежащей к интрамуральной части общего желчного протока. При наличии желчной гипертензии, механической желтухи просвет желчного протока может быть вскрыт. Образовавшиеся лоскуты стенки желчного протока подшивают к оставшейся ткани железы. ПП, при наличии в нем камней или стриктур, рассекают, как при операции Фрея. Ру-петлю тощей кишки подшивают по периметру резецированной головки, крючковидного отростка и ПП. Недостатком этой операции является реальная возможность возникновения стриктуры общего желчного протока внутри полости анастомоза [31]. При наличии протяженной стриктуры общего желчного протока вскрывать его просвет в образовавшейся после резекции головки полости не целесообразно. Наиболее надежным способом устранения желчной гипертензии является наложение гепатикоеюноанастомоза на отключенной по Ру петле тощей кишки. Субтотальная резекция головки ПЖ с пересечением перешейка ПЖ (операция Бегера). ПЖ мобилизуют в области перешейка, под которым создают туннель, обнажающий переднюю поверхность конфлюенса воротной вены. Воротную и верхнюю брыжеечную вену выделяют из рубцового футляра, окружающего и сдавливающего вены. Ткань головки и крючковидного отростка резецируют с оставлением полоски паренхимы вдоль медиальной стенки двенадцатиперстной кишки и терминальной части общего желчного протока толщиной не более 5 мм. Культя тела железы и остатки паренхимы вдоль стенки ДПК анастомозируют с Ру-петлей тощей кишки двумя соустьями. Панкреатодуоденальная резекция при ХП является вынужденной операцией, к которой прибегают в случаях, когда, несмотря на весь арсенал лучевых методов диагностики, не удается исключить наличие опухоли ПЖ. Кроме того, показанием для ПДР служит наличие дуоденальной дистрофии в сочетании с фиброзно-кистозным перерождением головки ПЖ. Дистальная резекция ПЖ при ХП выполняется в случаях, когда не удается исключить наличие опухоли хвоста ПЖ; в редких случаях - при постнекротических кистах, полностью замещающих хвост ПЖ, при условии отсутствия нарушения оттока секрета по ПП в области тела и головки ПЖ, что требует наложение цистопанкреатоеюноанастомоза. При выполнении дистальной резекции ПЖ, в случаях, когда селезеночные сосуды удается отделить от стенок постнекротической кисты, следует избегать спленэктомии. Рекомендации Резекция головки ПЖ с продольным панкреатоеюноанастомозом (операция Фрея) показана при фиброзной трансформации головки ПЖ, панкреатической гипертензии, обусловленной калькулезом ПП или его стриктурами (уровень доказательности С). Бернский вариант резекции головки ПЖ показан при наличии не только фиброзного перерождения паренхимы головки, но и билиарной гипертензии (уровень доказательности С). Субтотальная резекция головки ПЖ по Бегеру показана при наличии перечисленных осложнений в сочетании с портальной гипертензией, обусловленной сдавлением конфлюенса воротной вены (уровень доказательности С). Панкреатодуоденальная резекция показана в случаях, когда не удается исключить наличие злокачественной опухоли головки ПЖ, а также при фиброзном изменении головки ПЖ в сочетании с дуоденальной дистрофией, а также (уровень доказательности D). Дистальная резекция ПЖ показана в случаях, когда не удается исключить наличие опухоли хвоста ПЖ, возможно выполнение этой операции пр и постекротической кисте ПЖ, замещающей паренхиму дистальной части органа (уровень доказательности С).
Больные с ЛА 1 типа на момент установления диагноза, практически, всегда находятся в тяжелом состоянии, обусловленным анемией из-за рецидивирующих кишечных кровотечений. Из-за тяжести состояния пациентов радикальное хирургическое лечение выполнить не возможно. На первом этапе лечения необходимо добиться прекращения рецидивирующих кровотечений за счет срочного эндоваскулярного вмешательства [25, 35]. Рекомендуются следующие варианты эндоваскулярных вмешательств: окклюзия артерии дистальнее и проксимальнее шейки аневризмы (рис. 1); окклюзия полости аневризмы и афферентной артерии (рис. 2); эндопротезирование артерии покрытым стентом на уровне шейки аневризмы (рис. 3). 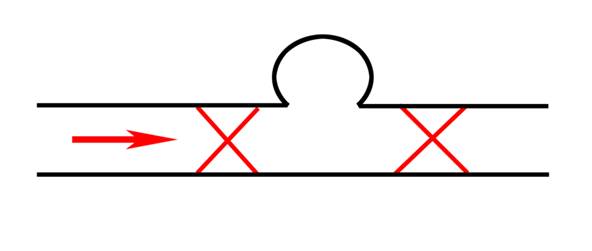 Рис. 1 Окклюзия артерии дистальнее и проксимальнее шейки аневризмы 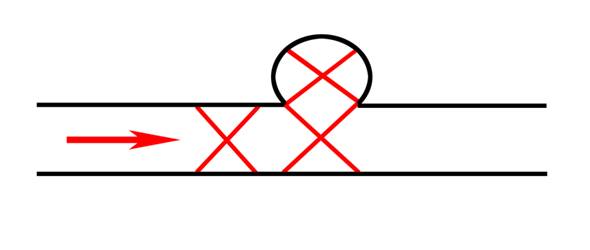 Рис. 2. Окклюзия полости аневризмы и афферентной артерии 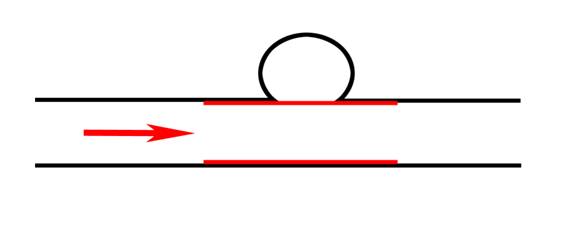 Рис. 3. Эндопротезирование артерии покрытым стентом на уровне шейки аневризмы Эндоваскулярное «выключение» ЛА из кровотока позволяет устранить рецидивирующие кишечные кровотечения. Однако, за счет сообщения полости ЛА 1 типа с просветом ПП, воздействие панкреатического сока приводит к лизису тромботических масс через 2-3 недели после эмболизации (за исключением случаев, когда выполнено эндопротезирование покрытым стентом) [6]. После интенсивной подготовки, направленной на устранение анемии и гипопротеинемии, необходимо проведение радикального хирургического вмешательства, направленного на устранение осложнений ХП, приведших к возникновению ЛА. Ложные аневризмы 2 типа, не имеющие сообщения с ПП, подлежат эндоваскулярному лечению, которое обеспечивает тромбирование полости аневризмы [6]. Рекомендации Больные с ЛА 1 типа подлежат двухэтапному лечению: эндоваскулярному устранению кишечного кровотечения за счет «выключения» ЛА из кровотока с последующим радикальным хирургическим лечения осложнений ХП (уровень доказательности С). При ЛА 2 типа показано эндоваскулярное лечение (уровень доказательности D).
Операции при ХП сопровождаются большим числом послеоперационных осложнений, достигающих 20-40% [5, 12]. В тех случаях, когда паренхима ПЖ, на момент операции не утратила секреторной активности, имеется реальная угроза возникновения послеоперационного панкреатита и формирования панкреатических свищей [3, 12]. Обширные резекции головки ПЖ с большой площадью раневой поверхности, создают условия для возникновения ранних кровотечений в просвет панкреатоеюноанастомоза. Послеоперационный панкреатит является частым осложнением после операций на ПЖ. Макроскопические проявления панкреатита в виде стекловидного отека парапанкреатической клетчатки и даже бляшек стеатонекроза могут регистрироваться уже во время операции [3]. В ближайшем послеоперационном периоде клиническими признаками панкреатита являются проявления эндогенной интоксикации (стойкая тахикардия при отсутствии гиповолемии, акроцианоз, угнетение самостоятельного дыхания), выделение из брюшной полости по дренажным трубкам экссудата бурого цвета с высоким содержанием амилазы, гастростаз и паралитическая кишечная непроходимость. Перечисленные симптомы свидетельствуют о развитии панкреонекроза. Биохимическим маркером панкреатита является повышение уровня амилазы в крови свыше 500 ед/л. Лечение послеоперационного панкреатита должно быть консервативным и проводиться в условиях отделения реанимации [3]. Схема базисной консервативной терапии включает антибактериальную терапия с целью профилактики и лечение септических осложнений; подавление секреции ПЖ, желудка и двенадцатиперстной кишки; устранение гиповолемии с коррекцией водно-электролитных и метаболических нарушений; улучшение реологических свойств крови; профилактику и лечение функциональной недостаточности желудочно-кишечного тракта; анальгетическую и антиферментативную терапию. При панкреонекрозе целесообразно использование экстракорпоральных методов детоксикации. В качестве профилактики послеоперационного панкреатита следует использовать октреотид в дозе 100-300 мкг подкожно 3 раза/сутки в течение 5 дней в зависимости от тяжести заболевания. Возможно назначение препарата в суточной дозе до 1200 мкг с использованием внутривенного пути введения [2]. Необходимость в экстренном хирургическом лечении возникает лишь при панкреонекрозе, осложнившимся распространенным гнойным перитонитом, как правило, обусловленным несостоятельностью швов панкреатодигестивного анастомоза [33]. Панкреатические свищи являются результатом послеоперационного панкреатита, на фоне которого возникает несостоятельность швов панкреатодигестивных анастомозов или культи ПЖ после дистальных резекций [40]. Панкреатические свищи делятся на 3 типа (табл. 6) [16]. Таблица 6 Классификация ПС по ISGPF(2005)
1Признаки инфекции включают гипертермию более 38°C, лейкоцитоз и наличие гнойного отделяемого по ПС. 2Повторная госпитализация в течение 30 дней после выписки из стационара. Рекомендации Послеоперационный панкреатит требует проведения интенсивной консервативной терапии в условиях отделения реанимации (уровень доказательности А). Показанием к хирургическому лечению является гнойный перитонит, обусловленный панкреонекрозом и несостоятельностью швов панкреатодигестивного анастомоза (уровень доказательности С). Панкреатические свищи подлежат консервативной терапии и динамическому наблюдению с обеспечением адекватного оттока панкреатического секрета. При наличии панкреатического свища имеется реальная угроза возникновения аррозионного кровотечения (уровень доказательности А). Внутрибрюшное и кишечное кровотечения. Вероятность возникновения кровотечения после резекционных операций на ПЖ достигает 10%, при этом летальность составляет 1,2% [38, 45] (уровень доказательности А). Кровотечения после резекционных операции на ПЖ следует классифицировать согласно рекомендациям международной группы исследователей в области хирургии ПЖ (ISGPS) [51], при этом учитываются следующие факторы: 1 - время начала кровотечения - 24 часа после завершения операции, разграничивают ранние и поздние кровотечения; 2 - тяжесть кровотечения - показатель гемоглобина и необходимость переливания компонентов крови; 3 - источник и локализация кровотечения – внутрипросветное (в просвет желудочно-кишечного тракта), либо внутрибрюшное кровотечение [54] (уровень доказательности А). Время начала кровотечения (ISGPS., 2007 г.): раннее – возникает в первые 24 часа после операции, вызвано техническими причинами: неадекватный гемостаз во время операции, коагулопатия, повреждение стенки сосуда коагуляцией при выполнении лимфадиссекции; позднее – возникает более чем через 24 часа от момента окончания операции; причинами кровотечения являются послеоперационный панкреатит и панкреатический свищ, внутрибрюшные абсцессы, изъязвления на месте анастомоза, формирование артериальной псевдоаневризмы (уровень доказательности А) [6]. В многоцентровом исследовании, проведённом E. Yekebas (2007) на основе анализа 1669 резекционных вмешательств на ПЖ, модифицирована классификация кровотечений по степени тяжести ISGPS (уровень доказательности А) [53]. 1. «Сторожевое кровотечение», характеризуется непродолжительным поступлением небольшого количества крови по дренажам из брюшной полости или назогастральному зонду, может быть рвота «кофейной гущей» или мелена; отсутствуют клинические проявления острой кровопотери (тахикардия, снижение артериального давления), уровень гемоглобина не понижается более 15 г/л. Кровотечение прекращается самостоятельно, необходимости в гемотрансфузии нет. При этом рецидив кровотечения возможен в течение 12 часов. 2. Неинтенсивное пострезекционное кровотечение характеризуется поступлением крови по дренажам из брюшной полости, снижением уровня гемоглобина до 30 г/л, наличием клинических проявлений острой кровопотери либо без них. 3. Интенсивное пострезекционное кровотечение характеризуется снижением уровня гемоглобина более 30 г/л, наличием выраженных клинических проявлений острой кровопотери [53]. Раннее послеоперационное кровотечение. Специфической особенностью операций при ХП (продольная панкреатоеюностомия, операция Фрея, бернский вариант резекции головки ПЖ) является образование большой раневой поверхности паренхимы ПЖ и значительная протяженность рассечения стенки тощей кишки, используемой для анастомозирования. В результате в ближайшем послеоперационном периоде может возникать кровотечение в просвет анастомоза как из паренхимы ПЖ, так и стенки тощей кишки. Клинические проявления сводятся к общим симптомам острой кровопотери и мелене. Раннее не интенсивное кровотечение в просвет панкреатоеюноанастомоза подлежит консервативному лечению. При интенсивном кровотечении следует выполнить экстренное ангиографическое исследование, с последующей эмболизацией кровоточащего сосуда. При отсутствии возможности выполнить эндоваскулярное вмешательство выполняют экстренное хирургическое лечение. При релапаротомии необходимо разобщить переднюю губу панкреатоеюноанастомоза и прошить кровоточащий сосуд, после чего произвести реанастомозирование. Недопустимо делать энтеротомию через переднюю губу анастомоза, так как это неизбежно приводит к несостоятельности швов из-за нарушения кровоснабжения кишечной стенки. Позднее послеоперационное кровотечение. Позднее кровотечение, являющиеся аррозионным, создает реальную угрозу для жизни больного и требует при неинтенсивном кровотечении консервативной терапии, а при интенсивном кровотечении – экстренного эндоваскулярного вмешательства с эмбилизацией аррозированного сосуда или экстренной релапаротомии [4, 5]. При релапаротомии необходимо учитывать состояние панкреатодигестивного анастомоза, культи ПЖ и парапанкреатической клетчатки. Кровотечение на момент операции может прекратиться, что существенно затрудняет выявление его источника. Послеоперационный панкреонекроз и некротический парапанкреатит, в сочетании с аррозионным кровотечением из магистральных сосудов, является неблагоприятным фактором и, как эксклюзивная мера, может потребовать выполнения экстирпации поджелудочной железы и спленэктомии. Рекомендации Поcлеоперационные неинтенсивные кровотечения требуют консервативной терапии. Для уточнения источника кровотечения следует выполнить ангиографию (уровень доказательности А). При обнаружении во время ангиографического исследования кровоточащей артерии показано выполнение ее эмболизации (уровень доказательности В). При интенсивном кровотечении и отсутствии возможности выполнения эндоваскулярного вмешательства требуется экстренное хирургическое лечение. При кровотечении из мягких тканей и при отсутствии панкреонекроза, некротического парапанкреатита возможно обеспечить гемостаз за счет прошивания. При аррозионном кровотечении из магистральных сосудов (мезентерикопортальный ствол, селезеночная вена, артерии бассейна чревного ствола и верхняя брыжеечная артерия), возникшем в результате послеоперационного панкреонекроза, возможно выполнение панкреатэктомии и спленэктомии (уровень доказательности D). Заключение ХП является часто встречающимся заболеванием, поражающим работоспособное население. При несвоевременном радикальном лечении болезнь приводит к стойкой инвалидности, ухудшает качество и уменьшает продолжительность жизни. При кажущейся простоте диагностики ХП не редко возникают трудности в проведении дифференциального диагноза с опухолевым поражением ПЖ и прилежащих органов. Для определения тактики лечения этих больных, выбора оптимального варианта предстоящей операции, необходимо комплексное лучевое обследование. Последнее должно выполняться на современной аппаратуре, а интерпретация полученных данных осуществляться профессионалами высокого класса. Операции, направленные на устранение осложнений ХП, относятся к числу наиболее сложным в абдоминальной хирургии и сопровождаются значительным количеством осложнений. Эффективное радикальное лечение больных ХП может быть обеспечено лишь в специализированных клиниках, обладающих большим опытом лечения этого заболевания. ХОЛЕЦИСТИТ Острый холецистит Проект Национальных клинических рекомендаций Диагностические критерии острого холецистита Оценка многоцентрового анализа диагностических критериев в Токийском соглашении 2013 по острому холециститу (TG13) показывает, что их чувствительность (91,2%) и специфичность (96,9%) являются убедительными. Диагностические критерии острого холецистита имеют высокую чувствительность и высокую специфичность (рекомендация 1, уровень B).
С. Визуализация Ультразвуковая диагностика острого холецистита. В силу своего удобства и отсутствия инвазии, низкой стоимости, доступности и отсутствия радиационного облучения УЗИ следует считать лучшим вариантом среди диагностических тестов для этого заболевания. Ультрасонография должна быть выполнена во всех случаях, при которых подозревается острый холецистит (рекомендация 1, уровень A). УЗИ является скрининговым тестом, который должен быть выполнен в первую очередь в каждом случае подозрения на острый холецистит. [12,13]. В докладе Chatziioannou и соавт. [14] проведено обсуждение 107 случаев УЗИ при остром холецистите с точки зрения его диагностической ценности и было обнаружено, что чувствительность его составила 50%, специфичность 88% и точность 77%. На основании мета-анализа пяти исследований с обработкой данных 532 случаев обследования больных с острым холециститом Shea и соавт. показали, что диагностические возможности УЗИ при остром холецистите составляют: чувствительность 88% (95% ДИ 0.74-1.00) и специфичность 80% (95% ДИ 0.62-0.98) [15]. Ультрасонография показывает 5088% чувствительность и 8088% специфичность. Это, главным образом, увеличенный желчный пузырь, утолщение стенки желчного пузыря, камни желчного пузыря и наличие эхо-взвеси. Диагноз острого калькулезного холецистита можно установить, когда одновременно имеют место следующие признаки:
Согласно отчета Cohan и соавт. [16], которые исследовали 51 случай заболевания и выявили утолщение стенки желчного пузыря лишь в 13 случаев острого холецистита; так называемый гипоэхогенный участок стенки желчного пузыря (гипоэхогенный слой) показал 8% чувствительность (95% ДИ 0-22.1) и 71,0% специфичность (95% ДИ 56.6-85.5). Изображения, полученные при ультразвуковом исследовании, играют важную роль в дифференциации острого неосложненного холецистита от гангренозного холецистита. Многие признаки при УЗИ при гангренозном холецистите встречаются и при остром неосложненном холецистите. Характерными сонографическими находками, свидетельствующих о гангренозных изменениях желчного пузыря, являются:
Ультразвуковой признак Мэрфи показывает высокую специфичность и является полезным для уточнения диагноза. Ультразвуковой симптом Мэрфи характеризуется болью, которая возникает, при нажатии на желчный пузырь ультразвуковым датчиком во время его исследования. Это превосходит значение клинического признака Мэрфи потому, что что можно нажать на желчный пузырь прицельно. На основании рассмотрения 219 случаев болей в правом подреберье Ralls и соавт. сообщили, что ультразвуковой признак Мэрфи несколько уступает выявлению клинического симптома Мэрфи по чувствительности (63,0%, 95% ДИ 49.1-77.0%), хотя превосходит в специфике (93,6%, 95% ДИ 90.0-97.3%). Они так же обнаружили, что в популяции пациентов с подозрением на острый холецистит, камни в желчном пузыре, как одиночный признак, показало положительное прогностическое значение в 88%. Если у больных имеется сочетание камней в желчном пузыре и положительный ультразвуковой симптом Мэрфи, то положительная прогностическая ценность увеличилась до 92%. У больных с желчными камнями с утолщенной стенкой желчного пузыря и наличием положительного сонографического признака Мэрфи - положительная прогностическая ценность составляет уже 94%. [19]. Bree и соавт. которые исследовали 200 случаев болевого синдрома в правом подреберье (из них в 73 случаях был острый холецистит), показали хорошую чувствительность ультразвукового симптома Мэрфи (86,3%, 95% ДИ 78.4-94.2%), хотя специфичность была ниже (35,0% 95% ДИ 26.4-43.0%), поэтому присутствие желчных камней следует учитывать при постановке диагноза [20]. Расширение общего желчного протока (более 8 мм) и камни в желчном пузыре на УЗИ, наличие желтухи и увеличенных показателей содержания печеночных ферментов в крови - свидетельствуют о холедохолитиазе. [ 21,22]. Признак ультразвукового симптома Мэрфи также может быть использован, чтобы отличить острый холецистит от случаев наличия положительного признака Мэрфи при других заболеваниях, таких как, например, как осложненная язва двенадцатиперстной кишки. Ультразвуковой признак Мэрфи показывает высокую специфичность и это полезно для создания диагноза. Таким образом, результаты УЗИ нельзя считать хорошим показателем для диагностики острого холецистита. Наличие низко-звукоотражательной области с нерегулярной множественной структурой, показывая чувствительность 62% (95% ДИ 35.1-88.0) и 100% специфичность (95% ДИ 100-100), имеет более высокую диагностическую ценность [16]. Таким образом, использование других методов, таких как МР холангиография, следует рассматривать положительно в зависимости от условий. С другой стороны, Tessler соавт., которые исследовали небольшое количество аналогичных случаев обнаружили, что явные доплеровские сигналы наблюдаются и в обычных случаях (без острого холецистита) и что изображение сигнала становится более значительным после приема пищи. Кроме того, Джеффри и др. провели детальное обсуждение 54 случаев больных, перенесших операцию по поводу острого холецистита и 115 здоровых людей, включая области интереса и обнаружили, что наличие или отсутствие сигнала изображения само по себе не является характерным для острого холецистита. Они выявили присутствии сигнала кровотока, проходящего в передней половине стенки желчного пузыря (частота встречаемости 26% по сравнению с 2% у здоровых людей), и обнаружили, что сигнал изображения на дне пузыря является более убедительным признаком заболевания (частота выявления 0% для обычных случаев и 19% у больных острым холециститом) [17]. На основании приведенных выше наблюдений, показана возможность установления диагноза острого холецистита с помощью цветной допплерографии. Однако обнаружение и интерпретация доплеровских сигналов зависит от мощности и качества настройки инструментов, используемых при исследованиях, а также телосложения пациентов. Преимущества Doppler исследования являются важными для установления диагноза острого холецистита. (рекомендация 2, уровень C). В то время как крупные камни общего желчного протока хорошо идентифицируются, мелкие камни могут быть трудно выявляемы сонографически. При клиническом подозрении, а также для диагностики холедохолитиаза, билиарного панкреатита или холангита должны быть применены дополнительные виды лучевой диагностики, такие как магнитно-резонансная холангиопанкреатография (MРХГ), эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) или интраоперационная холангиография. Компьютерная томография в диагностике острого холецистита Хотя УЗИ является важным первичным исследованием для пациента с болями в правом подреберье, лихорадкой, лейкоцитозом и положительны симптомом Мэрфи - такое классическое представление не может быть типичным в повседневной практике при диагностике острого холецистита [21]. КТ часто проводится у пациентов с целью более широкой дифференциальной диагностики, при наличии признаков и симптомов, болевого синдрома, который выходит за границы правого подреберья. КТ также может быть выполнена в экстренных случаях, когда имеется необходимость оценить наличие осложнений острого холецистита. Эти причины, а также более широкое использование КТ для проведения стратификации больных в отделениях неотложной хирургии - требуют использования КТ диагностики острого холецистита и его осложнений. Использование КТ резко увеличилось в последние годы в США: с 3 миллионов сканирований в 1980 году до более чем 62 миллионов сканирований в год - с более 90% чувствительностью при исследовании заболеваний и их осложнений в брюшной полости. [24]. Типичные результаты КТ при остром холецистите включают в себя определение наличия следующих показателей: увеличение размеров желчного пузыря (качественная оценка), утолщение стенки желчного пузыря (более 3 мм), наличие камней в желчном пузыре, выявление перипузырной жидкости, повышение плотности тканей в перипузырной жировой клетчатке, наличие поперечно-полосатой стенки желчного пузыря (чередующихся областей низкого и высокого затухания, имеющих относительно высокую специфичость в 89,9%), увеличение плотности прилегающей к желчному пузырю паренхимы печени (также имеющую высокую специфичность в 89,3%), явления перипузырного абсцесса, наличие внутрипросветных мембран (представляющих собой десквамацию слизистой оболочки желчного пузыря), прерывистость или отсутствие стенки желчного пузыря, газ в стенке или в просвете желчного пузыря, увеличение толщины слизистой оболочки пузыря. В ретроспективном обзоре анализа предоперационной КТ у 29 пациентов с доказанным острым холециститом, 59% больных имели утолщение стенки желчного пузыря, 52% из них - повышение плотности тканей в перипузырной жировой клетчатке, у 41% выявлена жидкость в свободной брюшной полости, из них у 31% перипузырно. [ 25]. Желчный пузырь считали увеличенным, если он был больше 5 см в ширину и больше 8 см в длину. Утолщение стенки было определено не более 4 мм в неспазмированном желчном пузыре (с короткой осью больше, чем 2 см) [25]. Наиболее частым осложнением острого холецистита является развитие гангрены желчного пузыря (2-38% случаев) с последующей перфорацией (до 10% случаев) [22]. Дефекты слизистой оболочки желчного пузыря или выявление внутрипросветных мембран предлагают наличие гангрены. Трансмуральные дефекты в стенке желчного пузыря могут быть очевидным признаками его перфорации. Эмфизематозный холецистит вызывается вторичной инфекцией стенки желчного пузыря при наличии газообразующих микроорганизмов. Такие больные чаще всего являются диабетиками (30-50%), мужчинами в возрасте 40-60 лет. Эмфизематозный холецистит визуализируется как наличие газа в стенке желчного пузыря. Это часто является предвестником развития гангрены, перфорации и формирования абсцесса. Острый холецистит осложняется образованием перипузырного абсцесса в 3-19% случаев. Абсцесс представляет собой как цельное образование, так в виде перипузырного ободка жидкости. В этой же зоне будет виден утолщенный сальник. Распространение перипузырного абсцесса в соседнюю печеночную паренхиму будет проявляться в виде кистозной массы с отеком окружающей паренхимы печени. Важно иметь в виду, что КТ ненадежно показывает наличие камней в желчном пузыре, может не всегда выявлять утолщение стенки желчного пузыря и не имеет способности обнаруживать симптом Мэрфи. Из-за низкой положительной прогностической ценности КТ выводы, указывающие на острый холецистит, следует интерпретировать с осторожностью. КТ имеет относительно высокую прогностическую ценность (89%) и диагноз острого холецистита вряд ли будет установлен надежно с помощью КТ. КТ имеет высокую чувствительность и специфичность для диагностики острого холецистита с общей точностью 94,3%. Эти данные подтверждают вывод, что КТ исследование является надежным видом визуализации для установки диагноза острого холецистита. КТ признаки также весьма специфичны (96,0%) для выявления пациентов с острым гангренозным холециститом, но с низкой чувствительностью (29,3%). [26-29]. В недавнем ретроспективном исследовании, оценивая полезность ультразвука против КТ при остром холецистите, авторы показали, что УЗИ имеет значительно более высокую чувствительность (83% против 39%), положительную прогностическую ценность (75% против 50%), и отрицательную прогностическую ценность (97% против 89%), чем КТ, и одинаковую специфичность (95% против 93%) [2]. Группой исследователей показано, что хорошее прогнозирование течения острого холецистита можно осуществлять с помощью многомерной модели логистической регрессии с участием КТ характеристик. Общая точность такой модели составляет 95,8%, чувствительность 95,6% и специфичность, 96,3%. Это прогнозирование основано на комбинации всего четыре ключевых характеристик: толщина стенки желчного пузыря (р <0,0001), размеры его короткой оси (р <0,0001), наличие камней (р = 0,006), а также наличие жидкости ( р = 0,05). [24] КТ более полезна при диагностике осложнений острого холецистита, поскольку в ряде случаев она визуализирует перивезикулярные паренхиматозные изменения лучше, чем УЗИ. Перивезикулярное абсцедирование сопровождается уплотнением содержимого с денситометрическими показателями, превышающими плотность желчи. При этом конкременты вне пузыря свидетельствуют о его перфорации. Эти камни могут приводить к эрозии стенок и фистулообразованию окружающих полых органов, таких как двенадцатиперстная кишка (наиболее часто), толстая кишка и холедох. Прямым признаком эрозии желчевыводящих путей является аэрохолия, выявляемая при КТ. Описываются явления частичной тонкокишечной непроходимости, связанные с проникновением камней в тощую кишку. [30]. |
