Ксенобиотики (БИОЛОГИЯ). Пути поступления ксенобиотиков в организм человека
 Скачать 183.7 Kb. Скачать 183.7 Kb.
|
|
Ксенобиотики Ксенобиотики(от греч.xenos– чужой, чужеродный;bios– жизнь) – это чужеродные для организма химические соединения, которые попадая в окружающую среду в значительных количествах, могут вызывать в живых организмах нарушения биохимических и физиологических процессов, структурных компонентов на молекулярно-генетическом, клеточном и организменном уровнях. Воздействие ксенобиотиков может привести к снижению жизнеспособности, плодовитости и вызвать гибель живых организмов, популяций или сообществ. К их числу относятся продукты хозяйственной деятельности человека (промышленность, сельское хозяйство, транспорт); вещества бытовой химии (моющие средства, вещества для борьбы с паразитами, косметические средства); многие лекарственные препараты. Поступление их в окружающую человека среду с каждым годом возрастает. При этом если раньше контакт с подобными соединениями был характерен для ограниченного контингента людей, связанных с определенным видом производственной деятельности, то в настоящее время все большие массы населения контактируют с ними за счет их распространения в быту. В зависимости от интенсивности и времени воздействия неблагоприятных факторов среды на организм формируются разные нарушения здоровья – от донозологических форм до тяжелых заболеваний (А.С. Володин с соавт., 2008). Пути поступления ксенобиотиков в организм человека Пути поступления ксенобиотиков в организм могут быть различными: через легкие, кожу и пищеварительный тракт. Самый простой путь проникновения – через дыхательные пути, так как легкие обладают большой поверхностью всасывания легочных альвеол (100-150 м2), малой толщиной альвеолярных мембран, интенсивным током крови по легочным капиллярам и отсутствием условий для значительного депонирования токсинов. Всасывание летучих соединений начинается уже в верхних дыхательных путях, но наиболее полно осуществляется в легких. Происходит оно по закону диффузии в соответствии с градиентом концентрации. Так поступают в организм многие летучие неэлектролиты: углеводороды, спирты, эфиры и другие соединения. Через легкие в организм могут попадать и быстро всасываться в кровь газы, пары, аэрозоли. Легкие постоянно подвергаются воздействию таких факторов, как сигаретный дым, озон, диоксид азота и другие летучие токсичные вещества. Проникновение веществ через кожу осуществляется через эпидермис, сальные и потовые железы и через волосяные фолликулы. Через кожу хорошо проникают низкомолекулярные и липофильные соединения. Скорость и возможность проникновения ксенобиотиков через кожу зависят от состояния кожного покрова: повреждение рогового слоя и жировой смазки кожи приводит к увеличению всасывания. Всасывание многих веществ происходит через слизистую оболочку полости рта путем простой диффузии и оттуда, минуя печеночный барьер, в кровеносную систему. Жирорастворимые соединения достаточно легко проникают через слизистую оболочку желудка в кровь. На протяжении желудочно-кишечного тракта существующие градиенты pHопределяют скорость всасывания токсических веществ. На их всасывание также влияет кровоснабжение стенки желудка и кишечника, моторика желудочно-кишечного тракта. Из пустого желудка вещества всасываются лучше, чем из наполненного. Если ксенобиотик поступает в желудок с пищей, то возможно взаимодействие с ее компонентами: растворение в жирах и воде, абсорбция белками и т.д., что уменьшает их контакт со слизистой. Некоторые ксенобиотики всасываются через слизистую оболочку желудочно-кишечного тракта путем пассивной диффузии неионизированных жирорастворимых молекул через мембрану клеток. Поэтому их всасывание после еды уменьшается за счет увеличения степени ионизации молекул. Другие соединения всасываются путем активного транспорта с помощью транспортных систем клеточных мембран. Если пища содержит компоненты также всасывающиеся путем активного транспорта (рибофлавин, аскорбиновую кислоту, препараты железа, мясной, растительный и молочный белок), то возникает конкуренция между элементами пищи и ксенобиотиками. Наибольшая скорость всасывания отмечена в тонкой кишке, наименьшая – в толстой. Причиной этого является меньшая площадь поверхности слизистой оболочки этого отдела, и, как правило, более низкая концентрация ксенобиотиков в сравнении с вышележащими отделами.  Влияние пищевых продуктов на всасывание ксенобиотиков: молоко и молочные продукты на 20-80% снижают всасывание тетрациклиновых антибиотиков; молоко увеличивает скорость всасывания нестероидных противовоспалительных средств (бутадион, вольтарен, индометацин и других), препаратов гормонов коры надпочечников (преднизолон, дексаметазон и других); алкогольные напитки, раздражая слизистую желудка, стимулируют секрецию соляной кислоты, задерживают эвакуацию содержимого желудка, что может облегчать всасывание ксенобиотиков и повышать их токсичность. Для уменьшения негативного влияния токсических веществ на слизистую желудка утром на завтрак полезно употреблять овсяную или рисовую крупу, которая при отваривании образует большое количество слизистого отвара. Кроме этого слизистый отвар образуют корень лопуха, ятрышник и другие диетические легкие каши, являясь эффективным средством защиты слизистой желудка от раздражающего действия токсических веществ. После всасывания из желудочно-кишечного тракта, через кожу или легкие чужеродные соединения и их метаболиты могут проходить через барьерные ткани, например, гематоэнцефалический барьер и плаценту. Гематоэнцефалический барьер на уровнях «кровь – мозг» и «кровь – спинномозговая жидкость» – это типичные липопротеиновые мембраны, и чужеродные молекулы преодолевают их также путем простой диффузии, со скоростью, пропорциональной растворимости в липидах. Плацента состоит из активно метаболизирующей ткани, образует сложный барьер между кровообращением матери и плода. Проходя через него, сложные соединения могут далее превращаться в различные метаболиты или накапливаться. Поступление ксенобиотиков в организм обусловлено, с одной стороны, с их собственными свойствами (способностью образовывать прочные связи с мембраной, характером этих связей, обеспечивающих длительность удерживания на белково-липидном комплексе, способностью конкурировать с обычными метаболитами), с другой – свойствами самого организма, определяющими из которых являются: состояние иммунной системы; половые различия; возраст; генетически обусловленная активность ферментов; наличие соматических заболеваний и другие. Многие ксенобиотики жирорастворимы (особенно пестициды), поэтому могут накапливаться в жировых депо. Другие (соли тяжелых металлов, тетрациклиновые антибиотики) – остеотропны, поэтому накапливаются в костях. Чужеродные соединения могут также связываться с белками (и в таком состоянии не могут выводиться через мембраны) и нуклеиновыми кислотами (некоторые антибиотики), приводя к мутациям. Метаболизм ксенобиотиков Превращение и накопление ксенобиотиков в организме человека представлено на рисунке 8. Несмотря на многообразие ксенобиотиков, механизм их воздействия на клеточном уровне одинаков. Прежде всего, они оказывают мутагенный или генотоксический эффект, в результате которого в организме человека возникают мутации в половых и соматических клетках, приводящие к развитию наследственных болезней, либо соматических заболеваний, которые не наследуются. Ферментопатический эффект ксенобиотиков связан с повреждением ферментов тканевого дыхания, биоэнергетики, детоксикации и антиоксидантной защиты, что приводит к развитию патологических реакций. В основе мембранопатологического действия лежит повреждение мембранных рецепторов нейромедиаторов, гормонов и других сигнальных молекул межклеточного взаимодействия, нарушение структуры мембран клеток, митохондрий и лизосом. При метаболических нарушениях ксенобиотики связываются с клеточными рецепторами, медиаторами, гормонами, что приводит к снижению синтеза белков, нарушению окислительно-восстановительных процессов и метаболизма жирных или аминокислот. Многие ксенобиотики могут вызывать иммунологическую сенсибилизацию организма и делать его более чувствительным к другим веществам, становиться причиной разнообразных аллергических состояний. 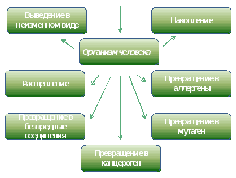 Рис.8. Превращение и накопление ксенобиотиков в организме человека (В.В. Маркина, 2006) При поступлении небольших количеств ксенобиотиков в организм их детоксикация осуществляется обычными путями – с помощью ферментативных и неферментативных превращений. Ведущую роль в ферментативных превращениях играют две фазы детоксикации: I фаза детоксикациипроисходит как окисление (реже восстановление) молекул ксенобиотиков, либо путем их гидролиза (ферменты локализуются в гладкой эндоплазматической сети печени) и осуществляется ферментами семейства цитохромаP-450. В ходе этой фазы возможно образование как биологически неактивных метаболитов, так и химически реактивных электрофильных соединений, более токсичных и даже обладающих канцерогенным действием (Д.В. Парк, 1973). Вступая в ковалентные связи с белками, нуклеиновыми кислотами и другими структурами, они могут оказывать также цитотоксическое и мутагенное действие. Интенсивность метаболизма ксенобиотиков – субстратов изофермента цитохрома P-450 выше у женщин, чем у мужчин (Hunt C.M. et al., 1992; Harris R.Z. et al., 2003). Таким образом, активация ферментов I фазы детоксикации не всегда связана с уменьшением действия токсического эффекта на организм. превращение молекул в I фазе биотрансформации усиливает их полярность и уменьшает способность растворяться в липидах, что способствует выделению уже на этом этапе некоторых ксенобиотиков с мочой. Витамины и минералы оказывают существенное влияние на функционирование цитохрома P-450. Дефицит витаминов A, E, C, PP, B2, фолиевой кислоты приводит к снижению активности цитохром-P-450-зависимой системы и, следовательно, к снижению детоксицирующей функции тканей и органов, прежде всего печени. Важным фактором, снижающим активность цитохрома P-450, является голодание. У лиц пожилого и старческого возраста биотрансформация ксенобиотиков значительно угнетена. Это связано, прежде всего, с уменьшением массы печени на 17-35% и снижением печеночного кровотока на 21-50% Содержание цитохрома P-450 и его активность также снижается при развитии бактериальных и вирусных инфекций. Для поддержания активности I фазы метаболизма ксенобиотиков имеет значение содержания в организме железа, магния, цистеина. Существует целая группа биологически активных веществ продуктов питания, индуцирующих активность цитохрома P-450, которые следует употреблять в пищу: изоцианаты и индолы (капуста, репа, брюква, редька, хрен); сульфиды, ди-, полисульфиды (чеснок, лук); катехины (чай, кофе, красное вино); биофлавоноиды (фрукты, овощи); терпеноиды (специи, фрукты, овощи). Важную роль в индуцировании цитохрома P-450 играют пряности и травы (лавр, розмарин, хмель, зверобой). Необходимо употреблять белковую пищу, содержащую глутатион, глицин (Т.Л. Пилат, Л.П. Кузьмина, Н.И. Измерова, 2012). II фаза метаболизма – конъюгирование(ферменты локализуются в шероховатой эндоплазматической сети). Основной функцией ферментов этой фазы является повышение гидрофильности соединений. Наиболее значимые ферменты относятся к классу трансфераз (глутатионтрансферазы, УДФ-глюкуронилтранферазы, ацетилтранферазы и другие). Повышение их активности защищает организм от химических канцерогенов и токсического воздействия электрофильных метаболитов. Детоксикация имеет место и в нормальных условиях, но играет подчиненную роль. В случае проникновения в организм большого количества ксенобиотиков этих детоксикационных процессов оказывается недостаточно. Системы детоксикации в таком случае должны в короткие сроки перестроиться для включения компенсационных механизмов. Особое значение приобретает при этом не только активация энергетических систем, но и усиленная экспрессия генов в сторону избирательного синтеза тех изоформ ферментов, которые соответствуют структуре ксенобиотиков. Большое значение имеет и осуществление принципа дублирования функций. Он может проявляться по-разному: в способности эндогенных конъюгирующих веществ взаимно заменять друг друга. В частности, такие вещества, как фенол и ацетон, метаболиты нафталина, могут вступать в реакции конъюгации с глюкуронидами, сульфитами, глютатионом, а толуол и ксилол, помимо перечисленных агентов, еще и с глицином. Реакции конъюгации обычно локализуются на эндоплазматической сети, а также в цитоплазме, митохондриях и лизосомах, т.е. внутриклеточное распределение этой функции при необходимости может меняться и расширяться. Так, конъюгация с глютатионом возможна и на эндоплазматической сети, и в цитоплазме, а метилирование еще и в лизосомах (Д.С. Саркисов, 1987); при детоксикации водорастворимых ксенобиотиков, не вступающих в реакции конъюгации. Это достигается наличием нескольких путей биотрансформации. В нормальных условиях может использоваться основной путь, а в экстремальных – включаться дополнительные пути. Во II фазе метаболизма ксенобиотиков важная роль принадлежит активации антирадикальной и антиперекисной защиты организма. В процессе биотрансформации ксенобиотиков образуются супероксидные анионы, перекись водорода, органические перекиси и т.д., которые обусловливают побочное действие ксенобиотиков (от нарушения проницаемости мембран до гибели клеток). Устранение этих эффектов производится системой антиоксидантов (соединений, предотвращающих образование свободных радикалов или обрывающих цепи свободнорадикального окисления). Ведущую роль в ней играют ферменты супероксиддисмутаза, каталаза и другие. Имеются и неферментативные антиоксидантные системы. Это липидорастворимые соединения: витамины А, Е, С, аминокислоты (цистеин, метионин, аргинин, гистидин), мочевая кислота, глютатион. Основным источником антиоксидантов в организме является пища. В организме взрослого человека различным токсическим воздействиям противопоставлены системы детоксикации в виде групп ферментов, активность которых в наибольшей степени выражена на уровне барьерных тканей. Однако в разные периоды онтогенеза активность этих ферментов различна. Так эмбрион и плод практически лишены собственной активности ферментов детоксикации – группа цитохрома Р-450. Лишь к моменту рождения их активность достигает половины от взрослого уровня, а полная активность осуществляется не раньше, чем через 2 месяца после рождения. Поэтому любые ксенобиотики, попадающие в организм плода трансплацентарно (все вещества, имеющие молекулярную массу меньше 1000), могут подвергаться детоксикации только за счет ферментов матери, у которой их активность снижена из-за высокого уровня эстрогенов. Опасность многих ксенобиотиков состоит ещё и в том, что они могут искажать синтез ферментов. Так, вместо цитохрома Р-450 может синтезироваться фермент цитохром Р-448, усиливающий синтез веществ, обладающих выраженными мутагенными и канцерогенными свойствами. Пути выведения ксенобиотиков из организма человека представлены на рисунке 9. 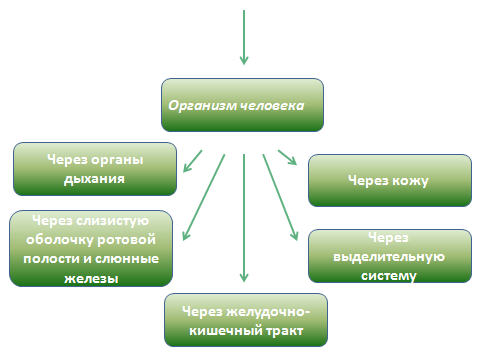 Рис.9. Пути выведения ксенобиотиков из организма человека (В.В. Маркина, 2006) Выведение токсических веществ и их метаболитов из организма происходит в основном через кишечник и почки. Через кишечник удаляются вещества не всосавшиеся в кровь при алиментарном поступлении, выделенные из печени с желчью и поступившие в кишечник через его стенки. При этом ведущее значение имеет выделительная функция печени. В печени метаболизируется около ⅔ всех поступающих в организм ксенобиотиков. Метаболизм ксенобиотиков способствует превращению жирорастроримых веществ в водорастворимые, способные к выведению из организма. Через почки выводятся растворимые в воде соединения, в том числе те, которые стали растворимыми в процессе своей биотрансформации. Степень влияния ксенобиотиков на человеческий организм находится в тесной взаимосвязи с такими факторами окружающей среды, как температура и влажность воздуха, шум, вибрация, различного рода излучения и многое другое. Такое воздействие называется сочетанным. При сочетанном воздействии нескольких химических факторов могут наблюдаться ряд эффектов: независимое действие веществ; взаимное ослабление; взаимное усиление (синергизм). Так, при одновременном воздействии вредных веществ и высокой температуры возможно усиление токсического эффекта за счет ускорения многих биохимических процессов, изменения терморегуляции, потери воды при усиленном потоотделении. Учащение дыхания и усиление кровообращения при этом ведут к увеличению поступления ксенобиотиков в организм через органы дыхания. Расширение сосудов кожи и слизистых повышает скорость всасывания токсичных веществ через кожу и дыхательные пути. Кроме того, высокая температура воздуха увеличивает летучесть различных вредных веществ и тем самым повышает их концентрации в воздухе. При повышенной влажности воздуха возможно изменение агрегатного состояния некоторых ксенобиотиков: растворение газов и образование мельчайших капелек кислот и щелочей, что способствуют возрастанию раздражающего действия. Повышенное атмосферное давление усиливает действие на организм неблагоприятных факторов окружающей среды, так как происходит усиленное поступления вредного вещества в организм в связи с ростом парциального давления газов и паров в альвеолярном воздухе и ускоренным переходом их в кровь; а также вследствие изменения многих физиологических функций, в первую очередь, дыхания, кровообращения, состояния центральной нервной системы и анализаторов. Шум может усиливать токсическое действие оксида углерода, стирола, нефтяных газов, аэрозоля борной кислоты. Совместное воздействие оксидов азота, формальдегида и городского шума вызывало у детей более выраженный негативный эффект по ряду физиологических показателей. Кремниевые пыли, оксид углерода и некоторые другие вещества оказывают более выраженный эффект при совместном с вибрацией воздействии. Совместное действие диоксида серы, оксида углерода и электромагнитных полей уменьшает систолический объем кровообращения; сернистого газа, окисей углерода и азота вместе с электромагнитным полем ухудшает функцию внешнего дыхания; окись углерода и электромагнитное поле так же, как сероуглерод и шум, способствуют увеличению числа людей с пониженной работоспособностью. Установлено, что гипоксия независимо от механизма ее развития является сильнейшим раздражителем нейрогуморальных регулирующих систем, включающих мобилизацию энергетических и структурных ресурсов организма, в частности, внутриклеточного энергетического аппарата, системы транспорта кислорода, ускорение диссоциации оксигемоглобина и др. (Пилат Т.Л., Кузьмина Л.П., Измерова Н.И., 2012). Однако при длительном дефиците кислорода компенсаторные механизмы истощаются и включается ряд патогенных факторов гипоксии, и прежде всего гиперактивация перекисного окисления липидов, изменение работы системы транспорта Са2+ с накоплением его в цитоплазме клетки, дефицит АТФ (Хватова Е.М., 1975; Меерсон Ф.З., Абрикалиев Н.И., 1981; Безрукавникова Л.М., Гончаров И.А., 1990). Основная литература :Гора Е.П. Экология человека : учеб. пособие / Е.П. Гора. – Москва : Дрофа, 2007. – 544 с. Жидкокристаллические дисперсии и наноконструкции ДНК / под ред. Ю.М. Евдокимова. – Москва : Радиотехника, 2008. – 296 с. Маринченко А.В. Экология: учебное пособие / А.В. Маринченко. – Москва : Дашков и Ко, 2009. – 328 с. Нанотехнологии в биологии и медицине / под ред. Е.В. Шляхто. –Санкт-Петербург , 2009. – С. 320. Простаков Н.И. Экология и среда жизни: факторы среды и методы исследования: учеб. пособие / Н.И. Простаков, О.Г. Солодовникова. – Воронеж: Изд-во ВГУ, 2008. – 101 с. Прохоров Б.Б. Экология человека / Б.Б. Прохоров. – Москва : Академия, 2003. – 320 с. Руководство к практическим занятиям по биологии: учебник / под ред. В.В. Маркиной. – Москва: Медицина, 2006. – 392 с. Руководство по биологии для студентов факультетов высшего сестринского образования для медицинских вузов / под ред. А.Н. Пашкова. – Воронеж : Квадрат, 2008. – 370 с. Экология человека: учебник / под ред. А.И. Григорьева – Москва : ГЭОТАР-Медиа, 2008. – 240 с. |
