кребс. Цикл Кребса. Белки углеводы липиды
 Скачать 2.34 Mb. Скачать 2.34 Mb.
|
Цикл Кребса 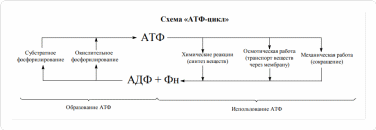 Стадии катаболизма Гидролитическая – I этап – специфический путь – происходит в кишечнике (переваривание пищи) или в лизосомах (самообновление клеток) гидролиз под действием ферментов гидролаз ЖКТ БЕЛКИ УГЛЕВОДЫ ЛИПИДЫ Протеолитические Гликолитические Липолитические Ферменты ферменты ферменты ↓ ↓ ↓ Аминокислоты Моносахариды Глицерин и ЖК Выделяется около 1% энергии, заключенной в молекуле, которая рассеивается в виде тепла. Тканевая – II этап – специфический путь - протекает в цитоплазме клеток и матриксе митохондрий. Часть образованных аминокислот (гликогенные), моносахара и глицерин превращаются в пировиноградную кислоту (ПВК, пируват). Кетогенные аминокислоты и жирные кислоты превращаются в активную уксусную кислоту (ацелил-SКоА) 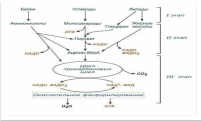 Около 13% выделенной энергии, заключенной в молекуле, запасается в виде АТФ. Общий путь катаболизма – III этап – протекает в митохондриях. Включает два процесса: окислительное декарбоксилирование пирувата до ацетил-КоА включение ацетил-КоА в цикл трикарбоновых кислот. СО2, НАДН2 и ФАДН2 переносят водород в ц.п.э., где образуется Н2О и выделяется АТФ, количество которой составляет около 46%, запасается в виде АТФ. ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА Пировиноградная кислота является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит КоА. Этот процесс катализирует пируватдегидрогеназный мульферментный комплекс. Ферменты пируватдегидрогеназного комплекса
Этапы окислительного декарбоксилирования происходит декарбоксилирование пирувата и перенос С2-фрагмента на ТПФ пируватдекарбоксилазой дигидролипоилтрансацетилаза катализирует окисление гидроксиэтильной группы и перенос ацетильного остатка на липоевую кислоту (ЛК) ацетильный фрагмент переносится на КоАSH с образованием ацетил-КоА и восстановленной формы липоевой кислоты - дигидролипоилтрансацетилаза восстановленная форма липоевой кислоты регенерируется в окисленную при участии ФАД-содержащего дегидролипоилдегидрогеназа Окисление En3-ФАДН2 происходит при участии НАД+, который восстанавливается до НАДН2 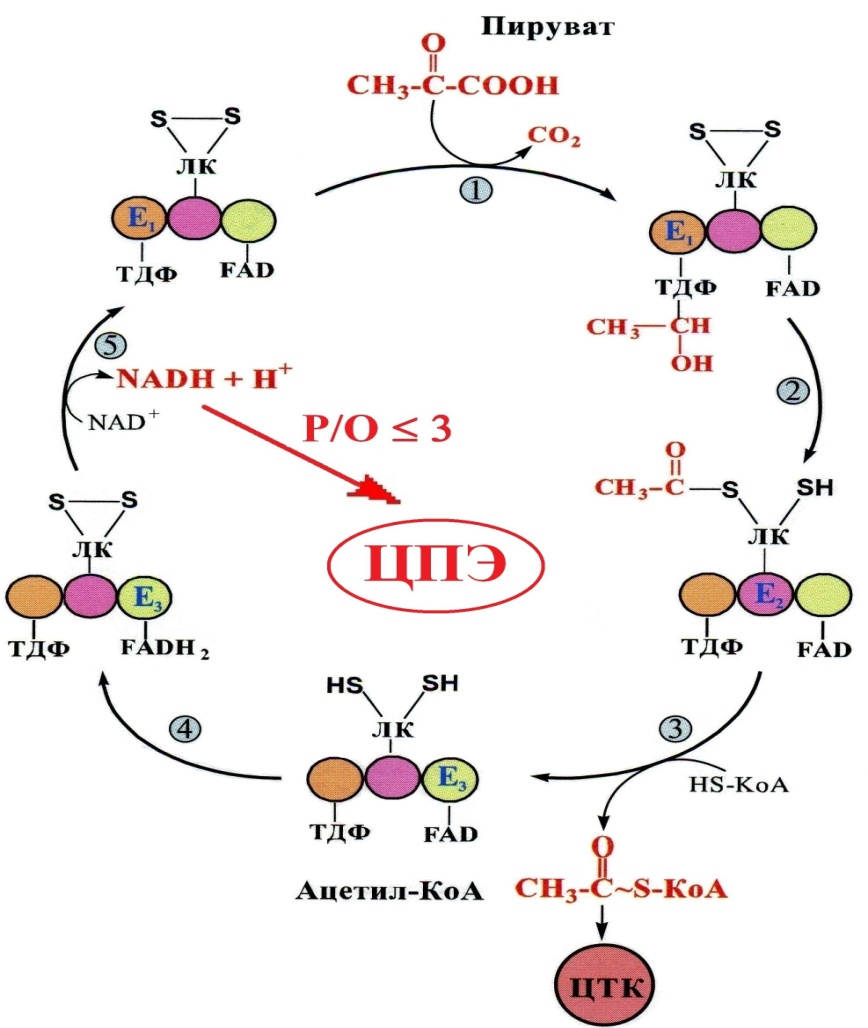 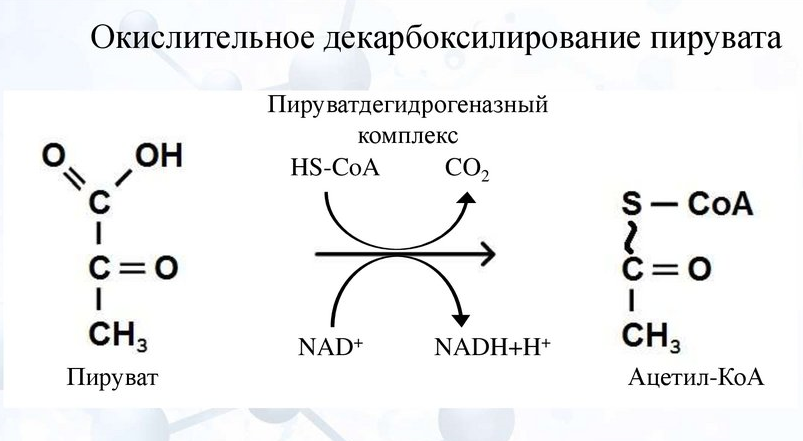 Энергетическая ценность окисления НАДН составляет 3 АТФ. ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (цикл Кребса-Корнберга или лимонной кислоты) Цикл Кребса – заключительный этап катаболизма, циклический процесс, в ходе которого ацетил-КоА окисляется до двух молекул СО2, протекает в матриксе митохондрий, состоит из 8 ферментативных реакций. Атомы водорода при участии НАД- и ФАД-зависимых ферментов передаются в цепь переноса электронов, в результате чего происходит образование АТФ и воды. 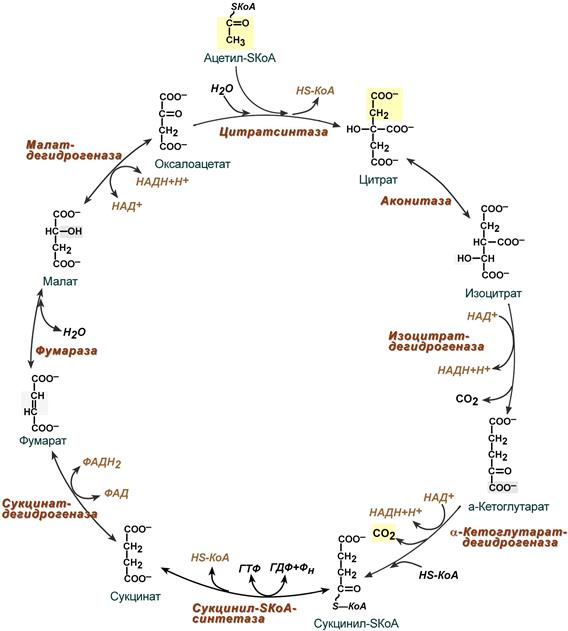 реакция конденсации – цитратсинтаза (класс лиазы) Реакция необратима за счет гидролиза макроэргической связи Связываются ацетил и оксалоацетат (щавелевоуксусная кислота) с образованием цитрата (лимонной кислоты) Этот фермент является аллостерическим 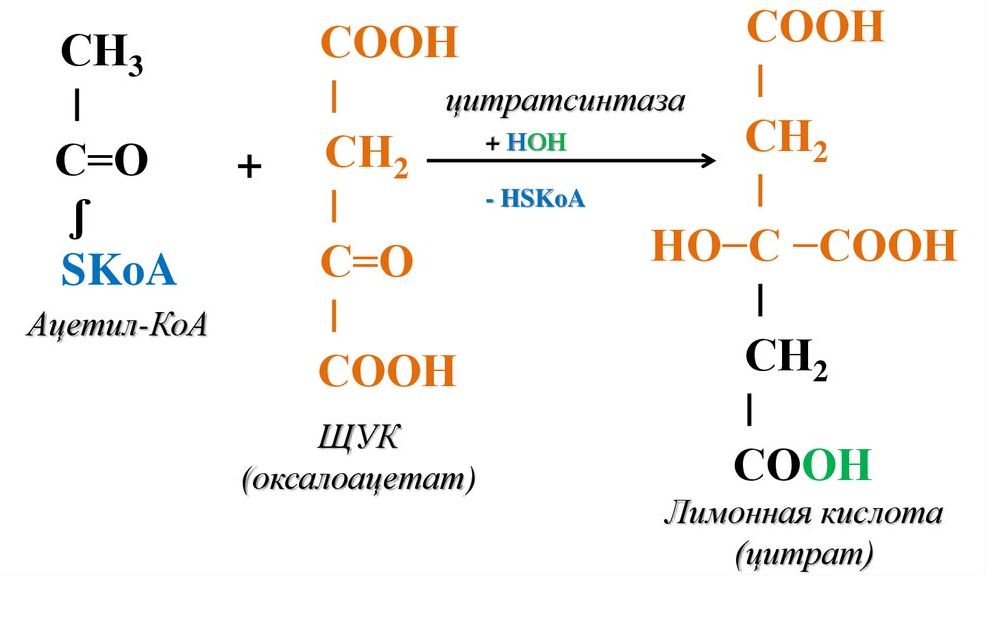  Субстрат: ацетил-КоА оксалоацетат Продукт: Цитрат КoA-SH Фермент – цитратсинтаза Регуляция: активаторы: оксалоацетат инсулин витамин Д3 ингибиторы: АТФ Цитрат сукцинил-КоА жирные кислоты Реакция гидратации-дегидратации – аконитат-гидратаза (аконитаза) катализирует обратимое присоединение и отщепление воды от лимонной кислоты (т.к. превращения происходят по двойной связи цис-аконитовой кислоты, то этот фермент относится к классу лиазы) изомеризация цитрата в изоцитрат протекает через образование промежуточного продукта – аконитат коферментом аконитазы являются – ионы Fe 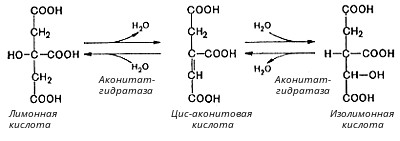  Субстрат – цитрат Продукт – изоцитрат Фермент – аконитаза реакция дегидрирования – НАД-зависимая изоцитратдегидрогеназа одновременно дегидрирует и декарбоксилирует изоцитрат восстановленный НАДН отдает протоны и электроны в дыхательную цепь митохондрий (МХ), где образуется 3 АТФ этот фермент является аллостерическим 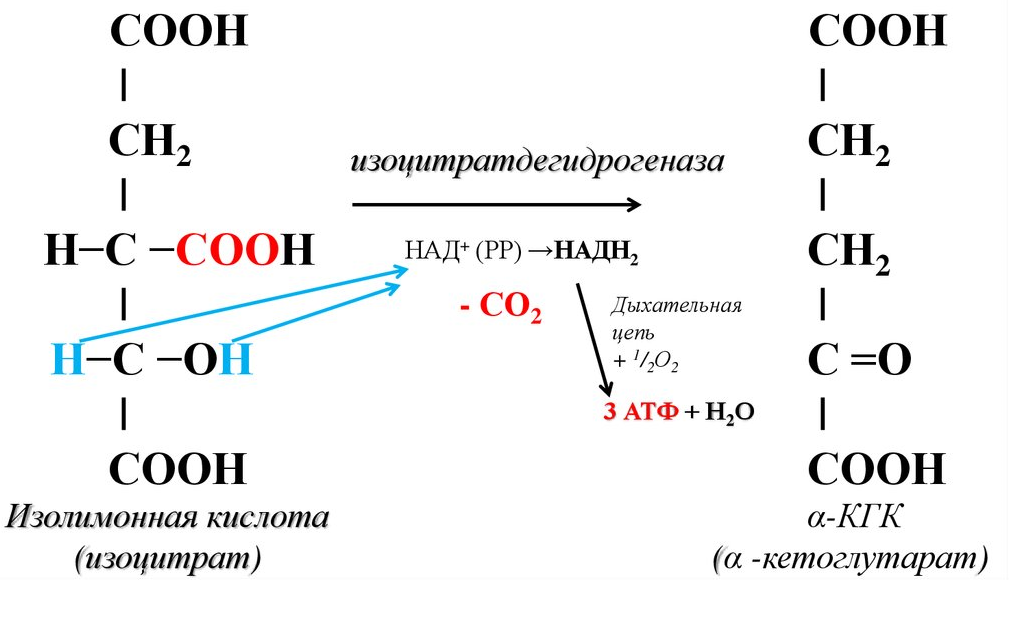  Субстрат – изоцитрат Продукт – α-кетоглутарат Фермент – изоцитратдегидрогеназа Кофермент – НАД Энергетическая эффективность – 3 АТФ Механизм образования АТФ – окислительное фосфорилирование Регуляция – Активаторы: АДФ Mg2+ Mn2+ Ингибиторы: НАДН2 реакция окислительного декарбоксилирования – α-кетоглутарат-дегидрогеназный комплекс это синтез АТФ с участием энергии переноса электронов ферментами внутренней мембраны МХ аллостерический фермент катализирует окислительное декарбоксилирование α–кетоглутарата. Комплекс α–кетоглутаратдегидрогеназа по своему строению аналогичен ПДГ (тоже содержит 3 фермента и 5 коферментов): α–кетоглутаратдекарбоксилаза (тиаминдифосфат В1), дегидролипоилтранссукцинилаза (липоевая кислота), дегидролипоилдегидрогеназа (ФАД В2) Суммарная α–кетоглутаратдегидрогеназная реакция (необратимая) Катализирует образование сукцинил-КоА из ɑ-кетоглутарата (щавелевоянтарной кислоты) Образуется 3 АТФ 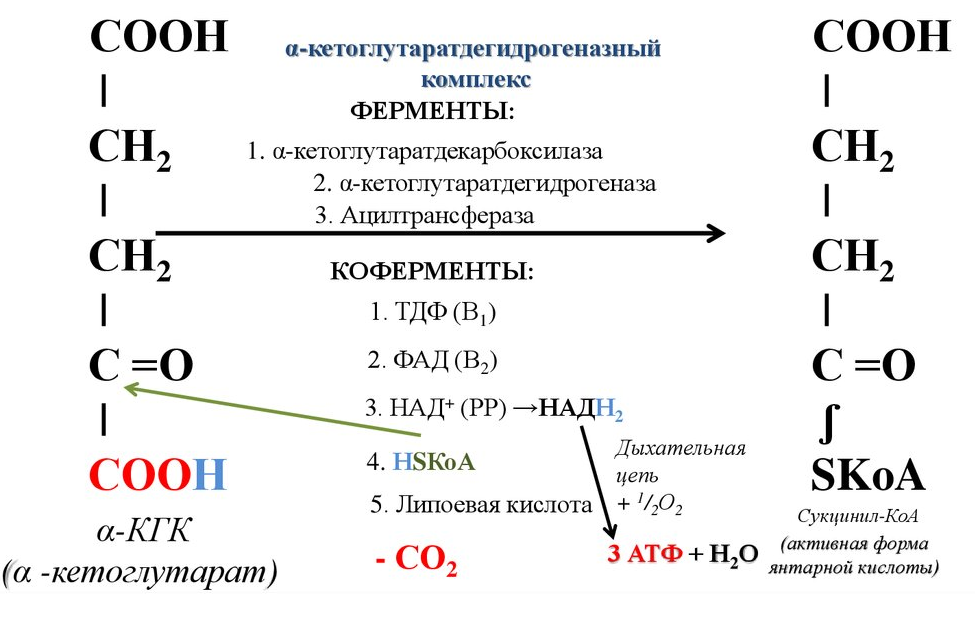  Субстрат – α-кетоглутарат Продукт – сукцинил-КоА CO2 Энергетическая эффективность – 3 АТФ Механизм образования АТФ – окислительное фосфорилирование Реакция субстратного фосфорилирования – сукцинил-КоА-синтаза синтез АТФ с использованием энергии макроэргического субстрата (сукцинил-КоА содержит макроэргическую связь) катализирует превращение сукцинил-КоА в сукцинат (янтарную кислоту) При этом образуется 1 АТФ 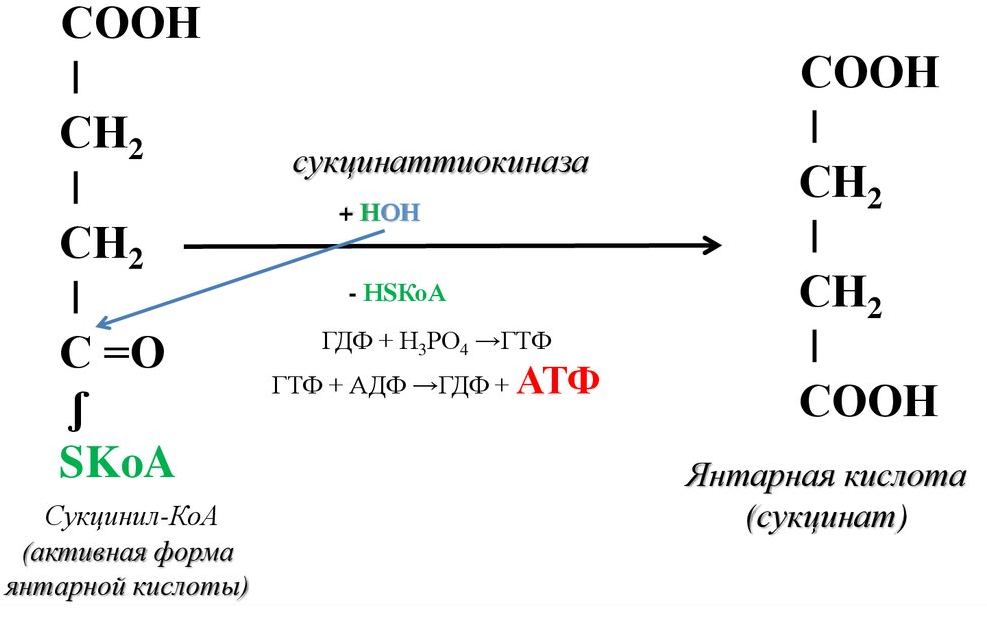  Субстрат: сукцинил-КоА Н3РО4 ГДФ Продукт: Сукцинат ГТФ Кo-ASH Фермент – сукцинаттиокиназа Энергетическая эффективность – 1 АТФ Механизм образования АТФ – субстратное фосфорилирование Реакция окисления-дегидрирования – ФАД-зависимая сукцинатдегидрогеназа катализирует дегидрирование сукцината (янтарной кислоты) в фумарат (фумаровую кислоту) содержит простетическую группу – ФАД Восстановленный ФАДН2 отдает протоны и электроны в МХ дыхательную цепь, где путем окислительного фосфорилирования образуется 2 АТФ отщепляет протоны, находящиеся в транс-положении сукцината Конкурентным ингибитором СДГ является малоновая кислота 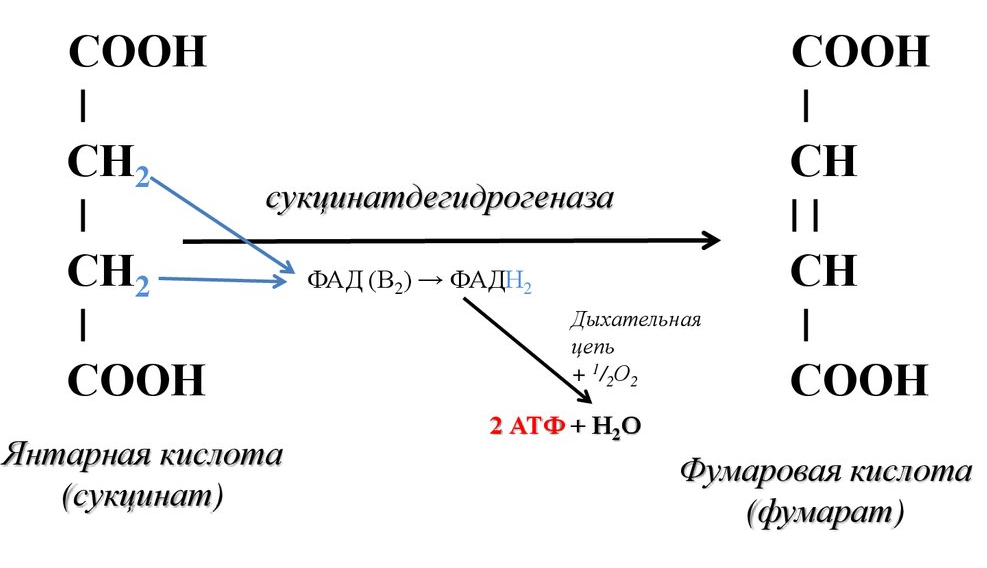  Субстрат – сукцинат Продукт – фумарат Фермент – сукцинатдегидрогеназа Кофермент – ФАД Энергетическая эффективность – 2 АТФ Механизм образования АТФ – окислительное фосфорилировани Реакция гидратации – фумаратгидратаза (фумараза) присоединяет молекулу воды по месту двойной связи (класс лиазы) с образованием яблочной кислоты (малата) фумаратгидратаза обладает стереоспецифичностью, - в ходе данной реакции образуется L-яблочная кислота 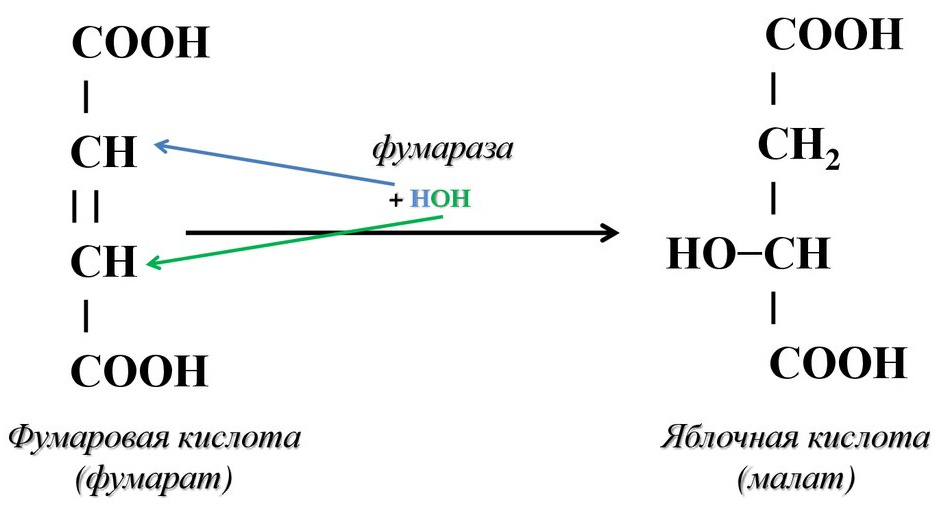  Субстрат: Фумарат вода Продукт – малат Фермент –фумараза Кофермент – нет реакция окисления-дегидрирования – НАД-зависимая малатдегидрогеназа дегидрирует малат с образованием оксалоацетата или щавелевоуксусной кислоты (ЩУК), которая затем вновь включается в новый цикл реакций ЦТК. содержит НАД, который восстанавливается НАДН отдает протоны и электроны в МХ дыхательную цепь, где в реакции окислительного фосфорилирования образуется 3 АТФ 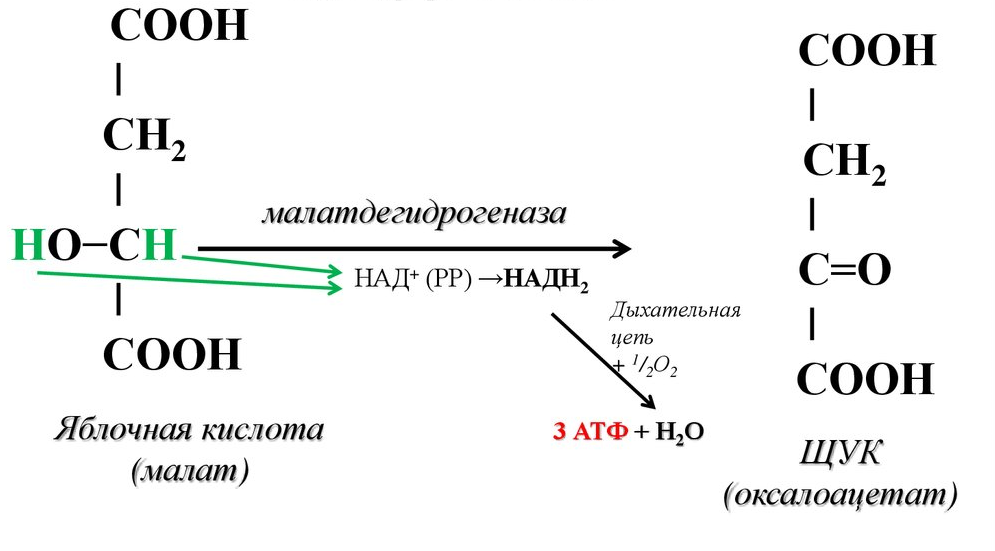  Субстрат – малат Продукт – оксалоацетат Фермент – малатдегидрогеназа Кофермент – НАД Энергетическая эффективность – 3 АТФ Механизм образования АТФ – окислительное фосфорилирование Регуляция: активатор – НАД ингибитор - НАДН2 Суммарная реакции ЦТК:  Ацетил-КоА + 3 НАД + ФАД + 2 Н2О→ КоА SH + СО2 + 3 НАДН + ФАДН2 + АТФ ВСЕГО: 12 АТФ За один цикл происходит: Сгорание 2-х углеродной молекулы Ацетил-КоА с выделением 2-х молекул СО2 Выделение 4 (2Н+ ) в составе 3НАДН2 и 1ФАДН2, которые поступают в митохондриальную ц.п.э. с выделением АТФ путем окислительного фосфорилирования (в расчете на 1 молекулу НАДН2=3АТФ, ФАДН2=2АТФ) = 9 АТФ + 2 АТФ = 11 АТФ Выделение 1 АТФ путем субстратного фосфорилирования. Гормоны 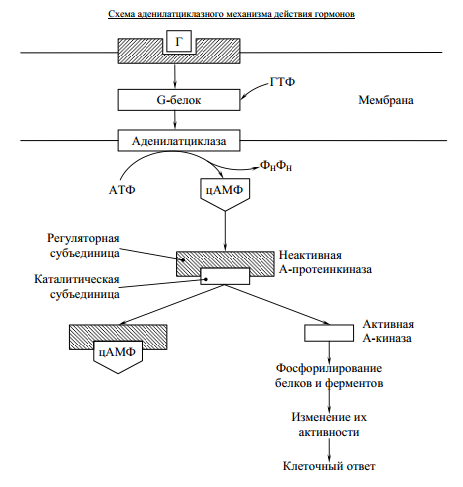 СХЕМА АДЕНИЛАТЦИКЛАЗНОГО МЕХАНИЗМА ДЕЙСТВИЯ ГОРМОНОВ Гормоны (первичные посредники), связываясь с рецепторами на поверхности клеточной мембраны, изменяют конформацию рецептора и увеличивают его сродство к G-белку, при этом образуется комплекс Гормон-Рецептор, который трансформирует сигнал первичного посредника в изменение концентрации вторичных посредников Присоединение Г-Р комплекса к G-белку ГТФ-зависимому Вторичные посредники: цАМФ цГМФ ИФ3 ДАГ СА2+ Образующийся под действием аденилатциклазы цАМФ связывается с регуляторными субъединицамиактивирует протеинкиназы А и вызывает их диссоциацию от каталитических, в результате этого они становятся активными Протеинкиназа-А фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза, гормончувствительная липаза. В результате фосфорилирования активность этих ферментов изменяется. Активация аденилатциклазной системы длится очень короткое время, т.к. G-белок после связывания с аденилатциклазой начинает проявлять ГТФ-азную активность. После гидролиза ГТФ в ГДФ, G-белок восстанавливает свою конформацию и перестает активировать аденилатциклазу, в результате прекращается реакция образования цАМФ, а реакции фосфорилирования в клетке прекращаются не сразу; пока продолжают существовать молекулы цАМФ – будет продолжаться и процесс активации протеинкиназ Для того чтобы прекратить действие цАМФ в клетке существует фермент – фосфодиэстераза, которая катализирует реакцию гидролиза цАМФ до АМФ Некоторые вещества, обладающие ингибирующим действием на фосфодиэстеразу (теофиллин), способствуют сохранению и повышению концентрацию цАМФ в клетке Под действием этих веществ в организме продолжительность активации аденилатциклазной системы становится больше Гормоны, действующие через мембранные рецепторы (цАМФ): Белково-пептидной природы: АКТГ (гипофиз) Кортиколиберин (гипоталамус) Паратгомон (паращитовидные железы) Кальцитонин (нейодсодержащий гормон щитовидной железы) Глюкагон (поджелудочная железа) МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ ЧЕРЕЗ ИОНЫ Са, ИНОЗИТОЛТРИФОСФАТ (ИФ3) И ДИАЦИЛГЛИЦЕРИН 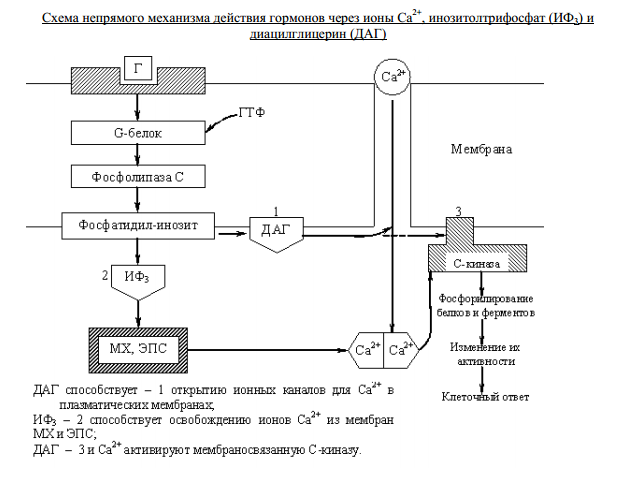 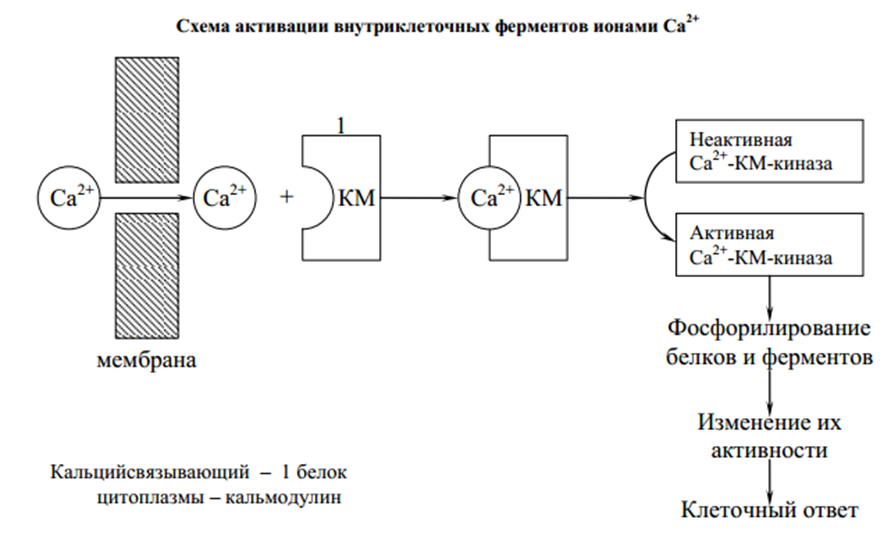 Существует также механизм передачи информации внутри клетки-мишени с участием ионов кальция, диацилглицерина (ДАГ) и инозитолтрифосфата (ИФ3) Гормон образуя комплекс с рецептором = Г-Р, через активацию соответствующих G-белков, присоединение Г-Р комплекса к G-ГДФ снижает сродство к ГДФ и увеличивает сродство к ГТФ, который активирует фосфолипазу С, которая начинает расщепление фосфоинозитолдифосфата (ФИФ2), в результате этого в клетке появляются вторичные посредники: Инозитолтрифосфат (ИФ3) – выходит в цитозоль Диацилглицерол (ДАГ) – остается в мембране Которые являются продуктами гидролиза сложного липида – фосфатидилинозита ИФ3 открывает кальциевые каналы в эндоплазматическом ретикулуме и митохондриях, что вызывает увеличение ионов Са. ДАГ способствует открытию ионных каналов для Са2+ в плазматических мембранах Затем ДАГ и большое количество Са2+ активируют мембраносвязанную активную протеинкиназу-С В результате этого происходит фосфорилирование белков, которое приводит к физиологическому ответу на действие гормона – изменение активности белков-ферментов В работе этого механизма передачи сигналов в клетке-мишени принимает участие специфический Са-связывающий белок – кальмодулин ( низкомолекулярный белок, на 30% состоящий из отрицательно заряженных АК (глу, асп)) и поэтому способен активно связывать Са2+. 1 молекула кальмодулина имеет 4 Са-связывающих участка После взаимодействия с Са2+ происходят конформационные изменения молекул кальмодулина и комплекс «Са-кальмодулин» становится способным регулировать активность многих ферментов – аденилатциклаза, фосфодиэстераза, протеиназы Гормоны, действующие через мембранные рецепторы: Белково-пептидные гормоны: Гонадотропин Вазопрессин Рилизинг-факторы (тиреолиберин) Гормоны, производные АК: Адреналин (катехоламины) 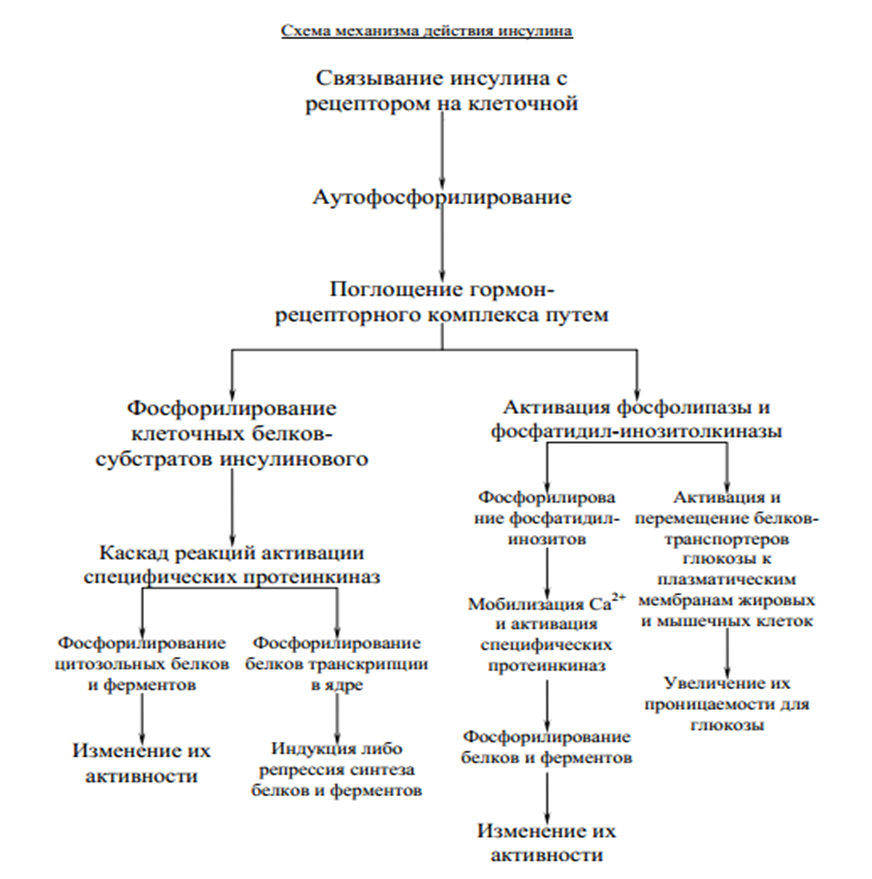 Действие инсулина начинается с его связывания со специфическим рецептором на поверхности клетки-мишени Рецептор инсулина – тирозиновая протеинкиназа, фосфорилирующая белки по ОН-группам тирозина. Рецептор состоит из двух α– и двух β-субъединиц - гликопротеинов с углеводной частью на поверхности мембраны В отсутствие гормона инсулиновые рецепторы не проявляют тирозинкиназной активности Присоединение инсулина к центру связывания на α– субъединицах активирует фермент и происходит фосфорилирование β субъединиц по нескольким тирозиновым остаткам В результате этого активная тирозиновая протеинкиназа начинает фосфорилировать другие внутриклеточные белки и ферменты, что приводит к изменению их активности. Инсулин активирует ферменты фосфолипазу и фосфатидилинозитолкиназы, следствием чего является образование ИФ3 и перемещение белков- транспортеров глюкозы в плазматическую мембрану клеток жировой и мышечной ткани, что ускоряет трансмембранный перенос глюкозы в эти клетки. Снижение чувствительности клеток к инсулину опосредуется двумя механизмами: Комплекс рецептор-инсулин захватывается внутрь клетки эндоцитозом с последующим разрушением части рецепторов в лизосомах, а часть возвращается в плазматическую мембрану Фосфорилирование инсулинового рецептора по остаткам серина и треонина снижает его сродство к инсулину Роль инсулина в регуляции обмена веществ: индуцирует синтез ферментов гликолиза, пентозного цикла и гликогенсинтазу тормозит липолиз в адипоцитах, активируя фосфодиэстеразу и уменьшая внутриклеточную концентрацию цАМФ активирует ферменты синтеза жирных кислот и ТАГ, ацетил-КоА-карбоксилазу и глицеролфосфатацилтрансферазу Гормоны
|
