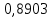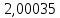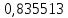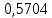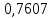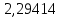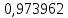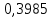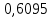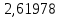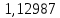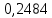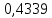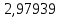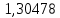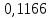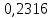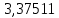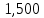РГР. Расчет ректификационной колонны по дисциплине Процессы и аппараты химической технологии
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
2.2 Построение х-у диаграммы, кривых изобар пара и жидкостиДля построения необходимо определить мольные доли НКК в жидкой фазе и равновесной паровой фазе. Для этого воспользуемся: - законом Дальтона, который гласит: парциальные давление компонента газовой смеси 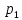 равно произведению давления в системе равно произведению давления в системе 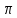 на мольную долю компонента на мольную долю компонента 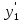 в газовой смеси, т.е. в газовой смеси, т.е. 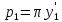 (4) (4)- законом Рауля, согласно которому парциальные давление 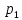 компонента идеального жидкого раствора равно произведению давления насыщенных парой компонента идеального жидкого раствора равно произведению давления насыщенных парой 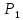 компонента при данной температура на мольную долю компонента компонента при данной температура на мольную долю компонента 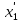 в жидкой фазе, т.е. в жидкой фазе, т.е.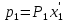 (5) (5)Совместным решением Дальтона и Рауля получим следующее уравнение равновесия: 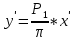 (6) (6)Согласно закону Рауля, парциальные давления компонентов определяются следующим образом: -для НКК: 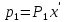 (7) (7)-для ВКК: 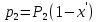 (8) (8)Давление насыщенных паров смеси этих компонентов 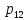 равно сумме парциальных давлений; так как в рассматриваемой системе жидкость находится в равновесии с соответствующим насыщенным паром, то равно сумме парциальных давлений; так как в рассматриваемой системе жидкость находится в равновесии с соответствующим насыщенным паром, то 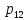 равно внешнему давлению равно внешнему давлению 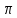 : :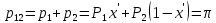 (9) (9)Из уравнения следует, что при известном внешнем давлении 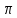 и температуре системы t можно однозначно определить состав жидкой фазы: и температуре системы t можно однозначно определить состав жидкой фазы: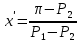 (10) (10)Используя формулы (6) и (10) определим мольные доли НКК в жидкой фазе и равновесной паровой фазе При температуре t1 = 93,862 °С: 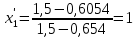 , ,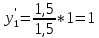 . .При температуре t2 = 99,1415 °С: 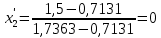 ,7691, ,7691,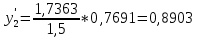 . .При температуре t3 = 104,421°С: 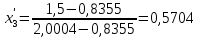 , ,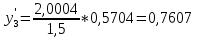 . .При температуре t4 = 109,7005 °С: 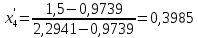 , ,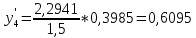 . .При температуре t5 = 114,98°С: 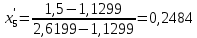 , ,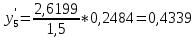 . .При температуре t6 = 120,2595 °С: 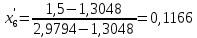 , ,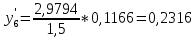 . .При температуре t7= 125,539 °С: 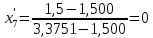 , ,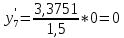 . .Полученные результаты приведены в таблице 4. Таблица 4 – Результаты расчета равновесных концентраций
По полученным данным строим 𝑥′−𝑦′ диаграмму и 𝑡−𝑥′,𝑦′ диаграмму. Рисунок 3 – 𝑡−𝑥′,𝑦′ диаграмма (изобара) |

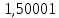
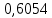
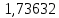
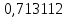
 ,7691
,7691