термодинамика. меньшикова софия хт-22-06 14 вариант дз2. Расчет состава идеальной газовой реакционной смеси
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
Факультет химической технологии и экологии Кафедра физической и коллоидной химии Оценка:______Рейтинг:_______ Преподаватель: (подпись) (фамилия, имя, отчество) ________ (дата) ДОМАШНЕЕ ЗАДАНИЕ №2 по дисциплине ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА на тему: Расчет состава идеальной газовой реакционной смеси Вариант № 14 ВЫПОЛНИЛА: (Фамилия, И.О.) ____________ (подпись) _________ (дата) М  осква, 2023 осква, 2023Таблица 1– Константы эмпирических зависимостей теплоёмкостей, теплоты образования, стандартные значения энтропии,вычисленные данные
Таблица 2 – Зависимость ∆rCp и ∆rHT от температуры
Рисунок 1 – Зависимость ∆rHT от температуры 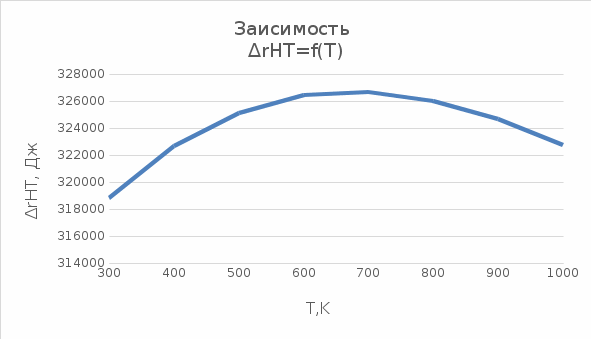 Рисунок 2 – Зависимость ∆rCp от температуры 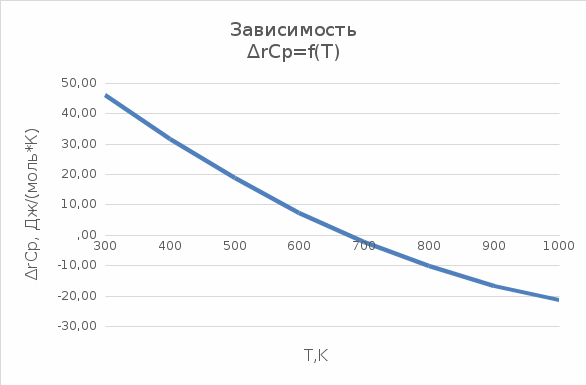 Таблица 3 – Изменение энергии Гиббса в интервале температур 300-1000 К для реакции, рассчитанное по уравнению Темкина-Шварцмана и метод Гиббса-Гельмгольца
Таблица 4– Термодинамические параметры участников реакции синтеза аммиака по литературным данным
Таблица 5 –Результаты расчета ∆rGT реакции методами Темкина-Шварцмана, Гиббса-Гельмгольца и по литературным данным
Рисунок 3 – Зависимости ∆rG=f(T), полученные методами Темкина-Шварцмана, Гиббса-Гельмгольца и по литературным данным о термодинамических свойствах участников реакции 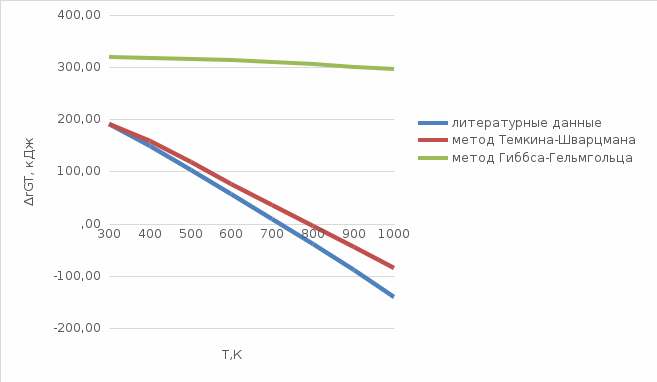 Рисунок 4 – Зависимость состава равновесной смеси для реакции синтеза аммиака при T= 800K от давления 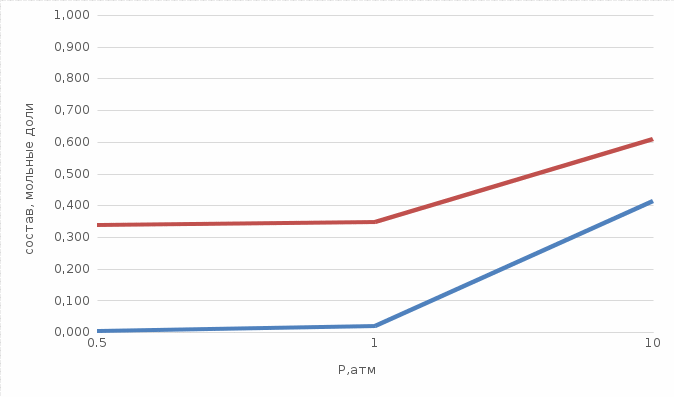    циклогесан водород(или этилен или дивинил оставшиеся продукты в равных долях     Список использованной литературы Д. Сталл, Э. Вестрам, Г. Зинке. Химическая термодинамика органических соединений. – М.: Мир, 1971. – 806 с. Краткий справочник физико-химических величин/Под ред. А.А. Равделя и А.М. Пономаревой. – СПб.: «Иван Федоров», 2002. – 240 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
