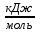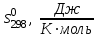ргр химия. Расчетнографическая работа Термодинамика химических процессов
 Скачать 76.34 Kb. Скачать 76.34 Kb.
|
|
Министерство образования и науки РФ Новосибирский государственный технический университет Кафедра химии и химической технологии Расчетно-графическая работа «Термодинамика химических процессов» Вариант № 10
Новосибирск, 2021 Задание. Дано уравнение реакции (2 NO(г) + Br2(г) = 2 NOBr(г)) 1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 0 f H298 и 0 298 S . 2. Вычислите изменение энтальпии реакции 0 rH298 и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции. 3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции 0 298 S r . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак 0 298 S r . 4. Вычислите энергию Гиббса прямой реакции в стандартных условиях 0 rG298 и установите возможность самопроизвольного протекания реакции. 5. Определите температуру, при которой реакция находится в равновесии (Тр). 6. Рассчитайте rG при Т1 = Тр–100, Т2 = Тр+100. 7. Постройте график зависимости rG от Т и обозначьте на графике область температур самопроизвольного протекания реакции. 8. Вычислите значения константы равновесия Kc при температурах Тр, Т1 и Т2. Cделайте вывод о влиянии температуры на величину Kc и на смещение химического равновесия. Расчеты и пояснения: 1.
2. Согласно следствию второго закона Гесса: 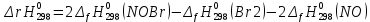 dH(реакции)= 2*79,5-30,92-2*90,25=-52,42 (кдж/моль) Термохимическое уравнение реакции будет иметь вид: 2 NO(г) + Br2(г) = 2 NOBr(г) Так как 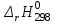 =-52,42, то реакция является экзотермической =-52,42, то реакция является экзотермической3. Энтропия изолированной системы возрастает: - если происходят фазовые превращения: Твердое вещество - жидкое -газообразное. В данной реакции таких превращений нет. - если в результате процесса увеличивается количество молей газообразных продуктов. В данной реакции этого не происходит, так как количество молей исходных веществ равно количеству молей получающихся в результате реакции веществ.(Второй закон термодинамики) dS=S2-S1 dS=2*273,55-245,35-2*210,62=547,1-666,59=-119,49(ДЖ/МОЛЬ*К) 4. G(NO(г))= 86,58 кдж/моль G(Br2(г))= 3,14 кдж/моль G(NOBr(г))=79,74 кдж/моль 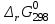 = G(NOBr(г))- G(Br2(г))- G(NO(г))=2*79,74 -86,58*2-3,14=159,48-173,16-3,14=-16,82 кдж/моль = G(NOBr(г))- G(Br2(г))- G(NO(г))=2*79,74 -86,58*2-3,14=159,48-173,16-3,14=-16,82 кдж/мольТ.к энергия Гиббса убывает, то процесс самопроизвольно протекает в прямом направлении. 5. Реакция будет находиться в равновесии при 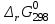 = 0, тогда = 0, тогда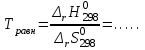 438,7 К 438,7 К6. 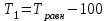 = 438,7-100=338,7 К = 438,7-100=338,7 К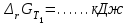 =-52,42-338,7*(-0,11949)=-11,95 кдж/моль =-52,42-338,7*(-0,11949)=-11,95 кдж/моль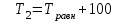 = 438,7+100=538,7 К = 438,7+100=538,7 К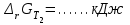 =-52,42-538,7*(-0,11949)=11,95 кдж/моль =-52,42-538,7*(-0,11949)=11,95 кдж/моль
   538.7 11.95       338.7       T,K T,K       -16.82 Самопроизвольное протекание идет при G<0 8. 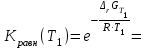 1,00425 1,00425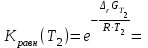 0,997334 0,997334K(T)= 1,0042 Вывод: При повышении температуры константа равновесия экзотермической реакции принимает значения меньше единицы, следовательно, самопроизвольному процессу протекания реакции в прямом направлении будет способствовать уменьшению температуры.  |

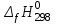 ,
,