11.3 B Элементы 14 (IV)-группы
|
Школа:
|
Дата:01.02
|
ФИО учителя: Рахметова Д
|
Класс: 11Б
|
Количество присутствующих:
|
отсутствующих:
|
Тема урока
|
Распространение и применение элементов 14 (IV) группы и их соединений
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу)
|
11.2.1.1 объяснять закономерности изменения физических и химических свойств элементов 14 (IV) группы
|
Цели урока
|
Учащиеся могут:
объяснять химическое свойства14 группы;
объяснять значение физко-химическое свойства 14 группы
|
Языковые цели
|
Учащиеся могут:
Устно объяснять химический круговорот веществ в природе, используя ключевые фразы и термины.
Лексика и терминология, специфичная для предмета:
Круговороты воды, азота, фосфора, кислорода, углерода.
Полезные выражения для диалогов и письма:
Круговорот воды - это …
В результате круговорота воды/углерода …
Важность круговорота воды для природы заключается в том, что …
По моему мнению, круговорот веществ очень важен для природы, потому что …
|
Ход урока
|
Запланированные этапы урока
|
Запланированная деятельность на уроке
|
Ресурсы
|
Начало урока
0-5
5-8
|
Проверяем знания учеников простыми ответами «да» или «нет»
1. 1s22s22p3 - электронная формула азота. да
2. N, P - элементы главной подгруппы VI группы. нет
3. На последнем энергетическом уровне атома азота находится пять электронов. да
4. Для элементов подгруппы азота характерны высшая степень окисления «+3» и низшая степень «-5». нет
5. Фосфор реагирует в обычных условиях с водородом. нет
6. Соли азотной кислоты называются нитратами. да
7. Азотная кислота реагирует с кислотными оксидами. нет
8. Оксид фосфора (V) - P2O3. нет
9. Водородное соединение с резким специфическим запахом NH3 да
10. Азотистая кислота - слабая одноосновная кислота Да
|
|
Середина урока
8-10
10-13
13-30
|
4. Пояснение учителя
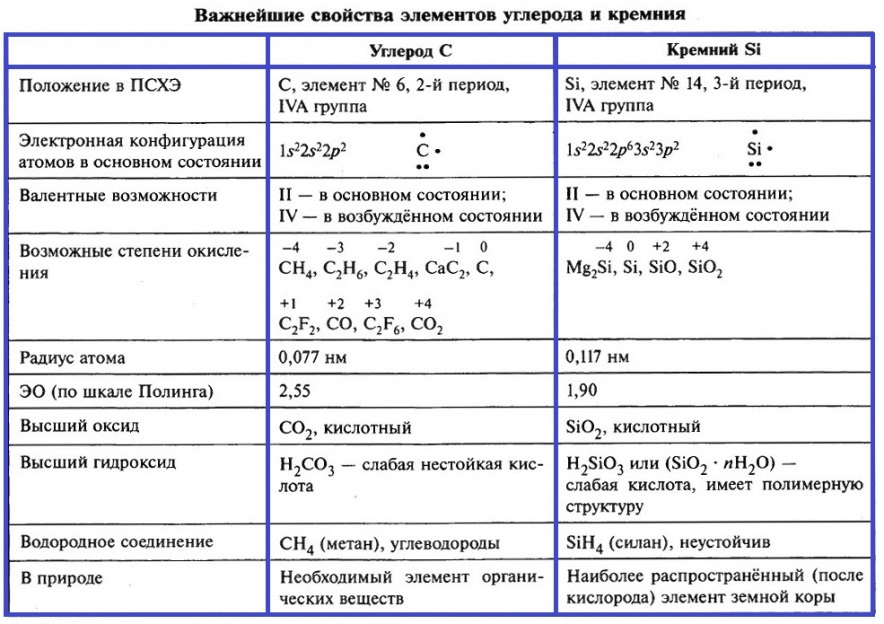
Элементы IV группы – это углерод, кремний, германий, олово и свинец. Более подробно рассмотрим свойства углерода и кремния. В таблице приведены важнейшие характеристики этих элементов.
5. Химические свойства
1. Взаимодействие с кислородом:
С + О2 изб →СO2 . С + О2 недост →СO
Si + О2изб = SiO2, 2Si + O2недост = 2SiO,
2 Взаимодействие с водородом и с серой при нагревании
С + 2Н2 = СН4 (метан). С + 2S = СS2 (cероуглерод).
4Si + S8 = 4SiS2
3) Восстановление металлов из их оксидов:
С + 2СuO = 2Cu + CO2.
При нагревании же с оксидами активных металлов углерод и кремний образуют карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
или силициды
2МgО + 3Si= Мg2Si + 2SiO.
4) Взаимодействие с металлами:
3С + 4 Al = Al4C3 (карбид алюминия).
5) Оксид углерода (II) горит в кислороде и на воздухе с выделением большого числа теплоты.
2СО + О2 →2СO2
6) Оксид углерода (IV) растворяется в воде
СО2 + Н2О →Н2СO3
6) Диоксид углерода – кислотный оксид, поэтому для него характерны реакции с основными оксидами и основаниями
СО2 + BaО →BaСO3 СО2 + 2KOH →K2СO3 + Н2О
СО2 + KOH →KHСO3
7) Взаимодействие с концентрированными кислотами:
С + 2H2SO4 = 2SO2 ↑ + CO2 ↑ + 2H2O.
8) Получение диокисида углерода в промышленности
Са СО3 = СаО+ CO2
9) Получение диоксида углерода в лаборатории
Na2CO3 + H2SO4→Na2 SO4 + СО2 + Н2О
10) Угольная кислота проявляет свойства кислот
Н2СO3+ 2NaOH→ Na2СO3 + 2Н2О
Н2СO3+ BaCI2→ Ba2СO3 + 2НCI
7. Закрепление.
2 вариант
4NH3 + 3O2
|
HNO3 + HNO2
|
2AgNO3
|
2P2O5
|
P2O5 +3 H2O
|
2N2 + 6 H2O
|
Ca3(PO4)2 + 3H2SO4
|
Mg3P2
|
2NO2 + H2O
|
Cu(NO3)2 + H2O
|
3Mg + 2P
|
2Ag + 2NO2 + O2
|
CuO + 2HNO3
|
H3PO4
|
4P+ 5O2
|
3CaSO4 + 2H3PO4
|
|
|
Конец урока
|
8. Рефлексия
Учитель возвращается к целям урока, обсуждая уровень их достижения.
|
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися?
|
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися?
|
Здоровье и соблюдение техники безопасности
|
|
|
| |
 Скачать 214.34 Kb.
Скачать 214.34 Kb.