301_Калашникова. Реферат химические источники тока содержание
 Скачать 107.59 Kb. Скачать 107.59 Kb.
|
|
РЕФЕРАТ Химические источники тока СОДЕРЖАНИЕ
ВВЕДЕНИЕ Химические источники тока – это устройство, в котором химическая энергия активных веществ при протекании окислительно-восстановительных процессов превращается непосредственно в электрическую энергию. Химические источники тока подразделяются на первичные источники, или элементы, и вторичные, или электрические аккумуляторы. Элементы могут использоваться до тех пор, пока в них есть запас активных веществ, обеспечивающих образование электрической энергии. При полном израсходовании этих веществ элементы становятся непригодными для дальнейшего использования. Аккумуляторы могут служить долгое время при использовании активных веществ при разряде. Эти вещества могут вновь образовываться при пропускании через аккумулятор в обратном направлении постоянного электрического тока от другого источника. Такой процесс регенерации израсходованных активных веществ называется процессом заряда аккумулятора. Области применения аккумуляторов постоянно расширяются вместе с развитием новой техники и новых технологий. Они применяются в различных областях народного хозяйства, военной промышленности, авиации, железнодорожном и автомобильном транспорте, многочисленных электронный устройств, в ракетной технике и быту[6]. ГЛАВА 1.ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА И ИХ КЛАССИФИКАЦИЯ 1.1 История создания химических источников тока Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля». В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах. В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств. В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia». Самый долгоживущий гальванический элемент - серно-цинковая батарея, изготовленная в Лондоне в 1840 г. Подключенный к ней звонок работает и по сей день. 1.2 Принцип действия Основу химических источников тока составляют два электрода (анод, содержащий окислитель, и катод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя. В современных химических источниках тока используются: в качестве восстановителя (на катоде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы; в качестве окислителя (на аноде) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие; в качестве электролита — растворы щелочей, кислот или солей. 1.3 Классификация По возможности или невозможности повторного использования химические источники тока делятся на: гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить; электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить; топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно. Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка. По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор). 1.4 Гальванические элементы Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. Таблица 1. Характеристика гальванических элементов
Другие типы: Свинцово-плавиковый элемент Медно-окисный гальванический элемент Висмутисто-магниевый элемент Ртутно-висмутисто-индиевый элемент Литий-хромсеребряный элемент Литий-висмутатный элемент Литий-окисномедный элемент Литий-йодсвинцовый элемент Литий-йодный элемент Литий-тионилхлоридный элемент Литий-оксидванадиевый элемент Литий-фторомедный элемент Литий-двуокисносерный элемент Диоксисульфатно-ртутный элемент Серно-магниевый элемент Хлористосвинцово-магниевый элемент Хлорсеребряно-магниевый элемент Хлористомедно-магниевый элемент Йодатно-цинковый элемент Магний-перхлоратный элемент Магний-м-ДНБ элемент Цинк-хлоросеребряный элемент Хлор-серебряный элемент Бром-серебряный элемент Йод-серебряный элемент Магний-ванадиевый элемент Кальций-хроматный элемент 1.5 Электрические аккумуляторы Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств. Типы электрических аккумуляторов: Железо-воздушный аккумулятор Железо-никелевый аккумулятор Лантан-фторидный аккумулятор Литий-железо-сульфидный аккумулятор Литий-ионный аккумулятор Литий-полимерный аккумулятор Литий-фторный аккумулятор Литий-хлорный аккумулятор Литий-серный аккумулятор Марганцево-оловянный элемент Натрий-никель-хлоридный аккумулятор Натрий-серный аккумулятор Никель-кадмиевый аккумулятор Никель-металл-гидридный аккумулятор Никель-цинковый аккумулятор Свинцово-водородный аккумулятор Свинцово-кислотный аккумулятор Свинцово-оловянный аккумулятор Серебряно-кадмиевый аккумулятор Серебряно-цинковый аккумулятор Цинк-бромный аккумулятор Цинк-воздушный аккумулятор Цинк-хлорный аккумулятор 1.6 Топливные элементы Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе. Прямой метанольный топливный элемент Твердооксидный топливный элемент Щелочной топливный элемент ГЛАВА 2. СВИНЦОВО – КИСЛОТНЫЙ АККУМУЛЯТОР, ЕГО УСТРОЙСТВО, ПРИНЦИП РАБОТЫ И ПРИМЕНЕНИЕ. 2.1 Общая характеристика кислотных аккумуляторов Кислотные аккумуляторы представляют собой сосуд, заполненный электролитом соответствующей плотности, т. е. раствором серной кислоты H2SO4 в дистиллированной воде, в который погружен блок пластин из чистого свинца Рb и блок пластин из перекиси свинца РbО2. Вследствие постоянно происходящей диссоциации молекул кислоты в электролите заряженного аккумулятора имеются ионы водорода Н2 (катионы) и ионы кислотного остатка SO4 (анионы). Если пластины аккумулятора замкнуть на некоторое сопротивление, то через него потечет ток. Отрицательно заряженные ионы SO4 будут стремиться к пластинам из чистого свинца, заряженным положительно. Ионы водорода, имеющие положительный заряд, будут стремиться к отрицательным пластинам, содержащим двуокись свинца. Пластины из свинца принято называть отрицательными, а из двуокиси свинца положительными. При разрядке кислотного аккумулятора происходят следующие химические реакции: у отрицательной пластины Pb + SO4 = PbSO4; у положительной пластины РbО2 + H2+H2SO4=PbSO4+2H2O. Из рассмотренных химических реакций видно, что при разрядке кислотных аккумуляторов на всех пластинах выделяется сернокислый свинец PbSO4 и уменьшается концентрация электролита (вследствие диссоциации кислоты и выделения воды). Сернокислый свинец обладает двумя недостатками. Во-первых, при интенсивном образовании сернокислого свинца возможно коробление или выпучивание пластин, а также "высыпание" из пластин активной массы, так как объем сернокислого свинца больше объема исходных продуктов, из которых он образуется. Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора. Зарядка аккумуляторов производится от внешнего источника электроэнергии, генератора постоянного тока или выпрямителя. При зарядке к отрицательным пластинам направляются ионы водорода, а к положительным – ионы кислотного остатка. В результате возникают следующие химические реакции: у отрицательной пластины PbSO4 + H2 = Pb + H2SO4; у положительной пластины PbSО4+2Н2О + SO4 = РbO2 + 2Н2 + 2H2SO4. Следовательно, при зарядке аккумуляторов происходит разложение сернокислого свинца на исходные продукты, а также восстановление концентрации электролита. Очевидно, что окончанием зарядки аккумуляторов можно считать такой момент, когда весь сернокислый свинец разложился и концентрация электролита восстановилась до нормальной. При дальнейшей зарядке потребляемая аккумулятором электрическая энергия будет расходоваться на разложение воды, имеющейся в электролите. Вода разлагается на водород и кислород. Кислород, как наиболее активный газ, производит окисление металлов, имеющихся в аккумуляторе. Водород выделяется в атмосферу. Поэтому на поверхности электролита появляются пузырьки, создающие впечатление "кипения" электролита. В смеси с воздухом водород образует взрывчатый гремучий газ, который должен быть немедленно удален из аккумуляторного помещения. ЭДС не включенного на разрядку кислотного аккумулятора, принимается в среднем равной 2,1 В независимо от размеров аккумулятора. Напряжение, создаваемое аккумулятором на зажимах, определяется уравнениями: при разрядке U = E-IPr; при зарядке U=E+Iзар r, где Е – ЭДС аккумулятора; Ip, Iзар – соответственно ток разрядки и зарядки аккумулятора; r – внутреннее сопротивление аккумулятора. Кислотные аккумуляторы имеют небольшое внутреннее сопротивление, поэтому напряжение на зажимах аккумулятора незначительно снижается даже при больших токах нагрузки. В среднем сопротивление кислотного аккумулятора составляет 0,005 Ом и является величиной, зависящей от плотности электролита, а также от габаритов аккумуляторов (чем больше габариты, тем меньше сопротивление). С уменьшением плотности электролита, т. е. с увеличением степени разряда, ЭДС кислотных аккумуляторов уменьшается, а внутреннее сопротивление увеличивается. Вследствие этого напряжение аккумулятора в начале разрядки понижается незначительно, а к концу падает быстро. 2.2 Конструкция аккумуляторной батареи Основы традиционного исполнения батарей сформировались уже в начале 20-го века и постепенно трансформировались до современного состояния по мере появления новых конструкционных материалов, но их эксплуатационные недостатки при этом сохранились. В России батареи традиционного исполнения выпускают как в моноблоках с отдельными крышками, герметизируемыми битумной смазкой, так и в моноблоках с общей крышкой, герметизируемой контактно-тепловой сваркой. Аккумуляторные батареи с отдельными крышками (рис.1) собирают в одном многоячеечном корпусе – моноблоке, выполненном из эбонита или другой кислотостойкой пластмассы, разделенном перегородками на отдельные камеры-ячейки (банки), по числу аккумуляторов в батарее. В каждую из ячеек помещен блок, состоящий из чередующихся положительных и отрицательных электродов, разделенных сепараторами. Он представляет собой отдельный аккумулятор напряжением 2 В. Пространство между дном моноблока и верхними кромками фиксирующих электроды опорных призм служит для накаливания шлама – осадка, образующегося в процессе эксплуатации вследствие оплывания частиц активной массы положительных электродов. Когда объем шламового пространства заполняется, происходит замыкание нижних кромок разноименных электродов и аккумулятор теряет работоспособность. 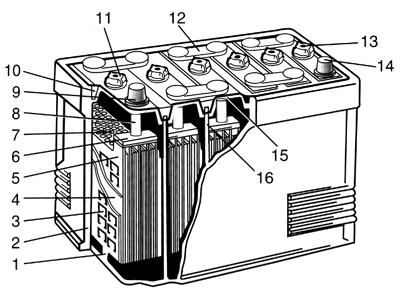 Рисунок 1 – Аккумуляторная батарея с отдельными крышками: 1- опорные призмы; 2- моноблок; 3- отрицательный электрод; 4- сепаратор; 5- положительный электрод; 6- межэлементные соединения; 7- щиток; 8- борн; 9- положительный вывод; 11- пробка; 13- вентиляционное отверстие; 14- отрицательный вывод; 15- крышка; 16- перегородки Электроды состоят из активной массы, нанесенной на токоотвод решетчатой конструкции – решетку. Сепараторы разделяют участвующие в электрохимических превращениях реагенты, а также обеспечивают возможность диффузии электролита от одного электрода к другому. Сторона сепаратора, обращенная к положительному электроду для облегчения доступа электролита к поверхности активной массы, выполнена ребристой. Борн, который служит наружным токоотводом аккумулятора, последовательно соединяет соседние аккумуляторы между собой в батарею. К выводным борнам крайних аккумуляторов батареи привариваются полюсные выводы и, служащие для соединения батареи с внешней электрической цепью. Положительный и отрицательный выводы имеют разный диаметр, что позволяет исключить возможность переполюсовки при подключении АКБ к бортовой цепи автомобиля. В верхней части электродного блока устанавливают щиток, предохраняющий верхние кромки сепараторов от повреждения при замерах уровня и плотности электролита. Каждый аккумулятор после установки электродного блока в камеру-ячейку моноблока закрывают сверху отдельной пластмассовой или эбонитовой крышкой. В ней выполняют по два отверстия с втулками для выводных борнов электродного блока. Между ними расположено резьбовое отверстие для заливки электролита и периодического обслуживания аккумулятора в процессе эксплуатации. После заливки электролита резьбовое отверстие закрывают пробкой из полиэтилена, имеющей небольшое вентиляционное отверстие, предназначенное для выхода газов при эксплуатации. Для герметичной укупорки новых сухозаряженных батарей в верхней части пробки над вентиляционным отверстием выполнен глухой прилив. Для обеспечения нормальной эксплуатации этот прилив, после заливки электролита в батарею, необходимо срезать. Благодаря специфическим свойствам термопластичной пластмассы появились аккумуляторные батареи с общей крышкой в моноблоке из сополимера пропилена с этиленом, устройство которых показано на рис. 2 В моноблоке установлены электродные блоки, состоящие из разноименных электродов и, разделенных сепараторами. Эти блоки соединены между собой при помощи укороченных межэлементных соединений через отверстия в перегородках моноблока. Крышка сделана единой на все шесть аккумуляторов батареи. Свойства термопластичной пластмассы позволили применить для герметизации АКБ с общей крышкой метод контактно-тепловой сварки, обеспечивающий сохранение герметичности как по периметру, так и между отдельными аккумуляторами в широком диапазоне температур (от −50 до 70°C). 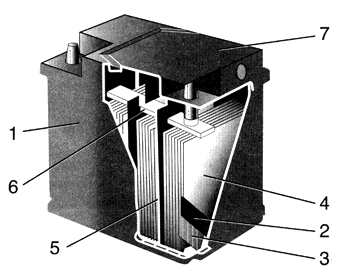 Рисунок 2- Аккумуляторная батарея с общей крышкой: 1-моноблок; 2-отрицательный электрод; 3-положительный электрод; 4- сепаратор; 5-перегородка; 6-межэлементные соединения; 7-крышка Недостатки традиционных свинцовых батарей обусловлены тем, что содержащаяся в сплаве положительных токоотводов сурьма постепенно, по мере их коррозии, через раствор переходит на поверхность отрицательного электрода. Осаждение большого количества сурьмы на поверхности отрицательной активной массы снижает напряжение на электродах батареи, при котором начинается разложение воды на водород и кислород. Поэтому, в конце зарядного процесса и при небольшом перезаряде, происходит бурное газовыделение, сопровождающееся "кипением" электролита вследствие электролитического разложения входящей в него воды. За последние 20-25 лет, по мере развития технологии и совершенствования оборудования, появилось несколько разновидностей батарей так называемого "необслуживаемого" исполнения. Их основная отличительная особенность – использование сплавов с пониженным содержанием сурьмы или вовсе без нее для производства токоотводов. Усовершенствование конструкции при создании необслуживаемых АКБ заключается еще и в том, что для увеличения запаса электролита без изменения высоты батареи, один из аккумуляторных электродов помещают в сепаратор-конверт, который изготовлен из микропористого полиэтиленового материала с низким электросопротивлением. В этом случае замыкание электродов различной полярности, при отсутствии сбоев в работе сборочного оборудования, практически исключено. Поэтому опорные призмы становятся ненужными, и блок электродов можно установить прямо на дно ячейки моноблока. В результате та часть электролита, которая раньше находилась в шламовом пространстве между призмами и не принимала участия в работе аккумулятора, теперь находится над электродами и пополняет его запас, расходуемый при эксплуатации батареи. Первоначально такие батареи начали выпускать в США на базе свинцово-кальциевого сплава (0,07-0,1% Ca; 0,1-0,12% Sn; остальное – Pb) для токоотводов, положительного и отрицательного электродов. Это снизило газовыделение, что обеспечило эксплуатацию АКБ без доливки воды в течение как минимум двух лет. Расход воды у этих батарей так мал, что конструкторы убрали из крышек отверстия для доливки воды и сделали батареи полностью необслуживаемыми. При этом самозаряд батарей замедлился более чем в 6 раз. Однако, при нескольких глубоких разрядах такие АКБ быстро теряют емкость и их стартерные характеристики резко снижаются, из-за чего они не нашли широкого распространения в Европе и России. В это же время в США появились батареи системы "кальций плюс" (гибридные) с содержанием до 1,5-1,8% сурьмы и 1,4-1,6% кадмия в положительном токоотводе и свинцово-кальциевым отрицательным токоотводом. Характеристики этих батарей по расходу воды и саморазряду вдвое лучше, чем у малосурьмяных, но все еще не такие хорошие, как у свинцово-кальциевых. К началу 80-х годов производство необслуживаемых батарей стало быстро развиваться в странах Европы. Но там пошли по пути применения сплавов с пониженным до 2,5-3,0% содержанием сурьмы. Однако, у таких АКБ расход воды и саморазряд в 2-3 раза выше, чем у батарей с кальциевыми токоотводами. Позже и в Европе появились так называемые гибридные батареи. Наконец, в конце 90-х годов и в США, и в Западной Европе началось производство батарей с токоотводами из свинцово-кальциевого сплава с добавкой новых легирующих компонентов, в том числе серебра, которые не боятся глубоких разрядов. В России выпускаются необслуживаемые батареи емкостью от 44 до 90 А·ч с токоотводами из малосурьмяного сплава с содержанием сурьмы 1,7-3,0%. Следует отметить, что эксплуатация батарей без отверстий для доливки воды требует более точной работы системы энергосбережения автомобиля, а также более внимательного отношения автовладельцев к состоянию и исправной работе электрооборудования. В первую очередь это касается натяжения ремня привода генератора и исправности самого генератора, а также регулятора напряжения. Отрицательно сказывается на состоянии батарей последнего поколения и наличие утечек тока в системе электрооборудования или сигнализацию. Подавляющее большинство АКБ, поступающих в Россию из стран Европы, выпускают, как правило, в гибридном исполнении, либо с токоотводами обеих полярностей из свинцово-кальциевых сплавов. При изготовлении сухозаряженных батарей многие производители применяют для электродов обеих полярностей малосурьмяные сплавы с содержание сурьмы 1,6-1,8% [4]. 2.3 Свинцово-кислотные аккумуляторы (SLA). Для обозначения таких аккумуляторов применяется аббревиатура SLA (Sealed Lead Acid – герметизированные свинцово-кислотные). Это старейшие перезаряжаемые аккумуляторы, предназначенные для коммерческого использования, причем они до сих пор остаются наиболее дешевыми автономными источниками энергии. Видимо, самым существенным недостатком, присущим свинцово-кислотным элементам, является выделение газов – кислорода и водорода. Предотвратить его можно только путем уменьшения напряжения при зарядке, однако при подзарядке это приводит к тому, что аккумулятор не заряжается полностью до номинального напряжения. Так что проблема до сих пор не решена. Вместе с тем способность удерживать номинальную силу тока при низком напряжении, небольшая цена по сравнению с затратами на обслуживание батарей этого типа и отсутствие сбоев питания при их использовании вполне оправдывают установку свинцово-кислотных аккумуляторов большой емкости. Сегодня SLA-аккумуляторы применяются в основном там, где требуется большая мощность при низкой стоимости устройств, а их вес и габаритные характеристики несущественны (например, в блоках бесперебойного питания, охранных системах, системах резервного освещения). В портативных приборах используются герметичные (необслуживаемые) аккумуляторы или аккумуляторы с регулирующим клапаном давления. Подобными SLA-устройствами иногда комплектуются переносные сотовые телефоны большой мощности и некоторые видеокамеры, но в целом их применение для портативных систем нехарактерно. Появились необслуживаемые и малообслуживаемые аккумуляторы, основанные на внутренней рекомбинации газа, а также различные герметизированные аккумуляторы (правильно говорить "герметизированные", а не "герметичные"). Из особенностей современных свинцово-кислотных аккумуляторов следует отметить: • зарядка от простейших зарядных устройств; • улучшение работы в буферном режиме, то есть в режиме постоянного подзаряда – срок службы доведен уже до 25 лет; • значительное увеличение ресурса – количество циклов зарядки-разрядки составляет уже 600-800, а не 200-300, как раньше; • сведение к минимуму величины саморазряда – 0,1% в день; • появление множества типоразмеров и введение их единой стандартизации. В отличие от обычных свинцово-кислотных аккумуляторов, в частности автомобильных, SLA-аккумуляторы для электроники разрабатываются с низким потенциалом перезарядки с целью предотвращения выделения газа. Поэтому SLA-аккумулятор имеет длительный срок хранения, но никогда не заряжается до своей полной емкости, а следовательно, по сравнению с другими типами заряжаемых батарей имеет самую низкую плотность энергии (удельную энергоемкость), которая выражается в количестве запасенной энергии к единице веса или объема. Вследствие низкого саморазряда, отсутствия эффекта памяти и минимальных требований по обслуживанию такие батареи в некоторых областях до сих пор остаются весьма выгодным решением. Так, если NiCd-аккумуляторы за три месяца саморазряжаются на 40%, то SLA-аккумуляторам для подобной саморазрядки понадобится не менее года. Разновидностью SLA-устройств являются так называемые гелевые аккумуляторы (некоторые из них продаются под торговой маркой gelcell), основанные на технологии Gelled Electrolite (GEL), которая была разработана в конце 50-х годов и предусматривает добавление в электролит двуокиси кремния (SiO2), в результате чего через несколько часов после заполнения электролит приобретает консистенцию желе. В толще желеобразного электролита образуются поры и раковины, имеющие значительные объем и площадь поверхности, где происходит рекомбинация молекул кислорода и водорода с выделением воды. В результате количество электролита остается неизменным, и в течение всего срока службы аккумулятора долив воды не требуется. Кроме GEL-технологии, применяется технология Absorptive Glass Mat (AGM), разработанная в конце 70-х годов и предполагающая использование пористого заполнителя из стекловолокна, пропитанного жидким электролитом. Микропоры этого материала заполнены электролитом не полностью, и в этом свободном пространстве происходит рекомбинация газов, что позволяет производить необслуживаемые батареи, как и по GEL-технологии. У свинцово-кислотных аккумуляторов, естественно, имеются и недостатки. Например, они не могут быстро заряжаться (зарядный ток, в зависимости от конструкции, не должен превышать 0,1-0,3 Сн, а типовое время зарядки – не менее 8-16 ч) и не переносят глубокого разряда. К тому же хранение SLA-аккумулятора в разряженном состоянии вызывает сульфатацию, которая делает последующую зарядку трудной или вообще невозможной, вследствие чего стандартные свинцово-кислотные аккумуляторы выдерживают относительно небольшое число циклов зарядки-разрядки. Так, в зависимости от глубины разрядки и температуры эксплуатации, типичный SLA-аккумулятор выдерживает лишь 300-500 циклов зарядки-разрядки. фактически каждый такой цикл отнимает у аккумулятора некоторую часть емкости. Конечно, это верно и для аккумуляторов других электрохимических систем, но в меньшей степени. Впрочем, у некоторых современных SLA-аккумуляторов, как уже отмечалось, количество циклов зарядки-разрядки доведено до 600-800, что сравнимо с NiMH-технологией. К тому же при низких температурах у SLA-аккумуляторов значительно уменьшается способность отдавать большой ток в нагрузку. Зависимость нелинейная, но для каждого элемента наблюдается падение напряжения на 2-5 мВ на один градус. Что касается утилизации вышедших из строя батарей, то из-за высокого содержания свинца SLA-аккумуляторы по нанесению экологического вреда уступают только NiCd-аккумуляторам. ЗАКЛЮЧЕНИЕ В работе были рассмотрены принципы работы, классификация и значение химических источников тока. Химические источники тока имеют огромное значение для развития науки, для освоения космоса, и развития общества. Значение химических источников тока очевидно, потому как мы используем их в повседневной жизни, трудно представить себе фотоаппараты, мобильные телефоны, карманные персональные компьютеры и т.п. подключенные к электросети, ограничивающие свободу человека. Современная наука стремится к созданию компактных и надежных приборов, сопровождающих человека в его жизни, химические источники тока играют в это немаловажную роль. ИСТОЧНИКИ И ЛИТЕРАТУРА 1. http://ru.wikipedia.org/wiki/Химический_источник_тока История создания. 2. http://www.aktex.ru/qa/36.html История изобретения и усовершенствования аккумулятора. 3. http://leg.co.ua/knigi/oborudovanie/akkumulyatornye-batarei-3.html 1.4 Принцип действия аккумулятора 4. http://akbplus.ru/AKB-Spravka/ustroistvo-avto-akkumulatora.html Назначение и устройство автомобильных аккумуляторов и аккумуляторных батарей 5. http://compress.ru/article.aspx?id=16846 Современные аккумуляторы 6. Шеханов Р.Ф., Ершова Т.В. Химические источники тока: лабораторный практикум/ Иван. гос. хим.-технол. ун-т. Иваново, 2008 |
