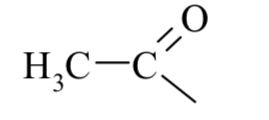
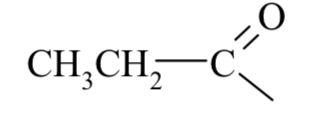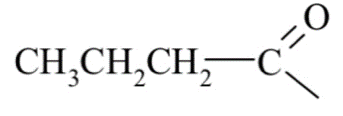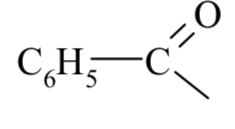Курсовая работа. Реферат, Болховитина. Реферат на тему Агенты ацилирования и алкилирования. Ацилирование и алкилирование гетероциклических соединений. Примеры синтезов, методики, условия и применение синтезируемых веществ
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
Основы синтеза органических соединений в химической технологии Реферат на тему «Агенты ацилирования и алкилирования. Ацилирование и алкилирование гетероциклических соединений. Примеры синтезов, методики, условия и применение синтезируемых веществ» Выполнила студентка 3 курса 180301 ФБО Болховитина Александра Владимировна Воронеж 2021 ВВЕДЕНИЕ При алкилировании и ацилировании ароматических углеводородов получают соответственно их алкильные и ацильные производные: 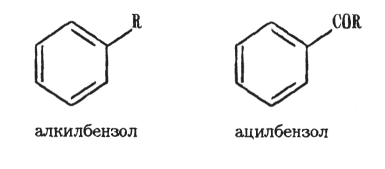 Реакции алкилирования и ацилирования относятся к реакциям электрофильного замещения и называются реакциями Фриделя—Крафтса. Алкилирование — введение алкильной группы в молекулу органического соединения (например, в бензольное кольцо). Реакцию алкилирования проводят при действии на вещество галогеналкилов в присутствии катализатора — безводного AICI3. Ацилирование – это введение в молекулу ацильной группы (остатка карбоновой кислоты) Ацилирование органических соединений применяется для двух целей. В одних случаях ацилпроизводное является целевым веществом. В других случаях ацилирование служит для временного введения ацила в амино- или гидроксильную группы, чтобы сделать возможным такие превращения ацилированного продукта, которые при наличии свободных этих групп недостижимы или идут с трудом. Затем путем гидролиза вновь освобождают функциональную группу от ацила. Реакции ацилирования используют и в аналитических целях, например, для установления количества гидроксильных групп в многоатомных спиртах, углеводах и др. АГЕНТЫ АЦИЛИРОВАНИЯ И АЛКИЛИРОВАНИЯ Наиболее распространенными алкилирующими агентами являются галоидные алкилы, алкены, спирты и диалкилсульфаты. Способность атома галогена в молекулах галоидных алкилов к реакциям нуклеофильного замещения делает эти соединения незаменимыми алкилирующими агентами. Легче всего подвергается обмену (более подвижен) атом йода, что связано с его большей поляризуемостью. Хлориды и бромиды сравнительно мало отличаются по реакционной способности, алкилфториды для целей алкилирования непригодны, так как атом фтора вследствие малой поляризуемости слишком инертен. Скорость реакции алкилирования при применении третичных галоидных алкилов выше, чем вторичных и первичных. Это различие обусловлено тем, что механизм реакций с участием третичных, вторичных и первичных галоидных алкилов различен. В случае применения третичного галогенпроизводного скорость реакции определяется скоростью его электролитической диссоциации. Например: 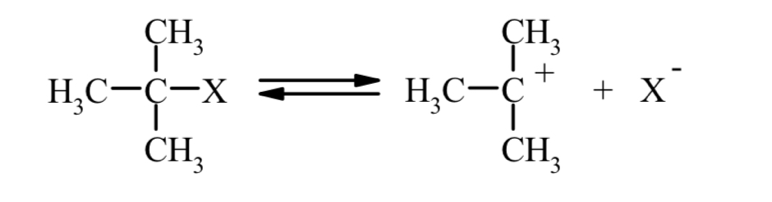 Образовавшийся карбкатион (карбониевый катион) быстро реагирует с анионом второго реагента (мономолекулярное нуклеофильное замещение, SN1): 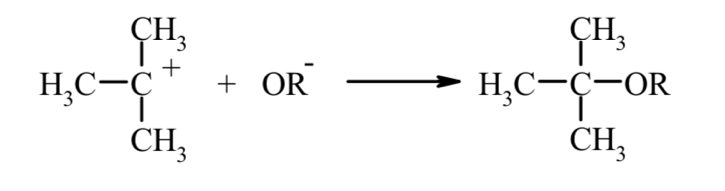 Первичные и вторичные галоидные алкилы реагируют через переходное состояние (бимолекулярное нуклеофильное замещение, SN2). Процесс можно представить следующим образом: 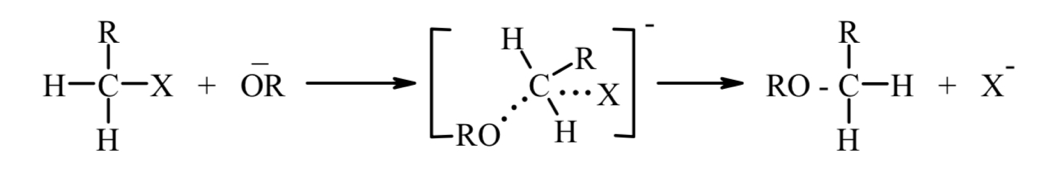 В переходном состоянии анион атакует атом углерода галоидного алкила со стороны, противоположной той, где расположен атом галогена. Для образования переходного состояния требуется определенная энергия активации, при этом скорость реакции зависит от концентрации каждого реагента. Алкены также могут быть использованы для алкилирования различных органических соединений. Алкилирующая способность олефинов обусловлена ненасыщенностью их молекул, склонностью вступать в реакции присоединения (чаще всего по электрофильному или гомолитическому механизмам). Применение алканолов в качестве алкилирующих средств возможно в случае разрыва в их молекулах связи углерод-кислород. Обычно для этого требуется присутствие сильных кислот. Специфическим алкилирующим действием обладают диалкилсулфаты. При их применении используется только одна алкильная группа. В качестве ацилирующих агентов используются: карбоновые кислоты, их ангидриды, галогенангидриды и сложные эфиры, кетены. В молекулы органических соединений вводят разнообразные ацильные группы. В нижеприведенной таблице 1 в качестве примера представлены некоторые из них. Таблица 1 Ацильные группы
По ацилирующей способности кислоты и их функциональные производные можно расположить в следующий ряд: сложные эфиры <карбоновые кислоты <ангидриды<галогенангидрид 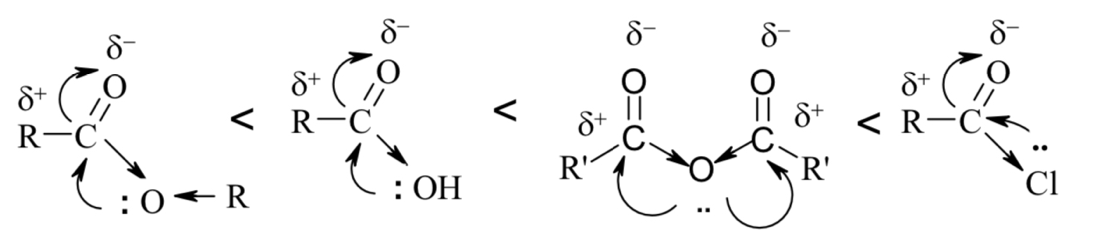 Активность ацилирующего агента определяется электрофильностью атома углерода карбонильной группы. В кислотах карбонильная группа, будучи связана с гидроксилом, стабилизируется, становится менее реакционноспособной по сравнению с той же группой в альдегидах и кетонах. Это обусловлено уменьшением положительного заряда карбонильного углерода вследствие положительного мезомерного эффекта кислорода гидроксильной группы. В сложных эфирах предельных спиртов положительный индуктивный эффект алкильных групп оказывает еще более сильное влияние на снижение ацилирующей активности. Усиление электрофильности карбонильной группы в галогенангидридах кислот обусловлено отрицательным индуктивным эффектом атома галогена, доминирующим над положительным мезомерным эффектом. Ангидриды карбоновых кислот содержат два ацильных фрагмента, из которых в реакцию ацилирования вступает только один. Его более высокая реакционная способность по сравнению с кислотами и сложными эфирами объясняется электроноакцепторным влиянием второго остатка. Выбор ацилирующего агента зависит от относительной реакционной способности ацилируемого соединения. АЦИЛИРОВАНИЕ И АЛКИЛИРОВАНИЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ Уксусным ангидридом ацилируют ацидофобные пятичленных гетероциклыс одним гетероатомом, которые под действием сильных минеральных кислот разрушаются. Катализаторами служат протонные кислоты (например, фосфорная) и кислоты Льюиса (хлорид олова IV): 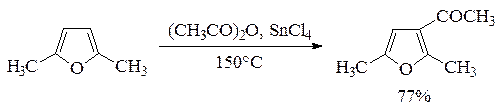 Реакция Вильсмайера – синтез ароматических альдегидов. В качестве ацилирующих агентов чаще всего используют диметилформамид. Катализатором является хлорокись фосфора: 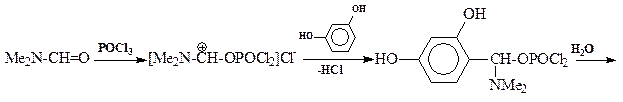 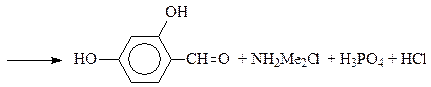 Субстратами являются ароматические и гетероароматические соединения (в том числе 5-членные ацидофобные гетероциклы): 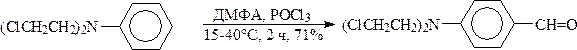 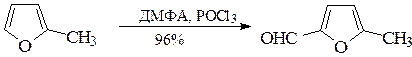 Реакция Раймера-Тимана – синтез ароматическихо-гидроксиальдегидовиз фенолов и хлороформа в щелочном растворе (формилирование через алкилирование). Электрофилом является дихлоркарбен, который образуется при взаимодействии хлороформа со щелочью. 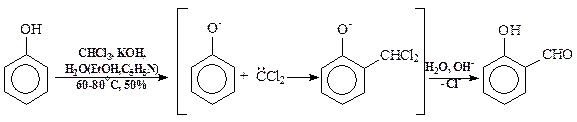 Субстратом могут быть замещенные фенолы с заместителями первого рода, нафтолы и замещенные нафтолы, гидрокси производные хинолина, тиазола ит.п., а также пиррол, индол и подобные гетероциклы: 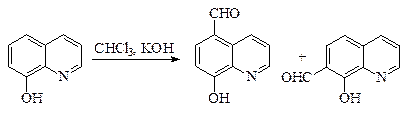 В результате присоединения алкильных и арильных реактивов Гриньяра и алкил- и ариллитиевых соединений к хинолинам и изохинолинам образуются соответствующие дигидропроизводные, которые можно выделить и охарактеризовать. Окисление таких аддуктов приводит к образованию замещённых ароматических производных . 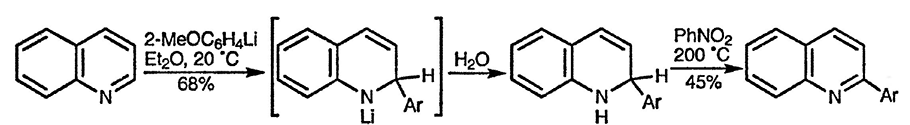 Викариозное нуклеофильное замещение (разд. 2.3.3.) позволяет вводить заместители в нитрохинолины: так, например, цианометильная и фенилсульфо-нилметильная группы могут быть введены в орто-положение к нитрогруппе в положение C(6) 5-нитрохинолина и положение C(5) 6-нитрохинолина. 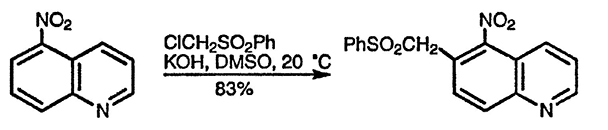 Особые возможности для получения хинолинов, замещённых по положению 5, открывает реакция присоединения литийорганических соединений к осмиевым комплексам хинолина ПРИМЕРЫ СИНТЕЗОВ, МЕТОДИКИ, УСЛОВИЯ И ПРИМЕНЕНИЕ СИНТЕЗИРУЕМЫХ ВЕЩЕСТВ В основе ряда методов гетероциклизации лежат реакции внутримолекулярного алкилирования и ацилирования азот-, кислород- и серосодержащих функциональных групп 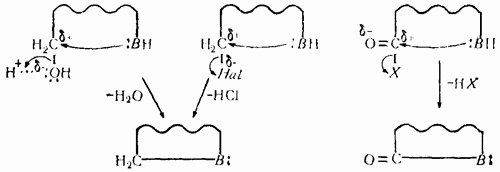 Например 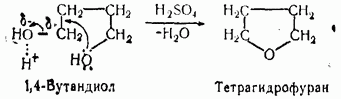 Источником нуклеофильных фрагментов может служить карбонильная группа, способная, как известно, енолизироваться или присоединять 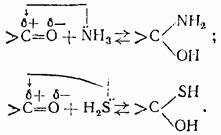 Поэтому для синтеза гетероциклов часто используют дикарбонильные соединения. Во многих случаях необходимой стадией получения ненасыщенных гетероциклов является дегидратация или дегидрирование (окислительное дегидрирование): 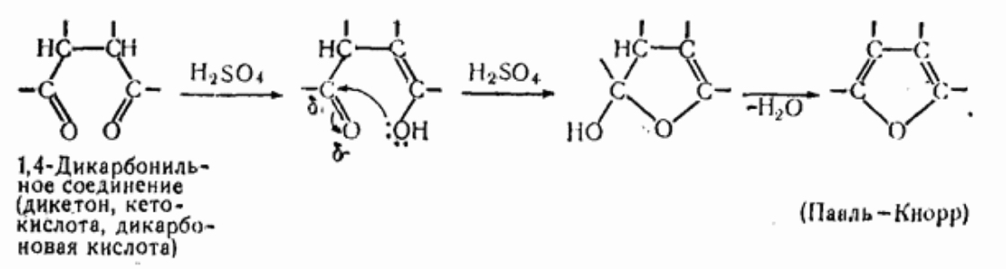 Если дикарбонильное соединение обрабатывать наряду с дегидратирующим агентом аммиаком или сероводородом, то образуется соответственно пиррол или тиофен: 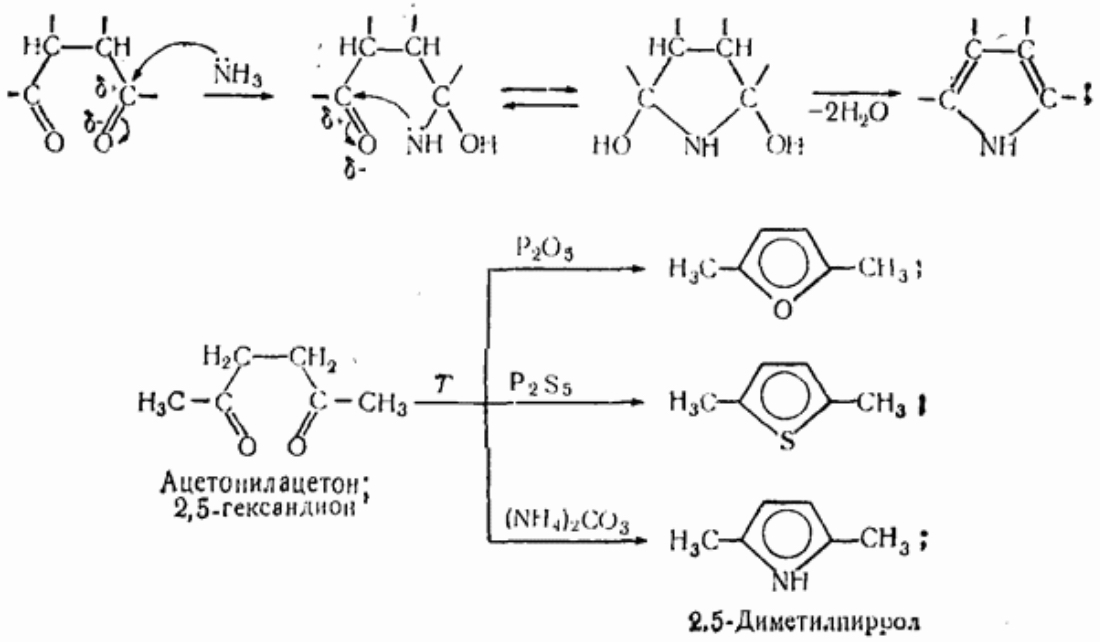 Пятичленные ароматические гетероциклы взаимно превращаются друг в друга над дегидратирующим катализатором при 400 °С (Юрьев): 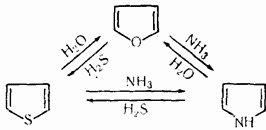 Таким же превращениям подвергаются соответствующие гидрированные гетероциклы. Гетероциклические амины, чаще в виде полифункциональных производных, находят применение, являясь обычно полупродуктами в органических синтезах. Получаются с применением аминов такие лекарственные препараты, как новокаин, спазмолитин, парацетамол, сульфаниламидные препараты. ЗАКЛЮЧЕНИЕ В реферате были подробно проанализированы основные агенты процессов ацилирования и алкилирования, рассмотрены реакции ацилирования и алкилирования гетероциклических соединений, приведены примеры синтезов, методики, условия и применение синтезируемых веществ в процессах ацилирования и алкилирования. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ Андрюшкова О.В., Козлова А.В.Органическая химия. Избранные разделы: учебное пособие. - Новосибирск: Изд-во НГТУ, 2010. 2. Артеменко А.И. Органическая химия. - М., 2012. Реутов О.И., Курц А.Л., Бутин К.П. Органическая химия: в 2 т. - М.: Изд.МГУ, 2010. |