Паровая каталитическая конверсия углеводородов. Хабибуллин И.С. Паровая конверсия. Реферат паровая каталитическая конверсия углеводородов
 Скачать 171 Kb. Скачать 171 Kb.
|
|
РЕФЕРАТ Паровая каталитическая конверсия углеводородов Факультет ____________________________________ Кафедра ______________________________________ Группа _______________________________________ Дата защиты " " 20 г.
Введение…………………………………………………………………………...3 1. Назначение процесса.....................................................................................4 2. Сырье процесса…………………………………………………………….5 3. Параметры.................................................................................................... .5 4. Катализаторы …………………………………………………..………….8 5. Реакции………………………………………………………………….…10 6. Технологическая схема с обязательным описанием, на каких НПЗ РФ есть такие установки..........................…...............................................................11 7. Материальный баланс………………………………………………….…13 8. Продукты…..................................................................................................16 Заключение………………………………….…………………………….….…..17 Список литературы………………………………………….…………………...18 Введение Высокая концентрация тепловой энергии, возникающая в некоторых технических объектах при повышении удельной мощности или термодинамического коэффициента полезного действия либо являющаяся паразитной, порождает нежелательные тепловые потоки, которые приводят к большим теплопотерям и перегревам конструкции. Теплопотери характеризуются тепловым потоком, исходящим из высокотемпературной зоны технического объекта и рассеивающимся вне его. Перегрев характеризуется накоплением тепловой энергии внутри технического объекта, приводящим к росту температуры и затрудняющим работу. Традиционно проблемы теплопотерь и перегрева конструкции решаются раздельно — с помощью соответственно теплоизоляции и охлаждения. В условиях мощных тепловых потоков (q >> 100 кВт/м2) применение теплоизоляции невозможно, а применение обычных способов охлаждения требует создания мощных систем, снижающих эффективность комплекса в целом. Назначение процесса Паровая конверсия — получение чистого водорода из лёгких углеводородов (например метана, пропан-бутановой фракции) путём парового риформинга (каталитической конверсии углеводородов в присутствии водяного пара). Реформирование газового пара является самым популярным и самым дешевым способом производства водорода. По сравнению с, например, электролизом воды, количество водорода, полученного на единицу потребляемой энергии, намного выше. Реформирование парового природного газа обычно происходит в два этапа. Первый этап называется первым риформингом и осуществляется в трубах, заполненных никелевым катализатором, нанесенным на алюминиевую подложку. Тепло, необходимое для процесса, подается через стенки труб, нагретых снаружи путем сжигания другой части природного газа. Каталитической конверсией углеводородов принято называть процесс получения водород содержащих технологических газов - сырья для синтеза аммиака, метанола и других продуктов. Назначение установки — производство водорода, потребность в котором возрастает из года в год в связи с постоянным углублением процессов переработки нефти, повышением требований к качеству получаемых топлив и смазочных материалов, а также в связи с необходимостью обессеривания энергетического топлива. В промышленности получают технический водород с содержанием водорода 95—98 % (об.). Производство технического водорода меньшей концентрации приводит к его повышенному расходу на установке гидрокрекинга, а большей концентрации — требует значительных затрат и экономически нерентабельно [6]. Паровую конверсию углеводородов следует вести, избегая осаждения углерода на катализаторе, способствующего его разрушению и увеличению гидравлического сопротивления в реакторе. Для предотвращения этого процесса следует поддерживать некий минимальный расход водяного пара в процессе паровой конверсии углеводородов. Теоретически этот расход не должен быть ниже 2:1. Однако для улучшения теплопередачи на практике подают до 4—5 м3пара на конверсию 1 м3 метана. В заводской практике для доочисткисырья для водородных установок нашли применение три типа процессов: очистка моноэтаноламином от сероводорода, одностадийное поглощение соединений серы поглотителем на основе оксида цинка (в случае присутствия лишь термически нестойких соединений серы) и двухступенчатая схема извлечения соединений серы, включающая деструктивное гидрирование сернистых соединений с последующим поглощением сероводорода на оксиде цинка. Сырье процесса В качестве сырья для получения водорода методом паровой каталитической конверсии легких углеводородов могут быть использованы природные и заводские (сухие и жирные) газы, а также прямогонные бензины. Этот наиболее распространенный метод производства водорода включает три стадии: подготовку сырья к конверсии, собственно конверсию и удаление из продуктов оксидов углерода [5]. Применяемая в настоящее время технология per ламентирует некоторые требования к качеству сырья, в частности по содержанию в нем соединений серы (в газах до 100 мг/м3, в бензинах до 0,3 мг/кг), отравляющих как никелевый катализатор паровой конверсии углеводородов, так и цинкмедный катализатор низкотемпературной конверсии оксида углерода. Присутствие в сырье непредельных углеводородов вызывает образование углеродистых отложений на катализаторепаровой конверсии углеводородов. Параметры В заводской практике для доочисткисырья для водородных установок нашли применение три типа процессов: очистка моноэтаноламином от сероводорода, одностадийное поглощение соединений серы поглотителем на основе оксида цинка (в случае присутствия лишь термически нестойких соединений серы) и двухступенчатая схема извлечения соединений серы, включающая деструктивное гидрирование сернистых соединений с последующим поглощением сероводорода на оксиде цинка. Современные установки по производству водорода обладают мощностью от 300 тыс. м3 до 3 млн. м9 водорода в сутки; для них характерны рабочие давления в интервале 2—3 МПа. Установка состоит из следующих секций: подготовки сырья (компрессор, подогреватель, аппараты для очистки сырья от соединений серы, пароперегреватель и инжекторный смеситель); паровой конверсии (печь паровой конверсии и паровой котел-утилизатор); конверсии оксида углерода в диоксид (реакторы средне- и низкотемпературной конверсии); очистки технологического газа от диоксида углерода (абсорбция горячим водным раствором карбоната калия, регенерация и др.) и секции метаниро-вания. Технологическая схема установки представлена на рис. VI-4. Сырье (газ) сжимают компрессором 9 до давления 2,6 МПа, подогревают в подогревателе, расположенном в конвекционной секции печи 8, до температуры 300—400 °С"и подают в реакторы 2 и 3 для очистки от соединений серы. К очищенному газу в смесителе 7 добавляют водяной пар, перегретый до 400—500 °С в пароперегревателе, также расположенном в конвекционной секции печи 8. Полученная парогазовая смесь поступает впечьпаровой конверсии 8. Собственно процесс паровой конверсии углеводородов проходит в вертикальных трубчатых реакторах, заполненных катализатором и размещенных в радиантной секции печи в один, два или несколько рядов, закрепленных только внизу или вверху и обогреваемых с двух сторон. Типичный катализатор процесса — никель, нанесенный на оксид алюминия. Парогазовая смесь с температурой 400—500°С подается в реакционную трубу через верхний коллектор, а конвертированный газ отводится снизу. Газовые факельные горелки располагаются в своде печи 8, а дымовые газы поступают сверху в нижние борова и затем через общий боров, расположенный в торце печи, с температурой 950— 1100°С — в конвекционную секцию печи. Топливом для печи служит очищенный от сернистых соединений технологический или природный газ. Воздух, необходимый для горения, подается воздуходувкой 4 через теплообменник 6, где он подогревается дымовыми газами до 300—400°С, затем дымовые газы отсасываются дымососом 5 и выводятся в атмосферу через дымовую трубу 1. Конвертированный газ, охладившийся до 400— 450°С в паровом котле-утилизаторе 10, поступает в реактор 11 среднетемпературной конверсии оксида углерода в диоксид над железохромовым катализатором. После понижения температуры до 230— 260°С в котле-утилизаторе 10 и подогревателе воды 12 парогазовая смесь поступает в реактор 13 низкотемпературной конверсии оксида углерода над цинк-медным катализатором. Смесь водорода, диоксида углерода и водяного пара охлаждают далее в теплообменниках 6 до 104 °С и направляют в абсорбер 14 на очистку горячим водным раствором карбоната калия от диоксида углерода. Насыщенный диоксидом углерода раствор поступает из абсорбера 14 в турбину 15, где его давление снижается примерно с 2,0 до 0,2—0,4 МПа, а затем в регенератор 16. Здесь в результате подогрева раствора в теплообменнике 6 и снижения давления из раствора выделяется диоксид углерода и вместе с парами воды выводится в атмосферу [1]. Водородсодержащий газ из абсорбера 14, подогретый до 300 °С в теплообменнике 6, поступает в реактор метанирования 17, где непревращенный оксид и неудаленный диоксид углерода гидрируются с образованием метана. После метанирования водород охлаждается в теплообменных аппаратах 6 и 12 до 30— 40 °С и далее в сепараторе 18 отделяется от сконденсировавшегося водяного пара. Водород компри-мируют компрессором 19 до давлений, требуемых потребителю (обычно 4—15 МПа). Конверсия углеводородов ведется при 800— 900 °С и 2,2—2,4 МПа над никелевым катализатором. Расход природного газа составляет 1,03—1,05 м3 на 1 м3 получаемого технического водорода; расход водяного пара—от 0,60 до 0,66 м3 на 1 м3 сухого газа. Спецификой работы установки, требующей строжайшего соблюдения правил безопасности и правил эксплуатации аппаратов, работающих под давлением, является применение взрывоопасных и токсичных веществ. Установка паровой каталитической конверсии углеводородов для производства водорода часто является составной частью установки гидрокрекинга; ее строительство обходится примерно в 25—30 % стоимости установки гидрокрекинга. Катализаторы Катализатор паровой конверсии углеводородов на основе никеля, содержащий в качестве никельсодержащего каталитически активного компонента оксид никеля NiO и дополнительно оксид циркония Zr2O при соотношении компонентов (% об.): оксид никеля - 10-70, оксид циркония - 30-90, отличающийся тем, что он дополнительно содержит до 10% об. порошка никеля карбонильного и/или порошка нихрома марки ПХ20Н80. Способ получения катализатора, состоящий в газотермическом напылении каталитически активного материала на теплопроводную подложку, отличающийся тем, что из порошков оксидов никеля NiO и циркония Zr2O соответственно выделяют фракции 30-100 мкм, смешивают их в заданном объемном соотношении, добавляют порошок никеля карбонильного и/или порошок нихрома марки ПХ20Н80, затем подвергают конгломерации и осуществляют плазменное напыление полученной смеси на заранее подготовленную загрунтованную порошком металлического никеля и/или нихрома поверхность [3]. В настоящее время основным, наиболее производительным и экономически оправданным методом получения водорода является паровая каталитическая конверсия (риформинг) углеводородов (природного газа, метана). В ходе процесса паровой конверсии метана осуществляются две целевые реакции, собственно реакция паровой конверсии метана: и реакции конверсии оксида углерода: в результате завершения которых в качестве продукта образуется водородсодержащий конвертированный газ (конгаз, синтез-газ), из которого затем и выделяют водород требуемой степени очистки. Целевые реакции процесса являются каталитическими, то есть, для их успешного осуществления применяются различные виды катализаторов. Наиболее распространенным каталитически активным элементом для процесса паровой каталитической конверсии метана является никель, хотя известны катализаторы, в которые в качестве каталитически активных компонентов входят и другие металлы, например, кобальт, платина, родий, рутений, палладий и проч. Выбор никеля обусловлен, главным образом, его высокой каталитической активностью при достаточно низкой цене. Главным недостатком никелевых катализаторов паровой конверсии метана традиционно является их склонность к углеродообразованию, что чревато дезактивацией каталитически активной поверхности и выходом катализатора из строя, а также забиванием газоходов контактного аппарата свободным пироуглеродом, образующимся из монооксида углерода при недостатке водяного пара, который, как правило, подается на процесс в избытке не менее 3,7:1 по отношению к метану. Целью катализатора является повышение эффективности и надежности процесса паровой конверсии углеводородов (метана) путем повышения селективности целевых реакций за счет снижения вероятности выпадения свободного пироуглерода на каталитически активных поверхностях контактного аппарата и обеспечения возможности проведения процесса при пониженных значениях избытка водяного пара. Указанные меры ведут к значительному снижению издержек производства водорода, связанному с получением большого количества перегретого водяного пара. Реакции В настоящее время конверсия метана и его гомологов является основным промышленным методом получения водорода и технологических газов для синтеза аммиака, спиртов, моторных топлив и других продуктов, В процессе конверсии метан окисляется водяным паром, диоксидом углерода или кислородом но следующим основным реакциям: CH4 + Н2О= СО + ЗН2 - 206,4 кДж/моль (5.1) СН4 + СО2 =2СО + 2Н2 - 248,3 кДж/моль (5.2) СН4 + 0,5О2 =CO+2H2+ 35,6 кДж/моль (5.3) СО + H2О=СО2 +Н2 +41,0кДж/моль(5.4) Реакции окисления гомологов метана протекают аналогично. Так,взаимодействие их с водяным паром может быть в общем виде выражено уравнением CnHm+ nH2O =nCO+H2(2n+m)/2 +Q Если требуется получить технически чистый водород, проводят реакцию (5.1) или (5.3) с последующей конверсией СО по реакции (5.4). При получении азотоводородной смеси для синтеза аммиака необходимое количество азота вводят с воздухом на стадии конверсии углеводородных газов либо при промывке конвертированного газа жидким азотом для удаления остатков оксида углерода. При получении смесей Н2-СО для синтеза спиртов комбинируют реакции (5.1), (5.2) и (5.3) , подбирая соотношение Н2О : СО: по объему в исходной смеси таким образом, чтобы отношение Н2 : СО но объему в конвертированном газе составляло (2—2,5) : 1. Для проведения в промышленных условиях сильно эндотермических реакций (5.1) и (5.2) требуется подвод тепла извне. При добавлении кислорода протекает экзотермическая реакция (5.3), что позволяет осуществить процесс конверсии углеводородных газов автотермично. Зависимости констант равновесия от температуры (Т в К) могут быть представлены в виде уравнений: Кр1= ехр [(8,752 Ln(Tp) - ( -22635;63- 29,76863Tp -0,005269261Т2Р + 0,4927824*10-6Т3р + 8,736*10-12Т4р)/Т] (5.5) Kp4= ехр (-0,768335 Ln (Тр) - (4943,27 - 1,50621 + + 30,1О18*10-4Т2р-9,6605*10-7Т3р+ 1,475*10-10Т4р)/Т] (5.6) На основе известных методик через мольные доли всех компонентов. участвующих в реакциях (5.1) и (5.4) ведут расчет равновесных составов конвертированного газа при различных значениях давления (в МПа). соотношениях пар : газ в температурах реакций. Химические превращения, лежащие в основе рассматриваемого процесса, относятся к реакциям окисления углеводородов. Многочисленные реакции данного типа можно разделить на две большие группы: реакции мягкого окисления (без деструкции углеводородного скелета) и реакции деструктивного окисления. Технологическая схема с обязательным описанием, на каких НПЗ РФ есть такие установки Парогазовая смесь с температурой 400500 °C подается в реакционную трубу через верхний коллектор, а конвертированный газ отводится снизу. Газовые факельные горелки располагаются в своде печи 8, а дымовые газы поступают сверху в нижние борова и затем через общий боров, расположенный в торце печи, с температурой 9501100 °C — в конвекционную секцию печи. Топливом для печи служит очищенный от сернистых соединений технологический или природный газ. Воздух, необходимый для горения, подается воздуходувкой 4 через теплообменник 6, где он подогревается дымовыми газами до 300400 °C, затем дымовые газы отсасываются дымососом 5 и выводятся в атмосферу через дымовую трубу 1. 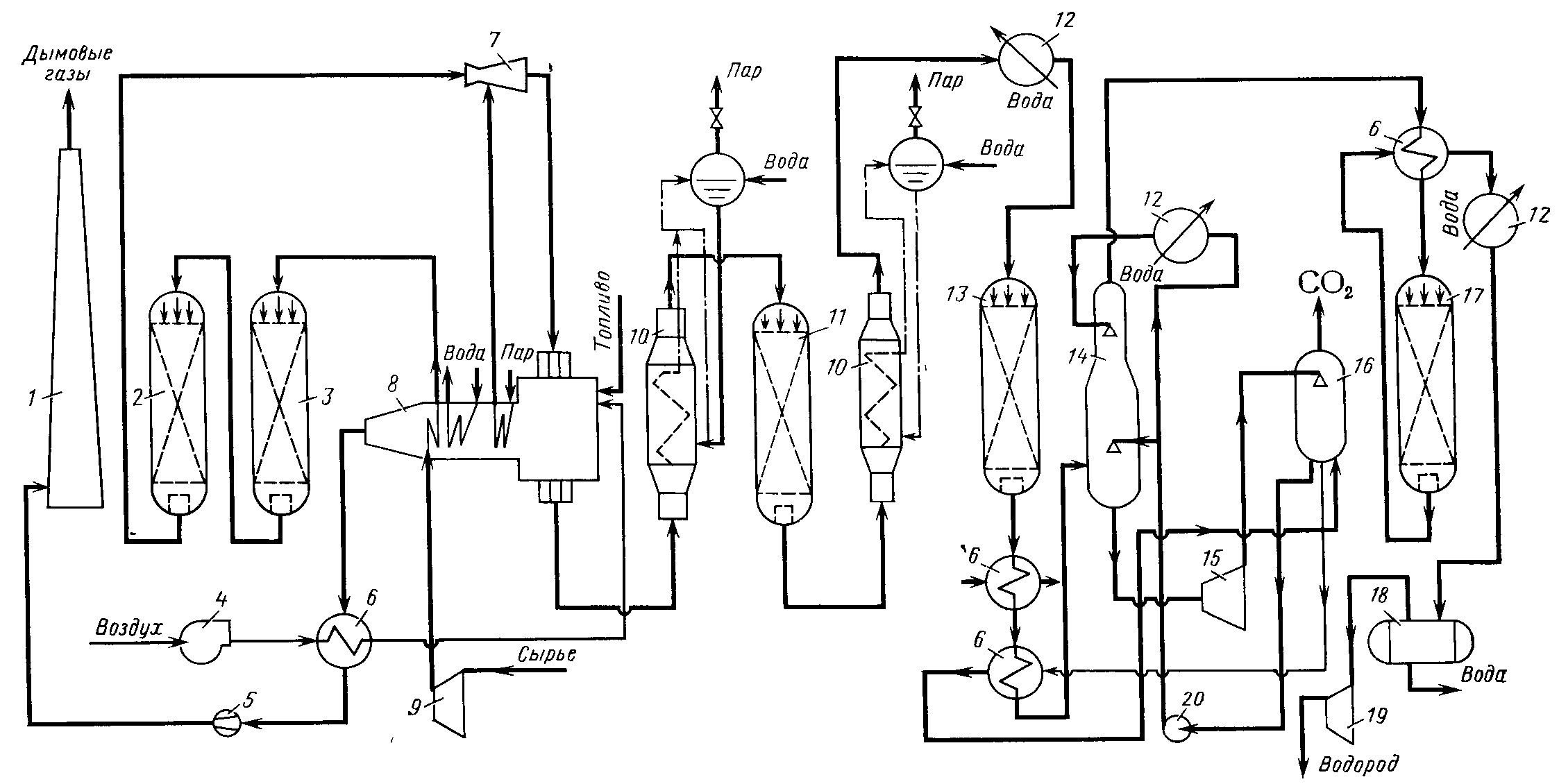 Рис.6.1. Технологическая схема установки для производства водорода методом паровой каталитической конверсии легких углеводородов: 1 — дымовая труба; 2 — реактор гидрирования; 3 — адсорбер для поглощения сероводорода; 4 — воздуходувка: 5 — дымосос; 6 —теплообменники; 7 — инжекторный смеситель; 8 — печь паровой конверсии; 9, 19 — компрессоры; 10 — котлы-утилизаторы; II, 13 — реакторы конверсии СО в СО2; 12 — подогреватель; 14 — абсорбер для очистки от CO2; 15 — турбина; 16 — регенератор абсорбента; 17 — реактор метанирования; 18 — газосепаратор; 20 — насос. Конвертированный газ, охладившийся до 400450 °C в паровом котле-утилизаторе 10, поступает в реактор 11 среднетемпературной конверсии оксида углерода в диоксид над железохромовым катализатором. После понижения температуры до 230260 °C в котле-утилизаторе 10 и подогревателе воды 12 парогазовая смесь поступает в реактор 13 низкотемпературной конверсии оксида углерода над цинк-медным катализатором. Смесь водорода, диоксида углерода и водяного пара охлаждают далее в теплообменниках 6 до 104 °C и направляют в абсорбер 14 на очистку горячим водным раствором карбоната калия от диоксида углерода. Насыщенный диоксидом углерода раствор поступает из абсорбера 14 в турбину 15, где его давление снижается примерно с 2,0 до 0,2—0,4 МПа, а затем в регенератор 16. Здесь в результате подогрева раствора в теплообменнике 6 и снижения давления из раствора выделяется диоксид углерода и вместе с парами воды выводится в атмосферу. Водородсодержащий газ из абсорбера 14, подогретый до 300 °C в теплообменнике 6, поступает в реактор метанирования 17, где непревращенный оксид и неудаленный диоксид углерода гидрируются с образованием метана. После метанирования водород охлаждается в теплообменных аппаратах 6 и 12 до 3040 °C и далее в сепараторе 18 отделяется от сконденсировавшегося водяного пара. Водород компримируют компрессором19 до давлений, требуемых потребителю (обычно 415 МПа). Материальный баланс Для определения расхода продуктов при проведении того или иного технологического процесса приготовления пищи, выхода готовой продукции, размеров и производительности аппаратов, а также расхода теплоты необходимо предварительно составить материальный баланс. Для периодических процессов, материальный баланс составляется на одну операцию, для непрерывных процессов – на единицу времени, например на 1 ч. По закону сохранения материи масса веществ, поступающих на переработку, должна быть равна массе веществ, прошедших переработку. Практически в процессе переработки пищевых продуктов имеют место потери, поэтому масса готовых продуктов, прошедших тот или иной технологический процесс, всегда меньше массы исходных продуктов, поступающих на обработку: М1 = М2+ Мпот, (7.1) где М1 – масса продуктов, поступающих на тепловую обработку, кг; М2 – масса готовой продукции, кг; Мпот – потери массы продуктов, кг. В свою очередь М1 = m1 + m2 + … + mn, (7.2) где m1, m2 … mn – массы отдельных составляющих продуктов. Уравнение (6.1) называют уравнением материального баланса. Оно применимо ко всему процессу в целом и к любой его стадии. Материальный баланс может быть составлен для всех продуктов, участвующих в технологическом процессе, либо для отдельных его компонентов. Материальный баланс для технологического процесса варки продуктов в большом количестве воды (например, картофеля) принимает следующий вид: М1 + W1 = М2 + W2 + ∆W, (7.3) где W1 – масса воды, загружаемой в аппарат, кг; W2 – масса воды удаляемой после тепловой обработки, кг; ∆W – масса выпариваемой воды, кг. Для технологического процесса варки первых блюд М1 + W1 = М2 + ∆W, (7.4) где W1 – масса жидкости (воды, бульона или молока), загружаемой в аппарат, кг; Данные материального баланса обычно сводят в таблицу прихода и расхода продуктов (продуктовые ведомости). Материальный баланс имеет большое значение для правильного ведения технологических процессов. При проектировании новых предприятий он позволяет правильно выбирать схему технологического процесса, размеры аппаратов и машин. По материальному балансу выявляют непроизводительные потери, а также определяют состав и качество различных отходов или побочных продуктов [4]. Кроме того, на основании материального баланса определяют выход продуктов. Отношение массы готового продукта (М2), полученного в результате проведения процесса, к массе исходных продуктов М1 (М1 + W1) выраженное в процентах, называется выходом продукта. Обозначив выход готового продукта Z, получим Z =  ; Z = ; Z =  . (7.5) . (7.5)Вследствие испарения воды в процессе тепловой обработки выход продукта всегда меньше 100%. Чем ближе выход к 100%, тем совершеннее процесс, тем меньше расход исходных продуктов и тем ниже стоимость полуфабрикатов или готовой продукции. При осуществлении многих технологических процессов масса выпариваемой воды представляет собой значительную величину, которая зависит от вида продукта, продолжительности тепловой обработки и интенсивности подвода теплоты. Так, при жарке мясных натуральных изделий потери составляют 37…40%, рубленых – 19…30%; рыбных натуральных изделий – 18…20%; картофеля во фритюре – 50%. Иногда выход готового продукта относят не к общему количеству загруженных продуктов, а к массе какого-либо одного из исходных продуктов (компонентов), в этом случае выход продукции может быть и больше 100%. Например, выход каш в кулинарной практике определяется по отношению к мaccе круп, загруженных в варочный котел. Массу продуктов, загруженных в аппарат, и потери массы при тепловой обработке определяют по соответствующим нормам из сборника рецептур блюд и кулинарных изделий [6]. Нагрев пищевых продуктов связан с затратами тепловой энергии. При расчетах тепловых аппаратов, а также при оценке и исследовании существующих конструкций количество подводимой извне теплоты обычно приходится определять из уравнения теплового баланса, на основании чего вычисляется общий расход теплоты и мощность нагревателей или расход топлива. Продукты Каталитическая конверсия углеводородов в настоящее время является основным промышленным способом получения водорода. Кроме природных и попутных нефтяных газов в качестве исходного сырья для его производства используют также коксовый газ и газы переработки нефти. При повышенных температурах углеводороды реагируют с водяным паром, диоксидом углерода, кислородом в соответствии с уравнениями: Как правило, конверсия углеводородов протекает в области, в которой образование углерода термодинамически неблагоприятно. При температурах ниже 700 К и повышенных давлениях основными продуктами реакции являются СН4 и СО2. При высоких температурах (выше 1500 К) реакции протекают практически до образования Н2 и СО [7]. Каталитическую конверсию природного газа или сжиженных газов и бензиновых фракций с температурой кипения до 473 К водяным паром осуществляют под давлением до 4,0 МПа при температуре газа на выходе 1033-1173 К в зависимости от требуемого состава газовой смеси. Смесь углеводородов и паров воды подается в реакционные трубы, находящиеся в топке печи и поглощающие от нее тепло. Процесс проводят на катализаторах Ni/Аl2О3. Для получения газа требуемого состава, например для синтеза метанола, в сырье вводят диоксид углерода и осуществляют процесс пароуглекислотной конверсии. В этом случае протекает также реакция: Проведение процесса конверсии метана смесью водяного пара и диоксида углерода позволяет широко варьировать отношение Н2:СО в синтез-газе. Как и в случае реакций паровой конверсии углеводородов, реакция пароуглекислотной конверсии метана обратима; остальные углеводороды конвертируются полностью. Заключение Использование предлагаемого технического решения позволяет улучшить теплоперенос через стенку труб в печи риформинга и как результат снизить разность температур между их наружной поверхностью и выходящим синтез-газом. Одновременно с этим удается уменьшить перепад давления по катализаторному слою, сократить расход топливного газа на проведение конверсии, увеличить выработку синтез-газа на агрегатах аммиака. Реакция паровой конверсии, ведущая к получению наибольшего количества водорода среди реакций конверсии углеводородов, обеспечивает также отсутствие выпадения твердых продуктов реакции в широких интервалах температур и составов. Варьируя тип и активность катализаторов, можно поддерживать различную интенсивность отведения тепла. Список литературы Гартман В.Л., Обысов А.В., Дульнев А.В., Афанасьев С.В. Новая базовая форма катализаторов для реакторов конверсии углеводородов//Катализ в промышленности. 2012.№3. С. 57–61. Сергеев С.П., Майдуров Н.П., Афанасьев С.В., Рощенко О.С. Теплообмен и гидравлика для течения газа в подъемной трубе трубчатой печи первичного реформинга//Химическая промышленность сегодня. 2014. №4. С. 35–41. Обысов А.В., Круглова М.А., Дульнев А.В., Афанасьев С.В. Разработка высокоэффективного катализатора для процессов очистки технологических газов//Тезисы докл. II Российского конгресса по катализу «Роскатализ». 2–5 октября 2014 г. Самара. Т. 2. С. 150. Патент на изобретение RU №2535826. МПК С01В 3/38, В01О 23/755. Способ получения синтез-газа паровой конверсией углеводородов Афанасьев С.В., Рощенко О.С., Дульнев А.В., Обысов А.В. Влияние типа катализатора на надежность работы печей риформинга агрегатов аммиака//Вектор науки Тольяттинского государственного университета. 2011. №4 (18). С.25–28. Патент на изобретение RU №2357919. МПК С01В 3/38, В01J 35/08. Способ получения синтез-газа, обогащенного водородом и монооксидом углерода, путем каталитического риформинга углеводородсодержащего сырья. Афанасьев С.В., Трифонов К.И. Физико-химические процессы в техносфере. Учебник. Самара: Изд-во Самарского научн. центра РАН, 2014. 195 с. |
