Периндоприл. Реферат Периндоприл Учебный предмет Основы медицинский химии студентка группы здо52 Кочарян Я. Р
 Скачать 116.61 Kb. Скачать 116.61 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Российский химико-технологический университет имени Д. И. Менделеева»
РЕФЕРАТ «Периндоприл» Учебный предмет: Основы медицинский химии Выполнила: студентка группы ЗДО-52 Кочарян Я.Р. Проверил: Сардушкин М.В. _____________________ Москва 2021 Содержание Введение 3 Историческая справка................................................................................................. 3 Фармакология...............................................................................................................4 Фармакодинамика........................................................................................................ 4 Фармакокинетика.........................................................................................................4 Зарегистированные торговые наименования............................................................6 Метод получения 7 Список литературы и интернет источников............................................................11 Введение  Структурная формула Брутто формула C19H32N2O5 Свойства Ингибитор АПФ. Периндоприла эрбумин (трет-бутиламин) — белый кристаллический порошок. Легко растворим в воде (60 вес.%), спирте и хлороформе. Молекулярная масса 368,47 (свободная кислота); 441,61 (терт-бутиламиновая соль).6 Периндоприл в форме свободной кислоты периндоприла эрбумина является пролекарством и метаболизируется in vivo путем гидролиза сложноэфирной группы с образованием периндоприлата, биологически активного метаболита.1 Историческая справка История открытия ИАПФ начинается с 60-х годов XX века, когда было обнаружено, что укус бразильской змеи Bothrops jararaka приводит к резкому снижению уровня артериального давления (АД).В 1965 г. бразильский ученый Ferreira, изучая яд гремучей змеи Bothrops Jararaca, обнаружил его способность стабилизировать брадикинин. Пептиды, присутствующие в яде, потенцируют гипотензивный эффект брадикинина, подавляя кининазу-2. Данное вещество было названо «брадикининпотенцирующий фактор». Проведя дополнительные исследования, Yang и соавт. показали, что это вещество идентично АПФ. Так был создан первый ИАПФ тепротид. В 1977 г. был синтезирован первый пероральный ИАПФ каптоприл. И наконец, в 1980 г. был разработан новый класс ИАПФ — карбоксильный дипептид эналаприл. Потом были синтезированы другие ИАПФ, имеющие свои особенности ФармакологияПериндоприла эрбумин — пролекарство, превращается в периндоприлат, который ингибирует АПФ у человека и животных. Механизм, посредством которого периндоприлат снижает АД, как полагают, заключается в основном в ингибировании активности АПФ. АПФ — пептидилдипептидаза, которая катализирует превращение неактивного декапептида, ангиотензина I, в вазоконстриктор, ангиотензин II. Ангиотензин II является сильным периферическим вазоконстриктором, который стимулирует секрецию альдостерона корой надпочечников и обеспечивает отрицательную обратную связь в отношении секреции ренина. Ингибирование АПФ приводит к снижению уровня ангиотензина II в плазме, что ведет к снижению вазоконстрикции, повышению активности ренина в плазме и снижению секреции альдостерона. Последнее приводит к диурезу и натрийурезу и может быть ассоциировано с небольшим увеличением сывороточного калия.2 АПФ идентичен ферменту кининаза II, разрушающему брадикинин. Еще предстоит выяснить, играет ли повышенный уровень брадикинина, сильного вазодепрессорного пептида, роль в терапевтических эффектах периндоприла эрбумина. В то время как основной механизм периндоприла в снижении АД, как полагают, осуществляется через РААС, ингибиторы АПФ оказывают некоторый эффект даже при очевидной гипертензии при низком содержании ренина. Периндоприл изучали у относительно небольшого количества пациентов негроидной расы, обычно имеющих низкое содержание ренина, и средний ответ дАД на периндоприл составлял примерно половину ответа, наблюдаемого у пациентов других рас, что согласуется с предыдущим опытом применения других ингибиторов АПФ.1 Фармакодинамика После приема периндоприла ингибирование АПФ зависит от дозы и концентрации в крови, при этом максимальное ингибирование 80–90% достигается при дозе 8 мг и сохраняется в течение 10–12 ч, через 24 ч ингибирование АПФ составляет около 60%. Степень ингибирования АПФ, достигаемая при данной дозе, со временем уменьшается (ID50 увеличивается). Прессорный ответ на инфузию ангиотензина I снижается периндоприлом, но этот эффект не такой стойкий, как эффект на АПФ; через 24 ч после применения дозы 12 мг наблюдается ингибирование примерно на 35%.1 Фармакокинетика Абсорбция При пероральном приеме периндоприла эрбумина Cmax в плазме достигается примерно через 1 ч. Абсолютная биодоступность периндоприла при приеме внутрь—около 75%. После абсорбции примерно от 30 до 50% системно доступного периндоприла гидролизуется до его активного метаболита периндоприлата, средняя биодоступность которого составляет примерно 25%. Cmax периндоприлата в плазме достигаются через 3–7 ч после приема периндоприла. Прием периндоприла эрбумина с пищей существенно не снижает скорость или степень абсорбции периндоприла по сравнению с состоянием натощак. Однако степень биотрансформации периндоприла в активный метаболит периндоприлат снижается примерно на 43%, что приводит к снижению кривой ингибирования АПФ в плазме примерно на 20%, что, вероятно, клинически несущественно. В клинических испытаниях периндоприл обычно применяли не натощак. При дозах периндоприла эрбумина 4, 8 и 16 мг Cmax и AUC периндоприла и периндоприлата увеличиваются пропорционально дозе как после однократного перорального приема, так и в равновесном состоянии при режиме многократного приема 1 раз в день. Распределение Примерно 60% циркулирующего периндоприла связывается с белками плазмы, и только 10–20% периндоприлата находится в связанном состоянии. Следовательно, взаимодействие с другими ЛС, опосредованное связыванием с белками, не ожидается. Метаболизм и выведение Фармакокинетика периндоприла после приема внутрь соответствует многокамерной модели, включая глубокий тканевый компартмент (места связывания АПФ). Средний Т1/2 периндоприла, ассоциированный с большей частью его выведения, составляет примерно от 0,8 до 1 ч. Периндоприл экстенсивно метаболизируется после приема внутрь, и только от 4 до 12% дозы выводится в неизмененном виде с мочой. Было идентифицировано 6 метаболитов, образующихся в результате гидролиза, глюкуронизации и циклизации посредством дегидратации. К ним относятся активный ингибитор АПФ, периндоприлат (гидролизованный периндоприл), глюкурониды периндоприла и периндоприлата, дегидратированный периндоприл и диастереоизомеры дегидратированного периндоприлата. У человека печеночная эстераза, по-видимому, отвечает за гидролиз периндоприла. Фармакокинетика активного метаболита периндоприлата также соответствует многокамерной модели после перорального приема периндоприла эрбумина. Образование периндоприлата происходит постепенно, Cmax в плазме достигается между 3 и 7 ч. Последующее снижение концентрации в плазме показывает кажущийся средний Т1/2 от 3 до 10 ч для большей части элиминации с пролонгированным конечным Т1/2 от 30 до 120 ч в результате медленной диссоциации периндоприлата из мест связывания АПФ плазма/ткань. При повторном пероральном приеме периндоприла 1 раз в день периндоприлат кумулирует, концентрация увеличивается примерно в 1,5–2 раза и достигает равновесного уровня в плазме через 3–6 дней. Клиренс периндоприлата и его метаболитов почти исключительно почечный. Пожилой возраст Концентрации периндоприла и периндоприлата в плазме крови у пожилых пациентов (старше 70 лет) примерно вдвое выше, чем у молодых пациентов, что отражает как повышенное превращение периндоприла в периндоприлат, так и снижение почечной экскреции периндоприлата.5 Сердечная недостаточность Клиренс периндоприлата снижается у пациентов с застойной сердечной недостаточностью, что приводит к увеличению AUC на 40% в интервале дозирования. Нарушение функции почек При дозах периндоприла от 2 до 4 мг AUC периндоприлата увеличивается при снижении функции почек. При Cl креатинина от 30 до 80 мл/мин AUC примерно вдвое больше, чем при 100 мл/мин. Когда Cl креатинина падает ниже 30 мл/мин, AUC увеличивается более заметно. У ограниченного числа иcследованных пациентов клиренс периндоприла при диализе составлял примерно от 40 до 80 мл/мин. Клиренс периндоприлата при диализе варьировал от 40 до 90 мл/мин. Нарушение функции печени Биодоступность периндоприлата повышается у пациентов с нарушением функции печени. Концентрации периндоприлата в плазме у пациентов с нарушением функции печени были примерно на 50% выше, чем у здоровых субъектов или пациентов с гипертензией и нормальной функцией печени.1 Зарегистированные торговые наименования на территории РФ3
Метод получения препарата Принимая во внимание фармацевтическую ценность этого соединения, важной является возможность его получения при помощи эффективного способа синтеза, который легко можно осуществить в промышленном масштабе, что приводит к получению периндоприла с хорошим выходом и с отличной чистотой при использовании исходных веществ с приемлемой стоимостью. В патентной заявке ЕР 0 308 341 описан синтез периндоприла путем пептидного сочетания бензилового эфира (2S,3аS,7аS)-октагидроиндол-2-карбоновой кислоты с этиловым эфиром N-[(S)-1-карбоксибутил]-(S)-аланина с последующим снятием защиты с карбоксильной группы гетероцикла посредством каталитической гидрогенизации. Преимущество этого способа состоит в получении периндоприла с хорошим выходом из исходных веществ, для которых уже описан способ промышленного синтеза. Тем не менее, у этого способа также есть недостатки, связанные с применением дициклогексилкарбодиимида на этапе сочетания: образование примесей сочетания и дициклогексилмочевины, побочного продукта, который тяжело удалить. В настоящее время заявителем был разработан новый способ синтеза периндоприла, который позволяет избежать образования этих вторичных продуктов. Более конкретно, настоящее изобретение относится к способу синтеза периндоприла и его фармацевтически приемлемых солей, который характеризуется тем, что соединение формулы (II) 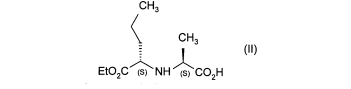 подвергают реакции с соединением формулы (III) в которой R1 представляет собой имидазолильную, бензимидазолильную или тетразолильную группу, получая соединение формулы (IV) 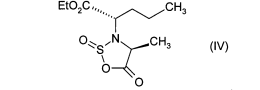 которое подвергают реакции с соединением формулы (V) в которой R2 представляет собой атом водорода, или бензил или линейную или разветвленную C1-С6- алкильную группу, или его солью присоединения с минеральной или органической кислотой, получая, после выделения, соединение формулы (VI) 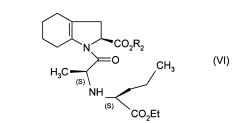 в которой R2 имеет значения, указанные выше, которое гидрируют в присутствии катализатора, такого как, например, палладий, платина, родий или никель, под давлением водорода от 1 до 30 бар, предпочтительно от 1 до 10 бар, получая после снятия защиты, при необходимости, с кислотной функциональной группы периндоприл формулы (I), который превращают, если это является желательным, в фармацевтически приемлемую соль, такую как трет-бутиламиновая соль. Пример, приведенный ниже, иллюстрирует изобретение, но никоим образом его не ограничивает. Пример. трет-Бутиламиновая соль (2S,3aS,7aS)-1-{(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино]пропионил}октагидро-1H-индол-2-карбоновой кислоты. Стадия А. Этил (2S)-2-[(4S)-4-метил-2-оксидо-5-оксо-1,2,3-оксатиазолидин-3-ил]пентаноат. В реактор вносили 200 г N-[(S)-этоксикарбонил-1-бутил]-(S)-аланина и 1,5 л дихлорметана и затем, при 0°С, добавляли 325 г 1H-имидазол-1-сульфинилхлорида. После этого температуру реакционной смеси доводили до температуры окружающей среды и затем, после перемешивания в течение 1 ч, образованный осадок отфильтровывали. Полученный фильтрат упаривали насухо, получая ожидаемый продукт в виде масла. Стадия Б. (2S)-1-{(2S)-2-[(1S)-1-(Этоксикарбонил)бутиламино]пропионил}-2,3,4,5,6,7-гексагидро1H-индол-2-карбоновая кислота. В реактор вносили 200 г (2S)-2,3,4,5,6,7-гексагидро-1H-индол-2-карбоновой кислоты и 1,5 л дихлорметана и после этого 180 мл триэтиламина. Затем медленно добавляли раствор 315 г соединения, полученного на вышеописанной стадии, в 500 мл дихлорметана и после этого перемешивали дополнительно в течение 1 ч при температуре окружающей среды. После добавления воды реакционную смесь охлаждали до 15°С и значение рН устанавливали на 4,2 путем добавление 2н. раствора соляной кислоты. После экстрагирования органические фазы промывали и затем упаривали, получая ожидаемый продукт. Стадия В. (2S,3aS,7aS)-1-{(2S)-2-[(1S)-1-(Этоксикарбонил)бутиламино]пропионил}октагидро-1Ниндол-2-карбоновая кислота. В емкость для гидрирования вносили 200 г соединения, полученного на вышеописанной стадии, в растворе в уксусной кислоте, и затем 5 г 10% Pt/C. Гидрировали под давлением 5 бар при температуре окружающей среды до абсорбирования теоретического количества водорода. Катализатор удаляли путем фильтрации и затем охлаждали до температуры от 0 до 5°С и полученное твердое вещество восстанавливали путем фильтрации. Осадок промывали и высушивали до постоянного веса. Стадия Г. трет-Бутиламиновая соль (2S,3aS,7aS)-1-{(2S)-2-[(1S)-1-(этоксикарбонил)бутиламино] пропионил}октагидро-1Н-индол-2-карбоновой кислоты. Соединение, полученное на вышеописанной стадии (200 г), растворяли в 2,8 л этилацетата и затем добавляли 40 г трет-бутиламина и 0,4 л этилацетата. Затем полученную суспензию нагревали в колбе с обратным холодильником до полного растворения, после этого полученный раствор фильтровали в нагретом состоянии и охлаждали, при перемешивании, до температуры от 15 до 20°С. Затем полученный осадок отфильтровывали, снова превращали в пасту с этилацетатом, высушивали и после этого разрушали, получая ожидаемый продукт с выходом 95% ФОРМУЛА ИЗОБРЕТЕНИЯ Способ синтеза периндоприла формулы (I) 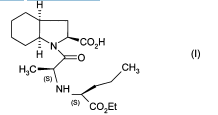 и его фармацевтически приемлемых солей, который характеризуется тем, что соединение формулы (II) 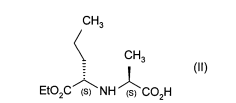 подвергают реакции с соединением формулы (III) в которой R1 представляет собой имидазолильную, бензимидазолильную или тетразолильную группу, получая соединение формулы (IV) 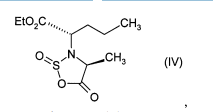 которое подвергают реакции с соединением формулы (V) в которой R2 представляет собой атом водорода, или бензил, или линейную или разветвленную C1-С6- алкильную группу, или его солью присоединения с минеральной или органической кислотой, получая после выделения соединение формулы (VI) 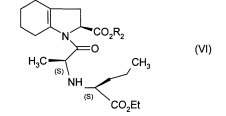 в которой R2 имеет значения, указанные выше, которое гидрируют в присутствии катализатора под давлением водорода от 1 до 30 бар, получая после снятия защиты, при необходимости, с кислотной функциональной группы периндоприл формулы (I), который превращают, если это является желательным, в фармацевтически приемлемую соль. Способ синтеза в соответствии с п.1, в котором давление водорода при осуществлении реакции гидрирования составляет от 1 до 10 бар. Способ синтеза в соответствии с п.1, в котором катализатор выбирают из палладия, платины, родия и никеля. Способ в соответствии с п.1 для синтеза периндоприла в виде трет-бутиламиновой соли. 4 Список литературы и интернет источников 1. https://www.rlsnet.ru/ 2. https://www.vidal.ru/ 3. https://grls.pharm-portal.ru/grls 4. https://patentimages.storage.googleapis.com/ 5. Открытые Журнал «Лечащий Врач» №05/2012 / Открытые системы. - М.: "Издательство "Открытые системы", 2012. - 108 c. 6. Николаев, Л.А. Современная химия / Л.А. Николаев. - М.: Просвещение, 1993. - 543 с. |
