реферат по аналитической химии. реферат анал 3 семестр гравиметрия. Реферат по дисциплине ах и фхма
 Скачать 89.31 Kb. Скачать 89.31 Kb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное автономное учреждение высшего образования ФГАОУ ВО «Уральский федеральный университет имени первого Президента России Б. Н. Ельцина» Институт химико-технологический Факультет химическая технология Кафедра аналитической химии РЕФЕРАТ по дисциплине «АХ и ФХМА» На тему «Техника выполнения весового анализа. Расчеты в гравиметрии» Выполнил: Рыбина Е. А. Группа: Х-210004 Преподаватель: Иванова А. В. Екатеринбург 2022 ОглавлениеВведение 3 1.Суть гравиметрического анализа 4 2. Методы проведения гравиметрического анализа 5 2.1 Метод выделения 5 2.2 Метод отгонки 5 2.3 Метод осаждения 7 3. Метод осаждения. Основные этапы и требования. 8 3.1 Расчет навески анализируемого образца и перевод ее в раствор. 8 3.2 Перевод определяемого вещества в форму осаждения 10 3.3 Фильтрование и промывание осадка 13 3.4 Получение весовой (гравиметрической) формы 15 3.5 Расчет результатов анализа 17 Заключение 19 Список литературы 20 ВведениеВ аналитической химии методы количественного анализа делятся на титриметрический и гравиметрический анализы. Гравиметрический анализ отличается высокой точностью и отсутствием предварительной градуировке измерительных приборов, но при этом является достаточно трудоемким по сравнению с другими методами. Гравиметрический анализ обычно делится на три метода: метод отгонки, метод выделения и метод осаждения. Целью данной работы является рассмотрение основных аспектов в гравиметрическом анализе: основные методы анализа, расчетные формулы и определения. В связи с данной целью задачами являются: подробное рассмотрение метода осаждения, его основные этапы, формулы и подробная характеристика каждого из этапов. 1.Суть гравиметрического анализаГравиметрией называют метод количественного анализа, заключающийся в точном измерении массы определяемого компонента пробы, выделенного в виде соединения известного состава или в форме элемента. Этот метод основан на законе сохранения массы веществ при химических превращениях. К достоинствам гравиметрического анализа относят высокую точность (обычно погрешность составляет 0,1–0,2%) и простоту. С другой стороны, его проведение зачастую более трудоёмко и занимает больше времени по сравнению с другими методами. При анализе макрокомпонентов точность гравиметрического анализа редко удается превзойти с помощью любых других методов. В ходе гравиметрического анализа определяемый компонент, как правило, селективно переводят в малорастворимую форму, затем осадок отделяют, высушивают либо прокаливают и точно взвешивают на аналитических весах. Существуют две формы осадка в гравиметрическом анализе осаждаемая и весовая. Осаждаемая форма — соединение, осаждаемое из раствора и содержащее анализируемый элемент. Весовая (гравиметрическая) форма — соединение, массу которого непосредственно измеряют взвешиванием. Пример, Al(OH)3 Al2O3 + H2O Где, Al(OH)3 – осаждаемая форма Al2O3 – гравиметрическая форма 2. Методы проведения гравиметрического анализаРазличают три группы методов проведения гравиметрического анализа методы выделения, отгонки и методы осаждения. 2.1 Метод выделенияВ методах выделения искомый компонент количественно выделяется в свободном состоянии из анализируемого вещества, после чего определяется его масса. Таким способом часто определяют компоненты сплавов. При растворении определенной навески сплава в царской водке получают раствор, который содержит ионы Au3+ и Cu2+. Добавлением к полученному раствору пероксида водорода, который восстанавливает ионы золота до элементного золотая и не влияет на ионы Cu2+, все золото выделяют в элементном состоянии. Золото, которое выделилось, отфильтровывают, промывают разбавленным раствором хлоридной кислоты от посторонних примесей, помещают вместе с фильтром в предварительно взвешенный фарфоровый тигель, высушивают, прожаривают для удаления летучих примесей и после охлаждения взвешивают. По массе золота, которое выделилось, рассчитывают его содержание в анализируемом сплаве. 2.2 Метод отгонкиМетоды отгонки. Эти методы основаны на измерении точной массы выделившихся в процессе анализа газообразных продуктов. Определяемую часть отгоняют путем нагревания анализируемого вещества или действием соответствующих реагентов, которое сопровождается выделением летучих продуктов. Вещества, определяемые методом отгонки: карбонаты и углекислый газ в карбонатных породах; кристаллизационная вода в гидратах солей; бор в виде летучих эфиров борной кислоты, например, B(OCH3)3; 2) мышьяк в видеAsCl3; германий в видеGeCl4; железо в виде FeCl3; ртуть в виде Hg и т. д. Метод отгонки также применяют при определении ванадия, вольфрама, молибдена, олова, сурьмы, иода, фтора, осмия, серы, селена, теллура, кремния и других элементов. Отгонка SiF4– отделение кремниевой кислоты от других примесей (соединений титана, железа, щелочных и щелочноземельных металлов и др.). Методы отгонки бывают прямые и косвенные. Прямые методы отгонки – методы отгонки, при котором определяемое вещество отгоняют из смеси и затем определяют массу отогнанного вещества или определяемый летучий компонент поглощают специфическим поглотителем и по увеличению массы поглотителя вычисляют содержание определяемого компонента. Пример, определение карбонатов и CO2 в карбонатных породах CaCO3+H+=Ca2++CO2↑+H2O, CO2+2NaOH=Na2CO3+H2O (поглотитель в данном случае – натронная известь CaO+NaOH).  (2.2.1) Процентное содержание карбоната вычисляют по формуле: 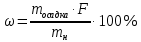 mосадка- весовая форма, г; F–гравиметрический фактор, 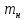 – навеска анализируемого вещества. – навеска анализируемого вещества. (2.2.2) Гравиметрический фактор – это отношение молекулярной массы определяемого вещества к молекулярной массе весовой формы. 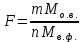 m, n – коэффициенты для того, чтобы уравнять количества атомов или молекул определяемого вещества в числителе и знаменателе. Вещества-поглотители: натронная известь CaO+NaOH (поглощаетCO2), хлорид кальцияCaCl2и оксид фосфора (V)P2O5(поглощают воду). Косвенные методы отгонки – методы, при которых определяется масса остатка. Определяемое вещество отгоняют из точной навески анализируемого образца. После окончания отгонки образец снова взвешивают. Массу определяемого вещества находят по разности масс образца до и после отгона. Пример: определение кристаллизационной воды в кристаллогидрате хлорида бария: BaCl2  2H2O=BaCl2+2H2O↑. 2H2O=BaCl2+2H2O↑.Косвенные способы гравиметрических определений применяют при определении влажности материалов, кристаллизационной воды в кристаллогидратах, потери массы при прожаривании и т. п. 2.3 Метод осажденияМетоды осаждения основаны на выделении определяемого компонента в виде малорастворимого соединения из части исследуемого вещества известной массы (навески). Обычно навеску анализируемого образца (mнав), содержащего определяемое вещество (В), переводят в раствор и добавляют избыток реагента-осадителя (А). Образовавшийся осадок (форма осаждения ВbАa) отфильтровывают, промывают, высушивают (прокаливают) до постоянной массы (весовая форма С) и взвешивают на аналитических весах: bB + aA BbAacC Зная точную массу и состав весовой формы можно вычислить массу и массовую долю определяемого вещества в анализируемом образце. Среди вышеперечисленных этот метод является наиболее значимым и универсальным. Его рассмотрим более подробно. 3. Метод осаждения. Основные этапы и требования.Гравиметрический анализ методом осаждения включает в себя следующие основные этапы: расчет навески анализируемого образца и перевод её в раствор; перевод определяемого вещества в форму осаждения (осаждение); отделение осадка от раствора (фильтрование) и удаление примесей (промывание); перевод формы осаждения в весовую (гравиметрическую) форму; взвешивание весовой формы на аналитических весах и расчет результатов анализа. Рассмотрим подробно каждый из этапов. 3.1 Расчет навески анализируемого образца и перевод ее в раствор.Для того чтобы корректно рассчитать массу навески, необходимо знать формулу анализируемого вещества или хотя бы примерное содержание его в пробе. Чем меньше процентное содержание определяемого компонента в пробе, тем больше должна быть навеска. Масса навески зависит от того, кристаллический ли осадок получается в ходе анализа либо аморфный. Кристаллические осадки более плотные, чем аморфные. Масса и объем получаемого осадка должны быть оптимальными для выполнения необходимых операций. Опытным путем установлено, что оптимальная масса осадка (весовой формы) составляет около 0,5 г для кристаллических осадков и 0,1–0,3 г. для аморфных осадков. Поскольку в гравиметрическом анализе допустимая ошибка взвешивания не должна превышать 0,1%, а лабораторные аналитические весы обеспечивают точность взвешивания до 0,0001 г, минимальная масса навески составляет 0,1 г. Для расчета массы навески анализируемого образца (пробы) в методе отдельных навесок, когда вся навеска вещества целиком используется для анализа используется формула: 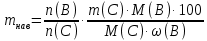   (3.1.2) (3.1.1) Если масса навески очень мала и относительная погрешность её взвешивания на аналитических весах превышает 0,1 %, то в этом случае следует применять метод аликвотных частей (пипетирования) и тогда расчет навески проводится по следующей формуле: 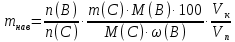 где: Vк – объём мерной колбы, мл; Vп - объём пипетки (аликвоты), мл. Для взятия навесок твердых веществ используются часовые стекла, специальные пробирки или бюксы, для жидкостей – капельницы, специальные колбы и др. Техника взятия навески. 1-й способ. Вначале точно взвешивают пустой бюкс. После этого помещают на него необходимое количество анализируемого вещества и снова точно взвешивают бюкс. 2-й способ. Поместив в бюкс необходимое количество вещества, точно взвешивают его, после чего навеску аккуратно переносят в стакан и снова взвешивают бюкс. Массу навески находят по разности. Взяв навеску, приступают к ее растворению. Растворение навески. В качестве растворителей применяют воду, кислоты (или их смеси), щелочи и различные окислители. Если вещество нерастворимо в воде, прибегают к помощи других растворителей или даже к сплавлению. Органические растворители в весовом анализе не применяют. 3.2 Перевод определяемого вещества в форму осажденияСоединение, в виде которого производят осаждение определяемого компонента, называется формой осаждения. Форма осаждения должна удовлетворять ряду требований: должна быть достаточно малорастворимой, то есть определяемое вещество должно осаждаться практически полностью; должна быть по возможности крупнокристаллической и содержать минимальное количество примесей; должна сравнительно легко переходить в весовую форму Потеря вещества за счет неполноты осаждения не должна превышать предела чувствительности аналитических весов (10–4 г.). В гравиметрическом анализе в качестве формы осаждения используют соединения с малой величиной константы растворимости (KS) (для бинарных соединений KS <10-8, 11 для соединений состава 2:1 KS <10-12). Поэтому выбор реагента-осадителя играет важную роль в весовом анализе. К осадителю также предъявляются определенные требования: При выборе осадителя следует сделать выбор в пользу более летучего соединения, поскольку в этом случае соосажденная с осадком его часть улетучится при промывании или прокаливании. Например, при определении бария в качестве осадителя предпочтительно использовать H2SO4, а не Na2SO4, а при определении железа – NH3, а не NaOH. Желательно выбирать селективный осадитель, т. е. осаждающий только данный ион. Если селективный осадитель не удается подобрать, используют маскирование мешающих определению ионов, т. е. связывают их в достаточно прочные комплексы, не осаждаемые данным реактивом.  (3.2.1) Для расчета количества осадителя n(A) и объёма его раствора V(A) производится на основании молярного соотношения между определяемым веществом и реагентом-осадителем исходя из соотношения. Тогда для метода отдельных навесок имеем: 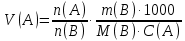 где: V(A) – объём раствора осадителя, мл С(А) – молярная концентрация раствора осадителя, моль/л  (3.2.2) В методе пипетирования в формулу следует ввести множитель, учитывающий аликвотную часть раствора определяемого вещества, взятую для анализа: 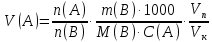 В зависимости от свойств осаждаемого соединения и в определенной мере от условий осаждения могут быть получены два типа осадков, существенно различающихся по ряду свойств: кристаллические и аморфные. Резкой границы между этими типами осадков нет. Нередко одно и то же соединение в зависимости от условий осаждения может образовать либо аморфный, либо кристаллический осадок. Например, BaSO4 при медленном осаждении из водных растворов дает кристаллический осадок. Если растворимость снизить добавлением 30—60 % этанола и проводить осаждение быстро, выпадает типичный аморфный осадок. Условия осаждения кристаллических осадков обусловлены особенностями механизма их образования, который включает образование первичных центров кристаллизации (зародышевых кристаллов) из пересыщенного раствора и дальнейшее их укрупнение.  (3.2.3) Характер образующегося осадка определяется соотношением скоростей двух процессов: образования зародышей и роста первичных центров кристаллизации. Эти скорости зависят от относительного пересыщения раствора (ОП), возникающего при добавлении осадителя: 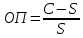 С – концентрация осаждаемого компонента в определенный момент времени в пересыщенном растворе; S – растворимость осаждаемого компонента (концентрация в насыщенном растворе). При малых значениях ОП преобладает рост кристаллов, при больших – образование первичных центров кристаллизации. Поэтому для образования крупнокристаллического осадка, который стремятся получить при гравиметрическом методе анализа, необходимо, чтобы величина ОП раствора при добавлении осадителя оказалась минимально возможной. Из этого условия вытекают определенные требования к процессу осаждения. Правила осаждения кристаллических осадков: Осаждение ведут из разбавленного раствора разбавленным раствором осадителя. Осадитель добавляют очень медленно, по каплям (особенно в начале осаждения). Непрерывно перемешивают раствор во избежание местного пересыщения. Осаждение ведут из горячего раствора (иногда нагревают и раствор осадителя). Полученный осадок отделяют от раствора не сразу, а через некоторое время. При этом происходит «старение» осадка – растворение мелких кристаллов, укрупнение и самоочищение кристаллов. Созревший осадок является более чистым и легко отделяется от маточного раствора. Правила осаждения аморфных осадков. Условия осаждения обусловлены свойствами аморфных осадков – склонностью к пептизации и повышенной адсорбирующей способностью. Для получения аморфных осадков используют горячие концентрированные растворы, осадитель прибавляют быстро при перемешивании. Перед осаждением аморфного осадка в раствор добавляют электролит, вызывающий коагуляцию. После сливания компонентов образовавшийся осадок быстро фильтруют и промывают. При получении осадка любого типа необходимо проверять полноту осаждения: когда раствор над осадком станет прозрачным, по стеклянной палочке, нижний конец которой касается стенки стакана немного выше уровня жидкости, приливают несколько капель осадителя и следят за тем, как эти капли смешиваются с раствором. Если прибавленные капли не вызывают помутнения раствора, можно считать, что полнота осаждения достигнута. Если в месте слияния капель с раствором образуется помутнение, повторяют добавление осадителя и нагревание до достижения полноты осаждения. 3.3 Фильтрование и промывание осадкаОтделение осадка от маточного раствора проводят его фильтрованием после созревания (кристаллические осадки) или сразу после осаждения (аморфные осадки). Фильтрование проводят с использованием беззольных бумажных (если в дальнейшем получение весовой формы предполагается прокаливанием осадка) или стеклянных (получение весовой формы предполагается высушиванием осадка) фильтров. В гравиметрическом анализе чаще всего используют бумажные беззольные фильтры. При сжигании они образуют 0,00003–0,00007 г. золы, массой которой можно пренебречь. Бумажные беззольные фильтры имеют различные диаметры и размеры пор. Степень пористости обозначается цветом ленты на пачке с фильтрами: синяя лента – наиболее плотные (низкая скорость фильтрации); применяют для фильтрования мелкокристаллических осадков; белая лента – средней плотности (средняя скорость фильтрации); применяют для фильтрования крупнокристаллических осадков; красная (черная) лента – наименее плотные (высокая скорость фильтрации); применяют для фильтрования аморфных осадков. Размер фильтра зависит от объема осадка, а не фильтруемой жидкости: фильтр должен быть заполнен осадком приблизительно на 1/3. 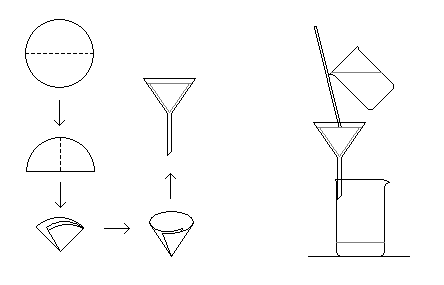 Рис.1 Складывание фильтра и фильтрование При фильтровании вначале пропускают через фильтр прозрачную надосадочную жидкость (маточный раствор). Затем несколько раз промывают оставшийся осадок непосредственно в стакане, в котором проводили осаждение, методом декантации. Для этого к осадку добавляют промывную жидкость, взмучивают его, дают отстояться и сливают промывные воды через фильтр. Промытый таким образом осадок количественно переносят на фильтр, где также промывают несколькими порциями промывной жидкости до полноты удаления мешающих ионов. Состав промывной жидкости (горячая или холодная вода, раствор какого-либо вещества) и условия промывания указываются в аналитической методике. Как правило, при промывании кристаллического осадка в состав промывной жидкости входит небольшое количество осадителя или вещества с одноименным ионом (ω = 1‒3 %) для уменьшения растворимости осадка и связанных с этим потерь.  (3.3.1) При необходимости учитывают потери осадка за счет его растворения в промывной жидкости (mпот, г), для чего требуется знать объём промывной жидкости (Vпж, мл) и растворимость формы осаждения (S, моль/л): 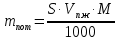 где: М – молярная масса осадка, г/моль  (3.3.2) Относительная погрешность (ɛ, %), связанная с потерей осадка при промывании, рассчитывается по формуле: 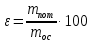 где: mос – масса осадка, г 3.4 Получение весовой (гравиметрической) формыВесовая (гравиметрическая) форма это соединение, в виде которого взвешивается определяемый элемент. К весовой форме предъявляются следующие требования: состав весовой формы должен точно соответствовать её химической формуле; весовая форма должна обладать химической устойчивостью к компонентам воздуха (пары воды, кислород, СО2 и т. д.) и продуктам сгорания фильтра; весовая форма должна быть термически устойчивой в широком интервале температур; желательно малое содержание определяемого элемента в весовой форме (по возможности минимальное значение гравиметрического фактора пересчета), чтобы погрешности в определении её массы в меньшей мере сказывались на результатах анализа Весовую форму получают из формы осаждения либо высушиванием, либо прокаливанием осадка до постоянной массы. Условия перевода в гравиметрическую форму зависят от свойств осадка и его стабильности. Высушивание в сушильном шкафу при температуре 100 - 1500С используют для осадков, которые нестехиометрично разлагаются при более высоких температурах. Прокаливанию подвергают осадки, не изменяющие химический состав при температуре прокаливания или образующие при данной температуре вещества постоянного состава, нелетучие и не реагирующие с материалом посуды. Прокаливают осадки в фарфоровых, кварцевых или платиновых тиглях. Размер тигля выбирают в зависимости от объема осадка. Перед использованием тигель тщательно промывают, сушат и прокаливают при температуре прокаливания осадка. Предварительное прокаливание тигля ведут в течение 10–15 мин, вынимают его из печи подогретыми тигельными щипцами и осторожно ставят в эксикатор. После остывания тигля до комнатной температуры его вынимают щипцами из эксикатора и взвешивают на аналитических весах с точностью до 0,0001г. Прокаливают не менее двух раз до постоянной массы. Полученный при фильтровании осадок предварительно высушивают вместе с фильтром в сушильном шкафу при температуре около 1000С. Затем осторожно вынимают фильтр из воронки, сворачивают, как показано на рис.2, и кладут в тигель. 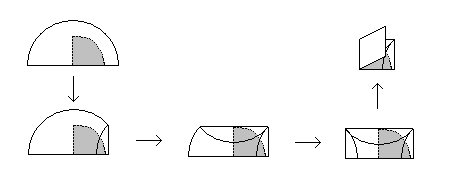 Рис.2 Свертывание фильтра с осадком Тигель осторожно озоляютна электрической плитке или в пламени газовой горелки, следя за тем, чтобы фильтр не воспламенялся. По окончании озоления тигель с осадком прокаливают в муфельной печи при требуемой температуре около 1 часа, охлаждают в эксикаторе и взвешивают с точностью до 0,0001г. Прокаливание и взвешивание повторяют до постоянной массы. 3.5 Расчет результатов анализаПолученную весовую форму взвешивают на аналитических весах и далее проводят расчеты. Достоверность вычисленного результата должна соответствовать наименьшей достоверности измеренных величин, которая при расчете результатов анализа, как правило, соответствует точности четырех значащих цифр. Расчет результатов анализа без учета влажности анализируемого образца. Расчет массы определяемого вещества m(B) и его массовой доли в анализируемом образце ω(В) проводят по схеме проведения гравиметрического анализа по методу осаждения, используя для расчета точно измеренную массу весовой формы m(C): 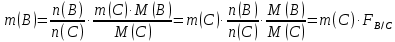 (3.5.1) 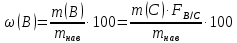  (3.5.2) где: FB/C – гравиметрический фактор пересчета; mнав – масса навески анализируемого вещества, г/мл   (3.5.4) (3.5.3) При проведении анализа методом аликвотных частей в формулы (3.5.1) и (3.5.2) следует ввести множитель, учитывающий объём используемых мерной колбы (Vк) и пипетки (Vп): 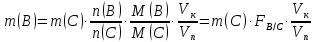 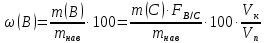  (3.5.5) Расчет результатов анализа с учетом влажности анализируемого образца. Во влажном или воздушно-сухом состоянии в веществе присутствует внешняя (гигроскопическая) влага. Удаляя эту влагу высушиванием при 100‒120°С получают сухое (абсолютно сухое) вещество. Внешняя влага обуславливает влажность образца ω(Н2О) (в %), которая рассчитывается по формуле: 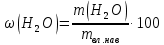 где: m(Н2О) – масса внешней влаги в образце, г mвл.нав – масса навески влажного образца, г  (3.5.6) Различают также кристаллизационную (кристаллогидратную) воду, которая входит в состав химических соединений и удаляется при более высоких температурах, например, H2С2O4·2H2О, MgSO4·7H2O. Вещество, содержащее кристаллизационную воду и не имеющее внешней влаги, является сухим веществом. Содержание (массовая доля) определяемого компонента во влажном образце ωвл (В) рассчитывается по известной формуле: 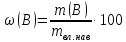  (3.5.7) Для вычисления содержания компонента в сухом веществе ωсух(В) его массу относят к массе навески сухой пробы. Тогда с учетом (3.5.5) и (3.5.6): 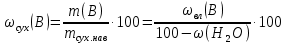 ЗаключениеВ данной работе были рассмотрены основные теоретические вопросы гравиметрического анализа. Подводя итоги, можно сказать, что данный вид анализа является очень точным, хоть и трудоемким. Наиболее распространенный метод анализа – метод осаждения. В данном методе навеску вещества растворяют в растворителе и осаждают определяемый элемент реактивом в виде малорастворимого соединения. Данный метод состоит из нескольких этапов: расчет навески анализируемого образца и перевод её в раствор, перевод определяемого вещества в форму осаждения (осаждение), отделение осадка от раствора (фильтрование) и удаление примесей (промывание), перевод формы осаждения в весовую (гравиметрическую) форму, взвешивание весовой формы на аналитических весах и расчет результатов анализа. Каждый этап был подробно описан. Были выведены основные формулы для расчета массы навески, гравиметрического фактора, объема раствора и массовой доли. Список литературыВасильев В.П, Аналитическая химия. В 2ч. Ч.1. Гравиметрический и титриметрический методы анализа: Учеб. для вузов. – М.: Высшая шк., 1989. – 320с. Васюкова, А. Т. Аналитическая химия : учебник для бакалавров / А. Т. Васюкова, М. Д. Веденяпина. — Москва : Дашков и К, 2019. — 156 c. Илларионова Е. А., Гончикова Ю.А., Сыроватский И.П. Гравиметия: учебное издание. - Иркутск : ИГМУ, 2022. - 55 с. Гравиметрические методы анализа // URL: https://lib.nsu.ru/xmlui/bitstream/handle/nsu/15273/%D0%9B%D0%B5%D0%BA%D1%86%D0%B8%D1%8F%2020.%20%D0%93%D1%80%D0%B0%D0%B2%D0%B8%D0%BC%D0%B5%D1%82%D1%80%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5%20%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%D1%8B%20%D0%B0%D0%BD%D0%B0%D0%BB%D0%B8%D0%B7%D0%B0.pdf?sequence=50&isAllowed=y Харитонов, Ю. Я. Аналитическая химия. Аналитика. В 2-х кн. / Ю. Я. Харитонов – Москва: Высшая школа, 2008. Кн.1. – 615 с. Текст : непосредственный. |
