водород и его сединения. реферат водород и его сединения. Реферат по дисциплине Химия По теме Водород и его соединения
 Скачать 34.67 Kb. Скачать 34.67 Kb.
|
|
Реферат по дисциплине: «Химия» По теме: «Водород и его соединения» Исполнитель: Тетеря Наталья Валерьевна Возжаевка 2019 год  Содержание:………………………………………………………. 2 Введение…………………………………………………… 3-4 Строение атома и положение в периодической системе.. 5-8 Свойства водорода…………………………………………. 6- Соединения водорода………………………………………8-12 Заключение……………………………………………………...13 Список используемых источников…………………………….13 Введение. В самом конце XVIII и в начале XIХ века химия вступила в период установления количественных закономерностей: в 1803 году был сформулирован закон кратных отношений (вещества реагируют между собой в весовых отношениях, кратных химическим эквивалентам), а в 1814 году опубликована первая в истории химической науки таблица относительных атомных весов элементов. В этой таблице на первом месте оказался водород, а атомные массы других элементов выражались числами, близкими к целым. Особое положение, которое с самого начала занял водород, не могло не привлечь внимания ученых, и в 1841 году химики смогли ознакомиться с теорией Уильяма Праута, развившего теорию Древнегреческих философов о единстве мира и предположившего, что все элементы образованы из водорода как из самого легкого элемента. Прауту возражал Й.Я. Берцелиус, как раз занимавшийся уточнением атомных весов: из его опытов следовало, что атомные веса элементов не находятся в целочисленных отношениях к атомному весу водорода. Но, возражали сторонники Праута, атомные веса определены еще недостаточно точно и в качестве примера ссылались на эксперименты Жана Стаса, который в 1840 году исправил атомный вес углерода с 11,26 (эта величина была установлена Берцелиусом) на 12,0. И все же привлекательную гипотезу Праута пришлось на время оставить: вскоре тот же Стас тщательными и не подлежащими сомнению исследованиями установил, что, например, атомный вес хлора равен 35,45, т. е. никак не может быть выражен числом, кратным атомному весу водорода... Но вот в 1869 году Дмитрий Иванович Менделеев создал свою периодическую классификацию элементов, положив в ее основу атомные веса элементов как их наиболее фундаментальную характеристику. И на первом месте в системе элементов, естественно, оказался водород. С открытием периодического закона стадо ясно, что химические элементы образуют единый ряд, построение которого подчиняется какой-то внутренней закономерности. И это не могло вновь не вызвать к жизни гипотезу Праута, — правда, в несколько измененной форме: в 1888 году Уильям Крукс предположил, что все элементы, в том числе и водород, образованы путем уплотнения некоторой первичной материи, названной им протилом. А так как протил, рассуждал Крукс, по-видимому, имеет очень малый атомный вес, то отсюда понятно и возникновение дробных атомных весов. Но вот что любопытно. Самого Менделеева необычайно занимал вопрос: а почему периодическая система должна начинаться именно с водорода? Что мешает существованию элементов с атомным весом, меньше единицы? И в качестве такого элемента в 1905 году Менделеев называет... «мировой эфир». Более того, он помещает его в нулевую группу над гелием и рассчитывает его атомный вес — 0,000001! Инертный газ со столь малым атомным весом должен быть по мнению Менделеева, всепроникающим, а его упругие колебания могли бы объяснить световые явления... Увы, этому предвидению великого ученого не было суждено сбыться. Но Менделеев был прав в том отношении, что элементы не построены из тождественных частиц: мы знаем теперь, что они построены из протонов, нейтронов и электронов.[1] Водород играл и продолжает играть в истории научной мысли немалую роль. Поэтому целью данной работы является установление аналогии водорода с другими элементами, определение его места в ПС, изучение его свойств и соединений. Строение атома водорода и его положение в Периодической системе Д.И. Менделеева. По сравнению с другими элементами водород имеет наиболее простое строение. Но простота электронной структуры атома не означает, что его физические и химические свойства наиболее просты. Наоборот, они удивительным образом отличаются от свойств всех других элементов. Атом водорода состоит из ядра, представляющего собой один протон. А также из одного электрона, который находится на окружающей ядро 1s- орбитали. Такая структура обуславливает уникальные свойства водорода. Во-первых, атом лишь валентную электронную оболочку и её единственный электрон не экранирован от действия заряда ядра внутренними электронами. Во-вторых, валентной оболочке достаточно приобрести или отдать лишь один электрон, чтобы достичь устойчивой электронной конфигурации. В-третьих, атом водорода имеет очень малые размеры – его ковалентный радиус (0,03нм) имеет минимальное значение среди всех элементов. Перечисленные особенности объясняют многие свойства водорода и его особое положение в Периодической системе. Водород занимает первое место в периодической таблице. Но в какую группу он должен быть помещён? В одних случаях водород помещают в подгруппу щелочных металлов, в других – в подгруппу галогенов. Атом водорода имеет единственный валентный электрон, как и все щелочные металлы, и так же как эти металлы, способен превращаться в положительно заряженный ион, отдавая электрон: Н0 – 1е- = Н+ Однако сходство реакций водорода, протекающих по этой схеме, с аналогичными превращениями щелочных металлов весьма формальное. Если удаление электрона из атома щелочного металла происходит легко и приводит к образованию устойчивой конфигурации благородного газа, то потеря электрона атомом водорода требует больших затрат энергии, при этом он полностью лишается электронов. В результате образующийся ион Н+ представляет собой протон, размеры которого меньше размеров катионов любых других элементов. Вследствие этого он оказывает громадное поляризующее действие и все соединения водорода, даже с наиболее активными неметаллами, являются веществами с полярной ковалентной связью. Но атомы водорода способны, хоть и с трудом, не только отдавать, но и присоединять электрон, приобретая при этом электронную конфигурацию благородного газа гелия и образуя ион Н- : Н0 + 1е- =Н- В виде таких ионов водород находится, например, в гидридах. Способность водорода вступать в реакцию по этой схеме аналогична способности галогенов присоединять электроны, приобретая при этом конфигурацию благородных газов. По этому свойству его, казалось бы, можно поместить вверху V 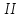 группы вместе с галогенами. Тем более, что по многим своим физическим свойствам водород напоминает галогены. группы вместе с галогенами. Тем более, что по многим своим физическим свойствам водород напоминает галогены. Однако водород не является р-элементом и сопоставление его сродства к электрону со сродством к электрону фтора или хлора убеждает, что свойства водорода заметно отличаются и от свойств элементов V 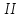 группы. Обратим внимание ещё на одно обманчивое сходство водорода с галогенами; все они при определённых условиях способны существовать в виде двухатомных молекул, однако связь в молекуле Н2 намного прочнее, чем в молекулах Наl2 любого из галогенов. группы. Обратим внимание ещё на одно обманчивое сходство водорода с галогенами; все они при определённых условиях способны существовать в виде двухатомных молекул, однако связь в молекуле Н2 намного прочнее, чем в молекулах Наl2 любого из галогенов.Таким образом, несмотря на некоторое сходство водорода с галогенами и щелочными металлами, формальное отнесение водорода к одной из групп не позволяет правильно предсказать все его свойства по анологии со свойствами других элементов этих групп. Следовательно, правильнее всего рассматривать водород как уникальный элемент, не имеющий полных аналогов. В подтверждение сформулированного выше утверждения приведём ещё два интересных обстоятельства. Первое из них связано с уникальным физическим свойством водорода, отличающим его от всех простых газообразных веществ, - очень высокой «растворимостью» в металлах. Растворимость водорода в металлах объясняется способностью его молекул «диффундировать» через кристаллическую решётку металла вследствие очень малых размеров молекул. Второе обстоятельство касается изотопов водорода. Существует три изотопные формы водорода: протий 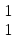 Н, дейтерий Н, дейтерий 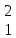 Н, и тритий Н, и тритий 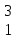 Н. В природном водороде содержится 99,985% изотопов протия, остальные 0, 015% приходятся на долю дейтерия. Тритий представляет собой неустойчивый радиоактивный изотоп и поэтому встречается лишь в виде следов. Н. В природном водороде содержится 99,985% изотопов протия, остальные 0, 015% приходятся на долю дейтерия. Тритий представляет собой неустойчивый радиоактивный изотоп и поэтому встречается лишь в виде следов.Обычно физические и химические свойства изотопов всех элементов, кроме водорода, практически одинаковы: для атомов, ядра которых состоят из нескольких протонов и нейтронов, почти не сказывается разница в один, два нейтрона. Но у водорода снова особенность – ведь ядро атома состоит из одного-единственного протона, и если к нему добавляется нейтрон, масса ядра возрастает вдвое, а если два нейтрона – втрое. Поэтому все изотопы водорода сильно отличаются по своим свойствам. Следует отметить, что для каждого соединения «обычного» водорода существует его дейтериевый аналог.[2] Свойства водорода. Физические свойства - газ без цвета и запаха. Быстрее других газов распространяется в пространстве, проходит через мелкие поры, при высоких температурах сравнительно легко проникает сквозь сталь и другие материалы. Обладает высокой теплопроводностью. Химические свойства. Даже из общего рассмотрения ясно, что в зависимости от обстоятельств водород может проявлять как окислительную, так и восстановительную способность. Из-за малого заряда ядра атом водорода сравнительно слабо притягивает электроны и может присоединять их только в том случае, когда другой элемент легко их отдает. Такими элементами являются щелочные и щелочноземельные металлы, которые при нагревавши в атмосфере водорода образуют солеобразные соединения - гидриды: 2 К+ Н2 = 2КН (гидрид калия) Са + Н2 = СаН2 (гидрид кальция) В обычном состоянии при низких температурах малоактивен, без нагревания реагирует с фтором и хлором (при наличии света) H2 + F2 = 2HF(фтороводород) H2 + Cl2 = 2HCl (хлороводород) С неметаллами взаимодействует активнее, чем с металлами. 2H2 + C = CH4 (метан) С другими неметаллами водород реагирует либо при высокой температуре, либо при высоких - температуре и давлении. Например, с серой водород реагирует только при нагревании, а с азотом - при нагревании и высоком давлении: Н2 + S = Н2S (сероводород) 3 H2 + N2 = 2 NН3 (аммиак) Водород может отнимать кислород или галогены от многих металлов и неметаллов. В этом случае он выступает как восстановитель: СuСl2 + Н2 = Сu + 2НСl Водород не поддерживает горение обычных горючих веществ (являющихся соединениями углерода). Так, зажжённая свеча гаснет в нём. Однако, например, кислород горит в атмосфере водорода. Отсюда видна относительность понятия "поддерживает" или "не поддерживает" горения. Обычно его относят именно к горению соединений углерода. Сам водород горит и в чистом кислороде, и на воздухе, причём продуктом сгорания является вода. При поджигании смеси обоих газов ("гремучего газа") взаимодействие протекает со взрывом. Если вместо поджигания привести эту смесь в соприкосновение с очень малым количеством мелко раздробленной платины (играющей роль катализатора), то реакция протекает быстро, но спокойно. Реакция образования воды из водорода и кислорода сильно экзотермична: 2 Н2 + О2 = 2 Н2О + 573 кДж Помимо прямого соединения с кислородом водород способен отнимать его от оксидов многих элементов: Cu, Pb, Hg и др. В результате из оксида получается свободный элемент, например: СuO + H2 = H2O + Cu + 130 кДж. Однако эти реакции, в которых водород выступает как восстановитель, протекают лишь при нагревании. При высоких давлениях водород вытесняет некоторые металлы также из растворов их солей. Опыт показывает, что химическая активность водорода иногда сильно повышается. Это наблюдается тогда, когда реагирующие с ним вещества находятся в непосредственном контакте с выделяющимся водородом. Повышенная активность такого водорода "в момент выделения» объясняется тем, что реагируют не молекулы Н2, а атомы. Это представление было косвенно подтверждено, когда удалось получить атомарный водород в газообразном состоянии и изучить его реакционную способность. Оказалось, что он значительно активнее молекулярного. Так, атомарный водород уже при обычных условиях соединяется с серой, фосфором, мышьяком и т. д., восстанавливает оксиды многих металлов, вытесняет некоторые металлы (Cu, Pb, Ag и др.) из их солей и вступает в другие химические реакции, на которые при тех же условиях не способен обычный молекулярный водород. При химических взаимодействиях с участием обычного водорода молекула его должна распадаться на атомы. Но сама реакция такого распада (диссоциация на атомы) сильно эндотермична: [3] Н2 + 435 кДж = Н + Н Соединения водорода. Водород является одним из наиболее распространённых элементов - его доля составляет 0,88% от массы всех трёх оболочек земной коры (атмосферы, гидросферы и литосферы), что при пересчёте на атомные проценты даёт цифру 15,5. Основное количество этого элемента находится в связанном состоянии. Так, вода содержит его около 11 вес. %, глина - около 1,5% и т. д. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов. Одним из соединений водорода являются галогеноводороды. Они образуются при соединении водорода с элементами VIIA группы. HF, HCl, HBr и HI представляют собой бесцветные газы, хорошо растворимые в воде. Cl2 + H2O = HClO + HCl; HClO-хлорная вода Так как HBr и HI типичные восстановители, то их нельзя получить по обменной реакции как HCl. CaF2 + H2SO4 = CaSO4 + 2HF Вода - самое распространенное в природе соединение водорода. 2Н2 + О2 = 2Н2О Не имеет ни цвета, ни вкуса, ни запаха. Очень слабый электролит, но активно реагирует со многими металлами и неметаллами, основными и кислотными оксидами. 2Н2О + 2Na = 2NaOH + H2 Н2О + BaO = Ba(OH)2 3 Н2О + P2O5 = 2H3PO4 Тяжелая вода (D2O) – изотопная разновидность воды. Растворимость веществ в тяжелой воде значительно меньше чем в обычной. Тяжелая вода ядовита, так как замедляет биологические процессы в живых организмах. Накапливается в остатке электролиза при многоразовом электролизе воды. Используется как теплоноситель и замедлитель нейтронов в ядерных реакторах. Пероксид водорода Н2О2 – тяжёлая полярная жидкость голубоватого цвета. Пероксид водорода вступает в реакции трёх типов: без изменения пероксидной группировки: Ва(ОН)2 + Н2О2 ВаО2+ 2Н2О в качестве восстановителя: КМnO4 + 5H2O2 + 3H2SO4 = 2Мn SO4 + K2 SO4 + 8 Н2О и, что более характерно, в качестве окислителя: PbS + 4H2O2= PbSО4 + 4Н2О H2O2 + SО2 = Н2 SO4 Кроме того, уже при небольшом нагревании или освещении пероксид водорода легко разлагается 2H2O2 = 2Н2О + О2 Гидриды – образуются при взаимодействии водорода с металлами (при высокой температуре) или менее электроотрицательными чем водород неметаллами. В этих соединениях водород проявляет аналогичную галогенам степень окисления -1. Гидриды щелочных и щелочноземельных металлов получают непосредственным синтезом при 200-6000С в виде белых кристаллических веществ, устойчивых при обычных условиях: 2Na + H2 = 2NaH При взаимодействии гидридов с водой образуется гидроксид металла и выделяется водород [4]. Заключение. Водород не имеет полной аналогии с остальными химическими элементами, и не принадлежит ни к какой группе. Водород – наиболее распространённый элемент в космосе. В природе – третий по химической распространённости элемент, основа гидросферы. Список используемых источников Кузьменко Н.Е., Ерёмин В.В., Попков В.А. Краткий курс химии. Пособие для поступающих в вузы:-М.: Высш. шк., 2000.-415с. [2] Штремпер Г.И. Школьный словарь химических понятий и терминов-М.:Дрофа, 2007.- 416с. [4] http://www.incd.info/getcont-2000-1.html [1] https://www.bestreferat.ru/referat-14213.html [3] |
