2365 Химия кр 1. Решение. 1 Фосфин образуется при нагревании белого фосфора в токе водорода при 300350 С 2Р 3Н 2 2рн 3
 Скачать 152.68 Kb. Скачать 152.68 Kb.
|
|
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения. Укажите условия протекания реакции. Р → РН3 → Р2О5 → Н3РО4 → Са3(РО4)2 → Са(Н2РО4)2 Решение. 1) Фосфин образуется при нагревании белого фосфора в токе водорода при 300-350 °С: 2Р + 3Н2 = 2РН3 2) При горении фосфина образуется фосфорный ангидрид: 2РН3 + 4О2 = Р2О5 + 3Н2О 3) При растворении Р2О5 в воде получается фосфорная кислота: Р2О5 + 3Н2О = 2Н3РО4 4) При взаимодействии Н3РО4 с гидроксидом кальция образуется осадок фосфата каль-ция: 2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2 + 6Н2О 5) При действии на среднюю соль Са3(РО4)2 фосфорной кислоты образуется кислая соль – дигидрофосфат кальция: Са3(РО4)2 + 4Н3РО4 = 3Са(Н2РО4)2 2. Сколько протонов и нейтронов содержит ядро атома 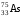 ? Составьте электрон-ную формулу атома мышьяка, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент? ? Составьте электрон-ную формулу атома мышьяка, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент?Решение. Порядковый номер элемента в периодической системе совпадает с величиной заряда ядра, т.е. индекс внизу символа элемента указывает на количество протонов в ядре, следовательно, в ядре атома мышьяка имеется 33 протонов. Число нейтронов равняется разности между массовым числом (индекс вверху символа) и порядковым номером эле-мента, следовательно, в ядре 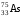 находится 42 нейтрона (75 – 33 = 42). находится 42 нейтрона (75 – 33 = 42).Электронные формулы показывают распределение электронов в атоме по энергетичес-ким уровням и подуровням. Так как число электронов в атоме элемента равно заряду ядра, т.е. его порядковому номеру в таблице Менделеева, то для элемента №33 – мышь-яка электронная формула имеет вид: 33As 1s22s22p63s23p63d104s24p3. В формуле выделе-ны электроны внешнего уровня (4s24p3), которые являются валентными электронами. Распределение электронов атома мышьяка по квантовым ячейкам: 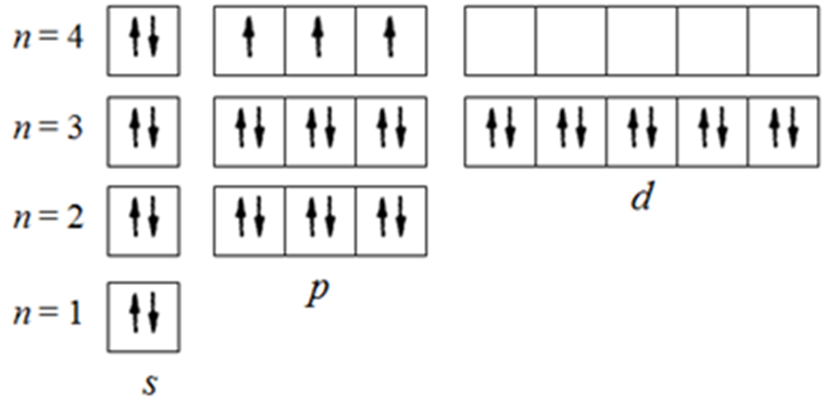 Из электронно-графической схемы атома мышьяка видно, что последний (33-ий) элек-трон занимает р-орбиталь. Следовательно, мышьяк относится к семейству р-элементов. 3. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Ответ мотивируйте строением атома этих элементов. Решение. Низшая степень окисления элементов определяется условным зарядом, который приоб-ретает атом при присоединении электронов, число которых необходимо для образова-ния устойчивой восьмиэлектронной оболочки инертного газа ns2np6, находящегося в том же периоде в таблице Менделеева. Высшая степень окисления элемента определяется условным зарядом, который получа-ет атом при отдаче всех внешних (валентных) электронов, в результате чего образуется устойчивая восьмиэлектронная оболочка инертного газа(n–1)s2(n–1)p6 (или двухэлек-тронная оболочка 1s2 атома гелия), находящегося в предыдущем периоде. Таким образом, высшая степень окисления элемента равна номеру группы в таблице Менделеева, в которой он находится, а низшая степень окисления равна 8 минус номер группы элемента. Углерод, фосфор, сера и йод находятся соответственно в IV, V, VI и VII группах и име-ют структуру внешнего энергетического уровня соответственно s2p2, s2p3, s2p4 и s2p5. Следовательно, высшая степень окисления углерода, фосфора, серы и йода равна соот-ветственно +4, +5, +6 и +7, а низшая степень окисления – соответственно -4, -3, -2 и -1. Формулы соединений элементов, отвечающих высшим степеням окисления: СО2 – ок-сид углерода (IV); Р2O5 – оксид фосфора (V); H2SO4 – серная кислота; HIO4 – йодная кислота. Формулы соединений элементов, отвечающих низшим степеням окисления: СH4 – ме-тан; РH3 – фосфин; К2S – сульфид калия; NaI – йодид натрия. 4. Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2 + O2  2SO3, 2SO3, если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Решение. По закону действующих масс скорость прямой реакции определяется формулой: υпр = kпр∙[SO2]2[O2], а скорость обратной реакции υобр = kобр∙[SO3]2, где kпр и kобр – соответственно константы скорости прямой и обратной реакций. Уменьшение объема газовой смеси в 3 раза равносильно увеличению концентрации компонентов смеси в 3 раза. Тогда скорости прямой и обратной реакций составят: 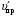 = kпр∙(3[SO2])2∙ (3[O2]) = 27kпр∙[SO2]2[O2] = 27υпр; = kпр∙(3[SO2])2∙ (3[O2]) = 27kпр∙[SO2]2[O2] = 27υпр; 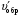 = kобр∙(3[SO3])2 = 9kобр∙[SO3]2 = 9υобр. = kобр∙(3[SO3])2 = 9kобр∙[SO3]2 = 9υобр. Таким образом, скорость прямой реакции увеличится в 27 раз, а скорость обратной реакции – в 9 раз, т.е. равновесие системы сместится в сторону прямой реакции. 5. Как повлияет понижение температуры и давления на равновесие следующих обратимых реакций: N2 + 3H2 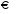 2NH3; 2NH3; 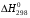 = –92,4 кДж = –92,4 кДж СОСl2 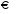 СО + Сl2, СО + Сl2, 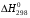 = +112,5 кДж = +112,5 кДжРешение. Направление смещения равновесия реакции определяется по принципу Ле Шателье: если на систему, находящуюся в равновесии, оказано внешнее воздействие (изменены температура, давление и др.), то происходит сдвиг равновесия в том направлении, кото-рое ослабляет эффект этого воздействия. В системе N2 + 3H2 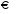 2NH3 прямая реакция – экзотермическая ( 2NH3 прямая реакция – экзотермическая (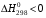 ), поэтому понижение температуры приводит к смещению равновесия в сторону прямой реакции: выделяющаяся в реакции теплота ослабляет воздействие понижения температуры. Прямая реакция ведет к уменьшению общего числа молекул газов (из 4 молекул N2 и H2 образуются 2 молекулы NH3), т.е. ведет к уменьшению давления в системе. Следова-тельно, при понижении давления равновесие сместится в сторону обратной реакции, ведущей к увеличению общего числа молекул газов. ), поэтому понижение температуры приводит к смещению равновесия в сторону прямой реакции: выделяющаяся в реакции теплота ослабляет воздействие понижения температуры. Прямая реакция ведет к уменьшению общего числа молекул газов (из 4 молекул N2 и H2 образуются 2 молекулы NH3), т.е. ведет к уменьшению давления в системе. Следова-тельно, при понижении давления равновесие сместится в сторону обратной реакции, ведущей к увеличению общего числа молекул газов. В системе СОСl2 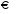 СО + Сl2 прямая реакция – эндотермическая ( СО + Сl2 прямая реакция – эндотермическая (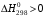 ), поэтому понижение температуры приводит к смещению равновесия в сторону обратной реак-ции, протекающей с выделением теплоты. При понижении давления равновесие смес-тится в сторону обратной реакции, ведущей к увеличению общего числа молекул газов. ), поэтому понижение температуры приводит к смещению равновесия в сторону обратной реак-ции, протекающей с выделением теплоты. При понижении давления равновесие смес-тится в сторону обратной реакции, ведущей к увеличению общего числа молекул газов. 6. Какой объем раствора гидроксида калия (массовая доля КОН 12%, плотность 1,11 г/мл) надо прилить к воде массой 500 г, чтобы получить раствор с массовой долей КОН 5%? Решение. Пусть m0 – требуемая масса исходного раствора КОН. Масса КОН в ней: 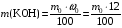 (г) (г) Эта масса КОН содержится и в полученном растворе, масса которого m = m0 + 500 (г), а массовая доля КОН равна ω = 5%: 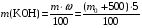 (г) (г) Тогда: 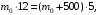 отсюда отсюда 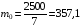 г гОбъем требуемого исходного раствора КОН: 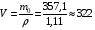 мл млТаким образом, для получения раствора с массовой долей КОН 5% нужно к 500 г воды прибавить 322 мл раствора с массовой долей КОН 12%. 7. Составьте молекулярные и ионные уравнения реакций взаимодействия в раст-ворах между: а) Na3PO4 и СаСl2; б) СН3СОONa и НСl; в) Mg(HCО3)2 и HNO3. Решение. а) Na3PO4 и СаСl2 Молекулярное уравнение реакции ионного обмена – образуется осадок: 2Na3PO4 + 3СаСl2 = Са3(РО4)2↓ + 6NaCl Полное ионное уравнение: 6Na+ + 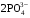 + 3Ca2+ + 6Cl– = Са3(РО4)2↓ + 6Na+ + 6Cl– + 3Ca2+ + 6Cl– = Са3(РО4)2↓ + 6Na+ + 6Cl–Сокращенное ионное уравнение: 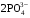 + 3Ca2+ = Са3(РО4)2↓ + 3Ca2+ = Са3(РО4)2↓ б) СН3СОONa и НСl Реакция ионного обмена – образуется слабый электролит – уксусная кислота: СН3СОONa + НСl = СН3СОOН + NaСl СН3СОO– + Na+ + Н+ + Сl– = СН3СОOН + Na+ + Сl– СН3СОO– + Н+ = СН3СОOН в) Mg(HCО3)2 и HNO3 Реакция ионного обмена – образуется слабый электролит – угольная кислота, которая неустойчива и разлагается с выделением углекислого газа: Mg(HCО3)2 + 2HNO3 = Mg(NO3)2 + 2CO2↑ + 2H2O Mg2+ + 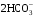 + 2H+ + + 2H+ + 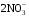 = Mg2+ + = Mg2+ + 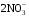 + 2CO2↑ + 2H2O + 2CO2↑ + 2H2O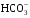 + H+ = CO2↑ + H2O + H+ = CO2↑ + H2O8. Составьте ионные и молекулярные уравнения гидролиза следующих солей: ZnCl2, K2S, Fe2(SO4)3. Какое значение рН (7 < рН > 7) имеют растворы этих солей? Решение. Хлорид цинка ZnCl2 – соль, образованная двухкислотным основанием Zn(OH)2 и силь-ной кислотой HCl. При растворении в воде молекулы ZnCl2 полностью диссоциируют на катионы Zn2+ и анионы Сl–. Катионы Zn2+ связывают ионы ОН– воды, образуя катион основной соли Zn(ОН)+, а не молекулы Zn(ОН)2, так как ионы Zn(ОН)+ диссоциируют гораздо труднее, чем молекулы Zn(ОН)2. Анионы Сl– не могут связывать ионы Н+ воды, так как HCl – сильный электролит. Соль гидролизуется по катиону; в обычных услови-ях гидролиз идет по первой ступени. Сокращенное ионное уравнение: Zn2+ + НОН 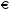 Zn(ОН)+ + Н+ Zn(ОН)+ + Н+Полное ионное уравнение: Zn2+ + 2Сl– + НОН 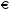 Zn(ОН)+ + Сl– + Н+ Zn(ОН)+ + Сl– + Н+Молекулярное уравнение: ZnCl2 + НОН 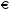 Zn(ОН)Cl + HСl Zn(ОН)Cl + HСlВ результате гидролиза в растворе появляется некоторый избыток катионов Н+, поэто-му раствор ZnCl2 имеет кислую среду (рН < 7). Сульфид калия K2S – соль, образованная сильным основанием КOH и слабой двухос-новной кислотой Н2S. При растворении в воде молекулы K2S полностью диссоциируют на катионы К+ и анионы S2–. Анионы S2– связывают ионы Н+ воды, образуя анион кис-лой соли НS–, а не молекулы Н2S, так как ионы НS– диссоциируют гораздо труднее, чем молекулы Н2S. Катионы К+ не могут связывать ионы ОН– воды, так как КОН – сильный электролит. Соль гидролизуется по аниону; в обычных условиях гидролиз идет по пер- вой ступени. Сокращенное ионное уравнение: S2– + НОН  НS– + ОН– НS– + ОН–Полное ионное уравнение: 2К+ + S2– + НОН  2К+ + НS– + ОН– 2К+ + НS– + ОН–Молекулярное уравнение: K2S + НОН  КНS + КОН КНS + КОНВ результате гидролиза в растворе появляется некоторый избыток анионов ОН–, поэто-му раствор K2S имеет щелочную среду (рН > 7). Сульфат железа (III) Fe2(SO4)3 – соль, образованная слабым трехкислотным основанием Fe(OH)3 и сильной двухосновной кислотой H2SO4. При растворении в воде молекулы Fe2(SO4)3 полностью диссоциируют на катионы Fe3+ и анионы  . Катионы Fe3+ свя-зывают ионы ОН– воды, образуя катион основной соли Fe(ОН)2+, а не катион Fe(ОН)+ или молекулу Fe(ОН)3, так как последние диссоциируют гораздо легче, чем катион Fe(ОН)2+. Соль гидролизуется по катиону; в обычных условиях гидролиз идет по пер-вой ступени. . Катионы Fe3+ свя-зывают ионы ОН– воды, образуя катион основной соли Fe(ОН)2+, а не катион Fe(ОН)+ или молекулу Fe(ОН)3, так как последние диссоциируют гораздо легче, чем катион Fe(ОН)2+. Соль гидролизуется по катиону; в обычных условиях гидролиз идет по пер-вой ступени.Сокращенное ионное уравнение: Fe3+ + НОН  Fe(ОН)2+ + Н+ Fe(ОН)2+ + Н+Полное ионное уравнение: 2Fe3+ +  + 2НОН + 2НОН  2Fe(ОН)2+ + 2Fe(ОН)2+ +  + 2Н+ + 2Н+Молекулярное уравнение: Fe2(SO4)3 + 2НОН 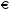 2Fe(OH)SO4 + H2SO4 2Fe(OH)SO4 + H2SO4В результате гидролиза в растворе появляется некоторый избыток катионов Н+, поэто-му раствор Fe2(SO4)3 имеет кислую среду (рН < 7). 9. Реакции выражаются схемами: Fe(OH)2 + O2 + Н2O = Fe(OH)3 Na2S + К2Cr2О7 + H2SO4 = S + Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. Решение. а) Fe(OH)2 + O2 + Н2O = Fe(OH)3 Степени окисления изменяются у железа и кислорода: 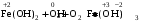 Составляем уравнения электронного баланса: 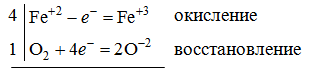 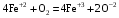 Расставляем коэффициенты в уравнении ОВР: 4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3 O2 – окислитель, восстанавливается; Fe(OH)2 – восстановитель, окисляется. б) Na2S + К2Cr2О7 + H2SO4 = S + Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O Степени окисления изменяются у серы и хрома: 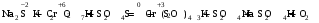 Составляем уравнения электронного баланса: 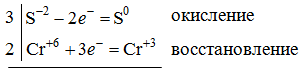 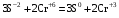 Расставляем коэффициенты в уравнении ОВР: 3Na2S + К2Cr2О7 + 7H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O К2Cr2О7 – окислитель, восстанавливается; Na2S – восстановитель, окисляется. |
