контрольная. _коолоид хим. вар.4. Решение Исходя из количеств атомов углерода и водорода, можно предположить, что вещество толуол С
 Скачать 327 Kb. Скачать 327 Kb.
|
|
4 Вещество с брутто-формулой 7С, 8Н имеет мольную рефракцию 30,95 см3/г-моль. Определить структурную формулу вещества. Решение: Исходя из количеств атомов углерода и водорода, можно предположить, что вещество – толуол (С6Н5СН3) или гексин – 1,3 (или его изомер по положению кратной связи)(СН ≡ С – С ≡ С – СН2 – СН2 – СН3). Рассчитаем мольную рефракцию обоих веществ по правилу аддитивности(значения мольных рефракций компонентов возьмем из справочника). Для толуола: 7 долей углерода 7 ∙ 2,418 = 16,926 8 долей водорода 8 ∙ 1,100 = 8,800 Кольцо 6 – членное 5,199 30,925 Для гексина-1,3 7 долей углерода 7 ∙ 2,418 = 16,926 8 долей водорода 8 ∙ 1,100 = 8,800 Тройная связь 2 ∙ 2,336 = 4,672 30,398 По полученным значениям к значению 30,95 см3/г-моль ближе рассчитанное значение для толуола 30,925 см3/г-моль, следовательно, данное соединение – толуол (С6Н5СН3) 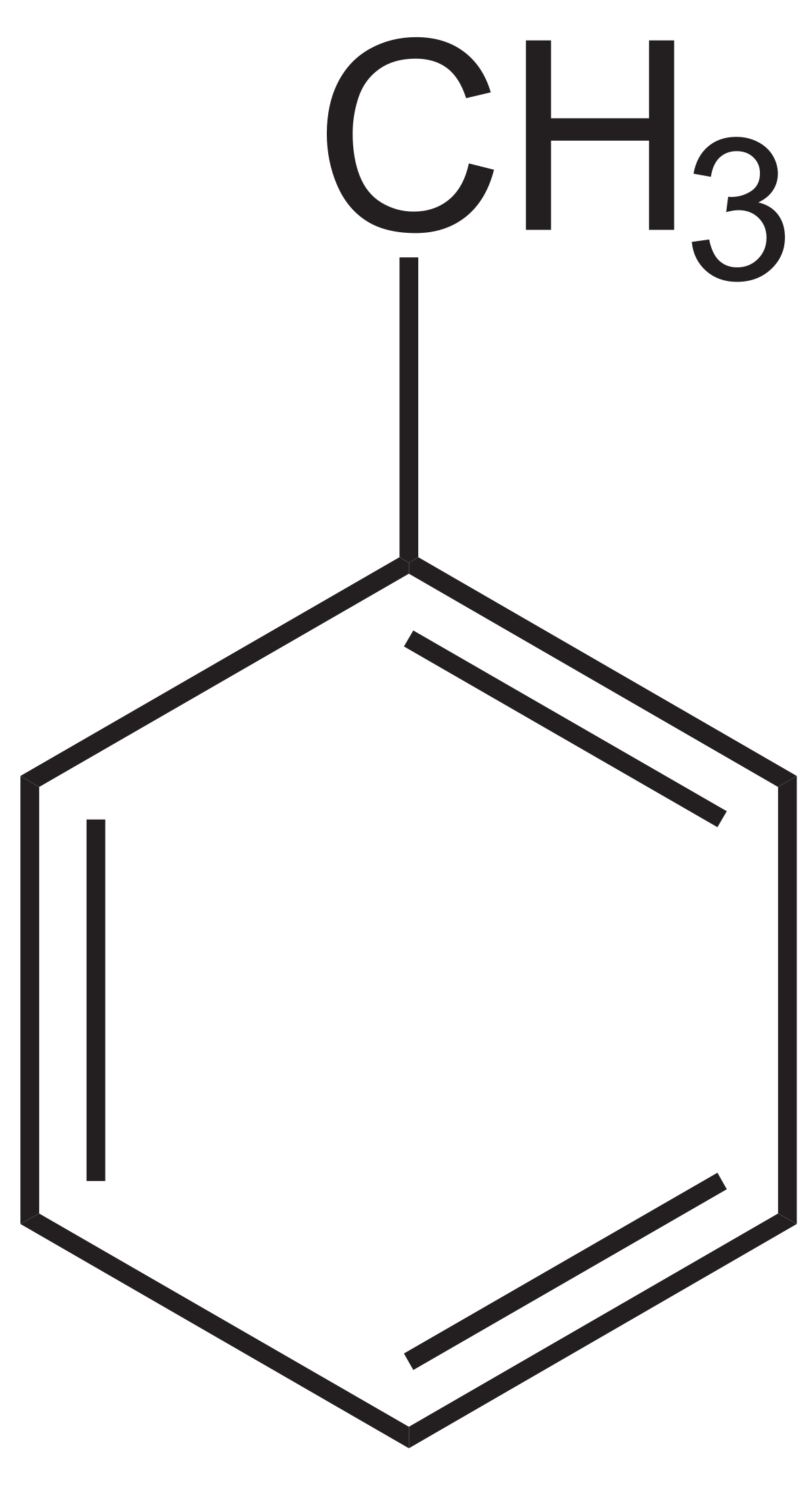 14 Написать уравнение 1 начала термодинамики, показать, какие величины, входящие в него, зависят от пути процесса. Ответ: Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты q, переданной системе, и работой l, совершенной системой над внешними телами. ΔU = q − l или Согласно представлениям М.К.Т. внутренняя кинетическая энергия полностью определяется температурой. Внутренняя потенциальная энергия зависит при данной температуре от удельного объема, которым определяется расстояние между молекулами. Внутренняя энергия в целом является функцией состояния рабочего тела. Внутренняя энергия идеального газа является функцией только температуры. Изменение внутренней энергии в процессе полностью определяется начальным и конечным состояниями рабочего тела и не зависит от характера процесса. Это значит, что величина Если изменение состояния рабочего тела происходит при постоянном V, то внешняя работа не совершается (Δl = 0 ) и согласно I-му закону термодинамики, теплота расходуется только на увеличение внутренней энергии. В этом случае подводимая теплота Отсюда: Абсолютные значения внутренней энергии обычно не нужны в расчетах. Важно знать ее изменение Для наиболее распространенных газов значение внутренней энергии приводится в таблицах.
 Рассмотрим однородное тело имеющее массу При сообщении из вне теплоты Бесконечно малое увеличение объема происходит в результате перемещения каждой точки поверхности тела по нормали на расстояние Поэтому На всю поверхность тела действует сила Таким образом:
Уравнение I закона Для внешней работы: l= Интеграл можно брать тогда, когда известны зависимость p от 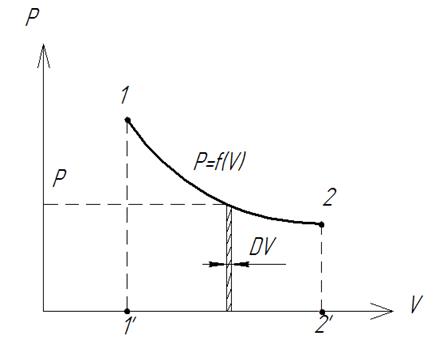 Заштрихованный элемент Если газ расширяется, ( Если газ сжимается под действием внешних сил ( 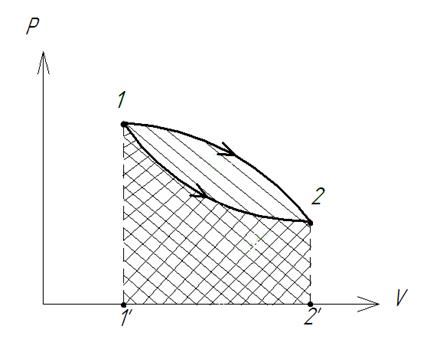 Этот рисунок показывает, что величина работы определяется зависимостью В уравнении I-го закона теплота Покажем это на примере перехода рабочего тела из состояния 1 в состояние 2 тремя путями. 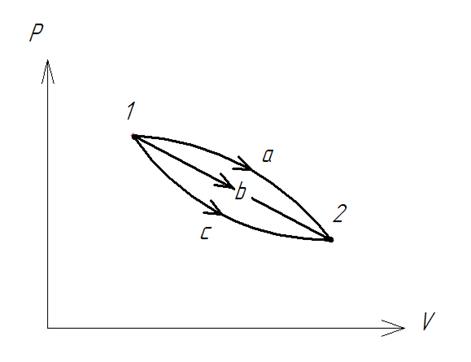 Изменение внутренней энергии Из рисунка видно, что Тогда на основании I закона термодинамики: При подводе теплоты к рабочему телу, 24 Показать, что из 2-го начала термодинамики выводится энтропия, как функция состояния /принцип Каратеодори/. Ответ: Принцип Каратеодори: вблизи каждого равновесного состояния любой термодинамической системы, существуют другие равновесные состояния, недостижимые из первого адиабатическим путем. Пусть у нас есть два близких состояния системы 1 ( Из этого принципа следует, что большинство процессов в термодинамике происходит с теплообменом. Изотермические процессы – единственные обратимые процессы, проходящие с теплообменом (в любом другом процессе температура рабочего тела изменяется и, согласно второму началу термодинамики теплообмен с нагревателем или холодильником не может быть обратимым). 34 Не пользуясь табличными данными, определить знак ΔG и направление следующих реакций: 2KClO3 ↔ 2KCl + 3O2 Δ H < O 7O2 + 2Cl2 ↔ 2Cl2O7 Δ H > O CS2 + 3O2 ↔ CO2 + 2SO2 Δ H < O Ответ: Выражение для энергии Гиббса имеет вид: ΔG = Δ H – Т ∙ ΔS S – энтропия – мера беспорядка системы. Чем более неупорядоченной является система, тем более положительное значение имеет ΔS 2KClO3 ↔ 2KCl + 3O2 Δ H < O, ΔS > 0 (из твердого вещества образуется твердое вещество и газ). Если Δ H < O, ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре 7O2 + 2Cl2 ↔ 2Cl2O7 Δ H > O, ΔS < 0 (из 7 + 2 = 9 моль газов получается 2 моль газа, система более упорядочена). Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях. ΔG > 0 – реакция идет в обратном направлении. CS2 + 3O2 ↔ CO2 + 2SO2 Δ H < O, ΔS < 0 (из 1 + 3 = 4 моль газов получается 3 моль газа, система более упорядочена). Знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми. 44 Типы сложных реакций /с примерами/. Ответ: Сложными называют химические реакции, протекающие более чем в одну стадию. Ниже представлена классификация сложных реакций. Последовательные реакции. Вещества, образующиеся в результате первой стадии этой реакции, являются исходными веществами для другой стадии. Схематически последовательную реакцию можно изобразить следующим образом: Параллельные реакции. Исходные вещества одновременно могут образовывать различные продукты реакции, например два или более изомера, как на рис. 1. 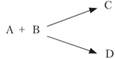 Рис. 1. Образование различных продуктов реакции (например: два или более изомера) Сопряженные реакции. Эти реакции идут по схеме: 1) А + В->С; 2) А + D -> Е. При этом одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой. Вещество А, общее для обеих реакций, носит название актор, вещество В — индуктор, вещество D, взаимодействующее с А только при наличии первой реакции, — акцептор. Например, бензол в водном растворе не окисляется пероксидом водорода, но при добавлении солей Fe(II) происходит превращение его в фенол и дифенил. Механизм реакции следующий. Па первой стадии образуются свободные радикалы: которые реагируют с ионами Fe2+ и бензолом: 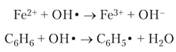 Происходит также рекомбинация радикалов: Таким образом, обе реакции протекают с участием общего промежуточного свободного радикала ОН*. Цепные реакции. Эти реакции состоят из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов. Для всех цепных реакций характерны три типичные стадии, которые мы рассмотрим на примере фотохимической реакции образования хлорида водорода. 1. Зарождение цепи (инициация): 2. Развитие цепи: Стадия развития цепи характеризуется длиной цепи — числом молекул продукта реакции, приходящихся на одну активную частицу. 3. Обрыв цепи (рекомбинация): 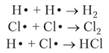 Обрыв цепи возможен также при взаимодействии активных частиц с материалом стенки сосуда, в котором проводится реакция, поэтому скорость цепных реакций может зависеть от материала и даже от формы реакционного сосуда — чем больше отношение площади поверхности сосуда к его объему, тем вероятнее обрывы цепи. Реакция образования хлорида водорода является примером неразветвленной цепной реакции, в которой на одну прореагировавшую активную частицу приходится не более одной вновь возникающей. Разветвленными называют цепные реакции, в которых на каждую прореагировавшую активную частицу приходится более одной вновь возникающей, т.е. число активных частиц в ходе реакции постоянно возрастает. Примером разветвленной цепной реакции является реакция взаимодействия водорода с кислородом. 1. Инициация: 2. Развитие цепи: 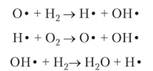 54 Можно ли на 100% разложить в закрытом сосуде NH4Cl, CaCO3? Ответ обосновать. Ответ: Запишем уравнения разложения данных веществ: NH4Cl = NH3 ↑+ НCl↑ CaCO3 = CaО + CO2↑ Если сосуд закрытый, то V = const. Следовательно, изменить концентации веществ невозможно, добавляя или отводя их из зоны реакции. Разложить можно, уменьшая давление в сосуде, а также нагревая сосуд, так как обе реакции эндотермические, идут при поглощении тепла. Тогда равновесие реакций сместится в сторону продуктов. 64 Дать определение следующим способам выражения концентрации: весовая процентная, объемная процентная, молярность, нормальность, моляльность, мольная доля, титр. Ответ: Весовая процентная концентрация растворов показывает число единиц массы растворенного вещества, содержащееся в 100 единицах массы раствора, и для его приготовления следует взять 12 единиц массы СаСl2 и 88 единиц массы растворителя. Молярная концентрация раствора (молярность) – отношение количества этого вещества, содержащегося в растворе (в молях), к объему раствора: где m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль; V – объем раствора, л. Молярным называется раствор, в 1л которого содержится 1 моль растворенного вещества. Эквивалентная (нормальная) концентрация раствора (нормальность) – отношение числа эквивалентов вещества, содержащегося в растворе, к объему раствора: где m – масса растворенного вещества; Мэкв – молярная масса эквивалента растворенного вещества. Моляльная концентрация раствора (моляльность) определяется числом молей растворенного вещества в 1кг (1000г) растворителя. Единица моляльности раствора в СИ – моль/кг. Основная особенность моляльного способа выражения концентрации заключается в том, что моляльная концентрация раствора не зависит от температуры, поскольку для определения моляльности не привлекается объем. Массовой долей растворенного вещества называют отношение массы растворенного вещества к общей массе раствора. Массовую долю обычно выражают в долях единицы и обозначают W. Мольная доля – отношение числа молей данного вещества в растворе к общему числу молей веществ, образующих раствор. Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл: Т(х) = m(х)/V, 74 Определить температуру кипения 10% водного раствора глюкозы C6H12O6. Решение: По закону Рауля повышение температуры кипения раствора (Δt) по сравнению с температурой кипения растворителя выражается уравнением: Δt = K·Cm(А), (1) где К –эбуллиоскопическая константа; для воды она равна 0,520; Сm(А) – моляльная концентрация растворенного вещества А, которая рассчитывается по формуле: Cm = 100/(180∙0,9) = 0,617 моль/кг Из формулы (1) повышение температуры кипения 10 %-ного раствора С6Н12О6 равно Δt = 0,52 ∙ 0,617 = 0,32 Вода кипит при 100оС, следовательно, температура кипения этого раствора Ткип = 100 + 0,32 = 100,32 оС 84. Закон разбавления Оствальда. Ответ: Рассмотрим электролит, молекулы которого XY распадаются в растворе на два иона – катион и анион. Фактически, степень диссоциации α представляет собой долю распавшихся молекул. Если общую концентрацию электролита (С) умножить на эту долю, то получим концентрацию любого из ионов. Иными словами, αС = [X+] моль/л, и αC = [Y–] моль/л. Если электролит сильный (α = 1), концентрация каждого из ионов просто равна исходной концентрации электролита. Допустим, имеется раствор циановодорода HCN (синильной кислоты) с концентрацией С моль/л. В растворе циановодород слабо диссоциирует на ионы: HCN В выражении для степени диссоциации α величина n0 отражает количество молекул (или молей) HCN, изначально попавших в раствор. Иными словами, n0 = C моль/л. n1 – это число молекул (или молей) HCN, распавшихся на ионы. Следовательно, n1 = [H+] и n1 = [CN–]. В этом случае: 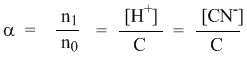 Отсюда следует, что [H+] = Cα, [CN–] = Cα. Если теперь записать выражение для константы диссоциации HCN, то можно выразить Кд через Сα: 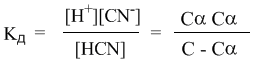 Концентрация недиссоциированных молекул [HCN] в равновесии должна быть меньше исходной концентрации С как раз на величину Сα – отсюда выражение (С – Сα) в знаменателе дроби. Если вынести концентрацию С за скобки и сократить, то получим следующее выражение: 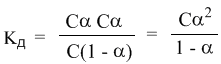 Или, в другой записи: 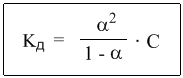 Это не что иное, как математическая формулировка закона разбавления Оствальда. Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности. Однако в случае слабых электролитов величина (1 – α) очень мало отличается от единицы. Действительно, если α = 0,01, то (1 – 0,01) = 0,99, т.е. практически 1. Таким образом, для слабых электролитов закон разбавления Оствальда можно записать в более простом виде: 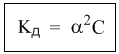 Константа диссоциации, как и любая константа равновесия, при данной температуре постоянна. Поэтому, если уменьшается концентрация вещества (раствор разбавляют), то для сохранения постоянства константы диссоциации должна возрастать величина α. Посмотрите опыт из Единой коллекции цифровых образовательных ресурсов: при разбавлении концентрированной уксусной кислоты раствор начинает слабо проводить ток (лампочка слегка накаляется). Это означает, что при разбавлении возрастает степень диссоциации слабого электролита. Наоборот, чем концентрирование раствор, тем меньше степень диссоциации α. 94. Строение мицелл коллоидных растворов. Ответ: Основной структурной единицей коллоидного раствора является мицелла. Причем частицы дисперсной фазы обладают сложной структурой, зависящей от условий получения золей и природы стабилизатора. Рассмотрим строение золя йодида серебра, полученного приливанием раствора нитрата серебра к раствору иодида калия (избыток KI - стабилизатор): AgNO3 + KI → AgI + KNO3 Ядро коллоидной мицеллы в данном случае будет состоять из нейтральных молекул AgI. nAgNO3 → nAg+ + nNO3− Схема строения мицеллы золя иодида серебра имеет вид: 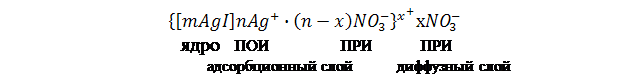 Коллоидная частица золя имеет положительный заряд (x+). Граница скольжения, по которой мицелла разрывается при движении в электрическом поле, лежит между коллоидной частицей и диффузным слоем. 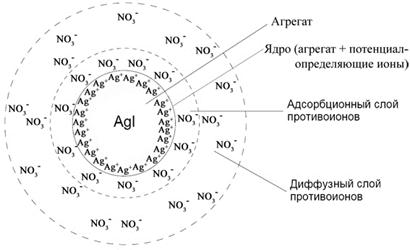 Рис. 1 Схема строения мицеллы золя иодида сере где m – число молекул AgI, образующих кристаллик; n – число потенциалообразующими ионов (как правило, т>n); x – число противоионов диффузного слоя; (n–x) – число противоионов в адсорбированном слое. Число таких ионов калия меньше числа адсорбированных ионов йода (n), вследствие чего коллоидная частица имеет отрицательный заряд (x–). Литература 1. Белик В.В. Физическая и коллоидная химия: учебник / В.В. Белик, К.И. Киенская. – М.: Академия, 2005. – 288 с. 2. Практикум по физической химии: учеб. пособие / под ред. М.И. Гельфмана. – СПб.: Лань, 2004. – 256 с. |
