58 вариант второе исправление. Решение н с о n 1 3 4 7
 Скачать 311.65 Kb. Скачать 311.65 Kb.
|
|
Исправьте замечания в задачах 158,987, 1095. Номер зачетной книжки 391858 № 58. Решение: Н : С : О : N = 1 : 3 : 4 : 7 Обозначим числа атомов водорода, углерода, кислорода и азота в простейшей формуле вещества соответственно через x, y, z. Атомные массы этих элементов равны соответственно 1, 12, 16 14. Поэтому массы водорода, углерода, кислорода и азота в составе вещества относятся как 1х : 12у : 16z :14 . По условию задачи это отношение имеет вид: 1 : 3 : 4 : 7. Следовательно: 1х : 12у : 16z :14 = 1 : 3 : 4 : 7. Тогда Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них: Таким образом, простейшая формула вещества HxCyOzNa будет иметь вид: H4CON4 или COH4N4. Ответ: COH4N4. № 158. Внешний квантовый слой имеет строение 6 s25 d5. Атом находится в 6-м периоде, в VII группе, побочной подгруппе. Этот элемент рений Re. +75Re ) ) ) ) ) ) электроннаяформула 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 2 8 18 32 13 2 4 d10 4f14 5s2 5p6 5d56s2                         графическая графическая      формула формула1s 2s 2p 3s 3p                            3d 4s 4р                                  4 f5s5р              5d6s В стационарном состоянии атом имеет 5 неспаренных электронов. Какая при этом Валентность атома при этом валентность рения переменная. В 1 – м возбужденном состоянии:                         графическая графическая      формула формула1s 2s 2p 3s 3p                            3d 4s 4р                                  4 f 5s 5р                 5d6s 6 р № 458. Запишем уравнение реакции а): С6Н12О6(к) = 2 С2Н5ОН(ж) + 2 СО2(г) Согласно следствию из закона Гесса: 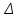 Нх.р. = [2 · (- 234.8) + 2· (- 393.5)] – (- 1273) = + 16.4 кДж. Нх.р. = [2 · (- 234.8) + 2· (- 393.5)] – (- 1273) = + 16.4 кДж.Изменение энтропии в ходе химической реакции: 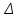 S = ∑ S298прод. - ∑ S298исх.в-в S = ∑ S298прод. - ∑ S298исх.в-в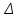 S = (2 · 213.6 + 2 · 160.67) = 748.54Дж/К S = (2 · 213.6 + 2 · 160.67) = 748.54Дж/КЭнергию Гиббса определим по уравнению: При Т = 298 К ΔG = ΔH – TΔS = 16400 – 298 ·748,54 = - 206,66кДж/ моль Запишем уравнение реакции б): С6Н12О6(к) + 6 О2 = 6 Н2О(ж) + 6 СО2(г) Согласно следствию из закона Гесса: 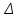 Нх.р. = [6 · (- 285.8) + 6 · (- 393.5)] – (- 1273) = - 2802.8 кДж. Нх.р. = [6 · (- 285.8) + 6 · (- 393.5)] – (- 1273) = - 2802.8 кДж.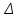 S = (6 · 213.6 + 6 · 70.1) – 6 · 205.03 = 51.42 Дж/К. S = (6 · 213.6 + 6 · 70.1) – 6 · 205.03 = 51.42 Дж/К.Энергию Гиббса определим по уравнению: При Т = 298 К ΔG = ΔH – TΔS = - 2802800 – 298 ·51,42 = - 2818,12кДж/ моль Ответ: более вероятная реакция Б). № 608. 2 NO + O2 => 2 NO2 2 V + 1 V > 2 V Запишем выражение константы равновесия: Кр = [NO2]2/ [NO]2· [O2] 𝞓H = - 117 кДж, реакция экзотермическая, теплота выделяется. При понижении температуры равновесие реакции сместится в сторону продуктов реакции, т.к. ΔH < 0. Реакция идет с уменьшением объемов. При увеличении давления равновесие реакции смещается в сторону ее продуктов, реакция протекает с уменьшением объемов. При уменьшении температуры константа равновесия увеличивается. 3 Fe2O3 + CO => CO2 + 2 Fe3O4 Кравн = [СО2]/ [СО] 0V + 1V=1V + 0V 1V=1V а) При повышении температуры равновесие реакции сместится в сторону исходных веществ, т.к. ΔH < 0. б) При понижении давления равновесие реакции не смещается, реакция протекает без изменения объемов. Константа равновесия при повышении температуры уменьшается. CaCO3 (т) = CaO (т) + CO2(г) 0 V<0V+ 1 V Запишем выражение константы равновесия: Кр = [CO2]  𝞓H = + 177.65кДж, реакция эндотермическая, теплота поглощается. Повышение температуры смещает равновесие реакции в сторону продуктов реакции 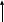  Реакция идет с увеличением объемов. Повышение давления смещает равновесие реакции в сторону исходных веществ 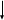 При Т Кр № 708. Решение: СН3ОН По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆t) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением: где К – криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,520; Сm(А) – моляльная концентрация растворенного вещества А, моль/кг. М(СН3ОН) = 32 г/моль. Масса растворителя составит: m = V · ρ = 150 г Понижение температуры кристаллизации раствора СН3ОН находим расчетом: Δt = K · m1 · 1000/m2 · M = 1.86 · 80 · 1000 /150 · 32 = 31; вода кристаллизуется при 00С, следовательно, температура кристаллизации раствора № 732. Ответы на вопросы. Электролитическая диссоциация – распад молекул электролита на положительно и отрицательно заряженные ионы – катионы и анионы. Электролиты – вещества, водные растворы которых обладают ионной проводимостью. Неэлектролиты – вещества, водные растворы которых не обладают ионной проводимостью. Константа диссоциации – количественная характеристика процесса диссоциации, которая определяется как отношение произведений концентраций ионов, образующихся при диссоциации, к концентрации исходных частиц. Степень диссоциации ( 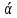 ) – отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул: α = n/N ) – отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул: α = n/NПо закону разбавления Оствальда: α = [Кд/C]1/2, Kд = С*α2. Ионное произведение воды Кw – произведение концентраций ионов водорода и ионов гидроксила. Кw = [H+][OH-] Водородный показатель рН – отрицательный десятичный логарифм концентрации водородных ионов: рН = - lg [H+] Константа гидролиза – количественная характеристика процесса гидролиза. Степень гидролиза - количественная характеристика процесса гидролиза, показывающая долю гидролизованных ионов. C = ? Решение: ɑ = 1.0 1. Соляная кислота – сильный электролит:  С(HCl) = 0.05 HClH++ Cl- С (Н+) = ɑ · С (HCl) = 1 · 0.05 = 0.05 моль/л, рН = - lg [H+] = - lg(0.05) = 1.3, pH , 7, среда кислая. [OH-] = 10-14/ [H+] = 10-14/ 0,05 = 2.0 · 10-13 моль/л. № 790. Ответы на вопросы. Реакции ионного обмена протекают до конца, если: - образуется осадок; - образуется газ; - образуется малодиссоциирующее вещество – вода. Если в растворе нет таких ионов, которые могут взаимодействовать между собой с образованием осадка, газа или слабого электролита, реакция ионного обмена не протекает до конца, т.е. является обратимой. При написании ионно-молекулярных уравнений следует пользоваться таблицей растворимости солей, кислот и оснований в воде. Реакции ионного обмена записывают в трех формах: - в молекулярном виде; - полное ионное уравнение; - сокращенное ионное уравнение. А) NH4NO3 – нитрат аммония. Соль образована сильной кислотой и слабым основанием, гидролиз по катиону, в 1 ступень. рН < 7, среда кислая. NH4NO3 = NH4+ + NO3- NH4+ + HOH = NH4OH + H+ NH4NO3 + H2O => NH4OH + HNO3 B) ZnS + 2 HCl => ZnCl2 + H2S ZnS + 2 Cl- + 2 H+ => Zn2+ + 2 Cl- + H2S ZnS + 2 H+ => Zn2+ + H2S C) Cr2S3 – сульфид хрома. Соль образована слабым основание и слабой кислотой. Гидролиз идет одновременно по катиону и аниону: Cr2S3 = 3 S2- + 2 Cr+3 3S2- + 2 Cr+3 + 6 HOH = 3H2S + 2 Cr(ОН)3 Cr2S3+ 6 H2O = 3H2S + 2 Cr(ОН)3 D) 2AlCl3 + 3Ba(OH)2 => 3BaCl2 + 2Al(OH)3 2 Al3+ + 6 Cl- + 3 Ba2+ + 6 OH- => 3 Ba2+ + 6 Cl- + 2 Al(OH)3 2 Al3+ + 6 OH- => 2 Al(OH)3 № 987. A) KBrO3 + 2Al + 2KOH => KBr + 2KAlO2+ H2O  BrO3- + 6e + 3 Н2О = Br- + 6 ОН-процесс восстановления окислитель 2 Al - 3 e + 4 OH- = AlO2- + 2 H2O процесс окисления  восстановитель 2Al + BrO3- + 8OH-+ 3 Н2О = Br- + 4H2O + 2AlO2- + 6 OH- Определим константу равновесия реакции по формуле: Кравн = 10ΔЕ * n/0.059, где ΔЕ = Е окисл – Евосст = 1.51 – ( - 2.35) = 0.84 В; Реакция возможна, идет в прямом направлении. B) 2FeCl3 + 2KBr =>Br2 + 2FeCl2 + 2KCl  2Fe+3 + 1e = Fe2+процесс восстановления окислитель 2 Br- - 2e = Br2 процесс окисления  восстановитель 2 Fe3++ 2Br- = 2 Fe+2 + Br2 Определим константу равновесия реакции по формуле: Кравн = 10ΔЕ * n/0.059, где ΔЕ = Е окисл – Евосст = 0.77 – ( - 1.09) = 1.86 В; n = n1 * n2 = 2 * 1 = 2 – количество электронов, участвующих в окислительно-восстановительном процессе. Тогда: Кравн = 101.86 *2/ 0.059 = 1063, Кравн > 1. Реакция возможна, идет в прямом направлении. № 1072.  Решение: Решение:С (Cr(NO3)3) = 0.1 моль/л 1. Запишем значения стандартных окислитель – C (AgNO3) = 1.00 моль/л но - восстановительных потенциалов: ЭДС = ? Е0(Cr3+/Cr) = - 0.71 B, Е0(Ag+/Ag) = 0.80 B анод катод 2. На аноде протекает реакция окисления: Cr0 – 3e = Cr+3, На катоде протекает реакция восстановления: Ag+ + 1e = Ag0, По уравнению Нернста: E = E0 + 0.059/n * lg [Men+], Екатод= 0.80 + 0.059/1 * lg (1.0) = 0.80 В. Еанод = - 0.71+ 0.059/3 * lg (0.1) = - 0.73 В. Определим ЭДС системы: ЭДС = Екатод - Еанод = 0.80 – (- 0.73) = 1.53 В.  ЭДС > 0, реакция Cr – 3e = Cr3+, Ag+ + 1e = Ag0  Cr + 3 Ag+ = 3 Ag0 + Cr3+ протекает самопроизвольно, и ячейка (-) Cr/ Cr3+ // Ag+ / Ag (+) является гальваническим элементом. Ответ: ЭДС = 1.53 В. № 1095. Расплав Al2O3 На графитовых (инертных) электродах протекает процесс: 2Al2O3 (расплав) = 4 Al + 3O2 Катодный процесс Al3+ + 3 e = Al (· 4) Анодный процесс: где он 2 O2- - 4 e = О2 (· 3) Суммарная реакция: 4 Al3+ + 6 О2- = 4Al + 3 О2 По закону Фарадея: m (Al) = M (Al) * I * t/ n* F, F = 96500 Кл/моль (постоянная Фарадея), M (Al) = 27 г/моль, n – количество принимаемых электронов, n = 3, t – время электролиза, I – сила тока. m (Al) = 27 * 1 * 6 * 3600 / 3 * 96500 = 2.014 г – масса алюминия, выделившегося на катоде. m (О2) = M (О2) * I * t/ n* F, F = 96500 Кл/моль (постоянная Фарадея), M (О2) = 32 г/моль, n – количество принимаемых электронов, n = 2, t – время электролиза, I – сила тока. m (О2) = 32 * 1 * 6 * 3600 / 2 * 96500 = 3,581 г – масса кислорода, выделившегося на аноде. Список использованной литературы 1. Ахметов Н.С. Общая и неорганическая химия.- М., 2003. 2. Глинка Н.Л. Общая химия. - М.: Химия, 1998. 3. Ерохин Ю.М. Химия: учеб. для студ. учреждений сред. проф. образования / Ю.М. Ерохин.- М.: Академия, 2011. 4. Коржуков Н.Г. Общая и неорганическая химия. - М., 2004. 5. Коровин Н.В. Общая химия. - М.: Высш. шк., 2007. |
