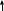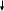Химия. Зачетная работа 1 семестр. Химия. Решение n4 Главное квантовое число. Последний электрон находится на 4 уровне
 Скачать 55.61 Kb. Скачать 55.61 Kb.
|
|
Зачетная работа 1 семестр По значениям квантовых чисел “последнего” электрона электронной формулы (n=4, l=1, ml = 0, ms= -1/2) определить положение данного элемента в периодической системе. Привести электронно-графическую формулу валентного слоя этого элемента, показать с помощью этой формулы возможные состояния возмущения данного атома, его ионы. Привести формулы оксидов и гидратных соединений. Решение: n=4 – Главное квантовое число. Последний электрон находится на 4 уровне. 1=1 – Побочное (орбитальное) квантовое число. n = 4, l=1, последний электрон на 4p – подуровне. ml = 0 – Магнитное квантовое число. Вторая из трех орбиталей. ms= -1/2 Магнитное спиновое квантовое число. Электронное облако последнего электрона вращается против часовой стрелки. Квантовым числам n = 4, l = 1, ml = 0, ms =-1/2 последнего по порядку заполнения электрона атома, соответствует атом Брома +35Br. Электронная формула: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 Валентный слой:
Состояния возмущения:
Ионы: Br 1+
Br 3+
Br 5+
Br 7+
Br 1-
Оксиды брома: Br2O – оксид брома (I) BrO2 – оксид брома (IV) BrO3 – оксид брома (VI) Гидратные соединения: HBrO – бромноватистая кислота Br2 + H2O ↔ HBrO HBrO3- бромноватая кислота (устойчива только в растворах, макс концент.50%) Br2 + 5Cl2 + 6H2O = 2HBrO3 + 10HCl HBrO4 – бромная кислота (существует только в растворе, макс концент. 83%) HBrO3 + XeF2 + H2O = HBrO4 + 2HF + Xe Вычислить начальную скорость реакции С2Н2 (г) + 2 Н2 (г) = С2Н6 (г) и скорость через некоторое время, если начальные концентрации исходных веществ были равны: [С2Н2]0 = 1,5 моль/л; [Н2]0 = 5 моль/л, а к указанному моменту прореагировало 80 % ацетилена. Константа скорости реакции равна 2,15 . 10-2. Начальная скорость реакции: u = k × [C2H2] ×[H2]2 u = 2.15 ×10-2 × 1.5 × 52 u = 0.80625 = 8,0625 × 10-1 моль/л . с Концентрация C2H2 – 20% 1.5 × 0.2 = 0.3 моль/л Концентрация уменьшилась на: 1.5 – 0.3 = 1.2 моль/л Концентрация вещества H2 (к указанному моменту): С2H2 : 2H2 = 1:2 1.2 × 2 = 2.4 5 - 2.4 = 2.6 моль/л Скорость к указанному моменту: u = 2.15 ×10-2 × 0.3 × 2.62 u = 0,043602 = 4,3602 × 10-2 моль/л . с Вычислить константу равновесия реакции 3 Fe + 4 H2O (г) ↔ Fe3O4 + 4 Н2 (г) - Q если начальная концентрация воды была [H2O]о = 2,5 моль/л, а к моменту достижения равновесия концентрация водорода в реакционной смеси составляла [Н2] равн. = 1,8 моль/л. Как сместится равновесие этой реакции, если а) повысить давление в системе; б) повысить температуру; в) применить катализатор; г) добавить дополнительное количество водорода? Рассчитать pH раствора, в 6 л которого содержится 5,13 г Ba(OH)2 (α=100%). |