Термодинамика. Заказ 2622. Решение Порядковый номер 14 имеет атом кремния, его строение атома в виде электронной формулы имеет следующий вид
 Скачать 80.14 Kb. Скачать 80.14 Kb.
|
|
16. Напишите электронные конфигурации атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d-орбиталей содержится на предвнешнем уровне последнего элемента? Решение: Порядковый номер 14 имеет атом кремния, его строение атома в виде электронной формулы имеет следующий вид: 14Si 1s 22s 22p 63s 23p2 Порядковый номер 40 имеет атом циркония, его строение атома в виде электронной формулы имеет следующий вид: 40Zr 1s 22s 22p 63s 23p64s 23d104p65s24d2 У атома циркония на предвнешнем уровне содержится свободных три d- орбитали, т.к. на двух d-орбиталях у него находится два электрона по одному на каждой, (для d - максимум 5). 27. Исходя из сокращенных уравнений ядерных реакций напишите их полные уравнения: a)? (α,D) 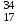 Cl; б) Cl; б)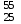 Mn (?, α) Mn (?, α) 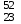 V; в) V; в)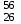 Fe (n, Fe (n,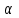 )?. )?.Решение: При сокращённой форме записи ядерной реакции в скобках пишут бомбардирующую частицу, а через запятую – частицу, образующуюся при данном процессе. В сокращённых уравнениях частицы 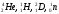 обозначают соответственно α, p, d(D), n. Исходя из сокращённых уравнений ядерных реакций, можно написать полные уравнения ядерных превращений: обозначают соответственно α, p, d(D), n. Исходя из сокращённых уравнений ядерных реакций, можно написать полные уравнения ядерных превращений: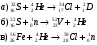 50. Какую низшую и высшую степени окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в высшей степени окисления. Как называются соответствующие соединения? Решение: Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того числа электронов, которое необходимо для образования устойчивой электронной оболочки инертного газа ns2np6 (в случае с водородом ns2). Водород, фтор, сера и азот находятся соответственно в IА-, VIIА-, VIА- и VА- группах периодической системы химических элементов и имеют структуру внешнего энергетического уровня s1, s2p5, s2p4 и s2p3. Таким образом, для завершения внешнего энергетического уровня, атому водорода и атому фтора необходимо присоединить по одному электрону, атому серы – два, атому азота – три. Отсюда низкая степень окисления для водорода, фтора, серы и азота равна соответственно -1, -1, -2 и -3. Формулы соединений кальция с данными элементами в этой степени окисления: CaH2 – гидрид кальция; CaF2 – фторид кальция; CaS – сульфид кальция; Ca3N2 – нитрид кальция. 84. Вычислите, какое количество теплоты выделилось при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Решение: Уравнение реакции: 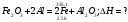 Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим: 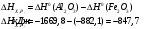 Вычисление количества теплоты, которое выделяется при получении 335,1 г железа, производим из пропорции: (2 .56) : -847,7 = 335,1 : х; х = (0847,7 . 335,1)/ (2 . 56) = 2543,1 кДж, где 56 атомная масса железа. 110. При некоторой температуре равновесие гомогенной системы 2NO + О2 Решение: Уравнение реакции имеет вид: 2NO + О2 Выражение константы равновесия данной реакции имеет вид: 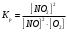 Подставляя в него данные задачи, получим: 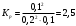 Для нахождения исходных концентраций веществ NO и О2 учтём, что, согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2. Поскольку по условию задачи в каждом литре системы образовалось 0,1 моль NO2, то при этом было израсходовано 0,1 моль СО NO и 0,1/2 = 0,05 моль О2. Таким образом, искомые исходные концентрации равны: [О2]исх = 0,1 + 0,05 = 0,15 моль/л; [NO]исх = 0,2 + 0,1 = 0,3 моль/л. 127. Из сочетания частиц Со3+, NH3, NO-2 и К+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах. Определите, какая комплексная соль кобальта (содержащая в качестве лигандов только NH3,или только NO2-) будет более устойчива. Ответ аргументировать. Дайте названия этим двум солям. Решение: Формулы комплексных соединений: 1. [Со(NH3)6](NO2)3 – нитрит гексаамминкобальта(III); 2. [Со(NH3)5NO2](NO2)2 – нитрит нитропентаамминкобальта(III); 3. [Со(NH3)4(NO2)2]NO2 – нитрит динитротетраамминкобальта(III); 4. [Со(NH3)3(NO2)3] – тринитротриамминкобальта; 5. К[Со(NH3)2(NO2)4] – тетранитротриамминкобальтат(III) калия; 6. К2[СоNH3(NO2)5] - пентанитроамминкобальтат(III) калия; 7. К3[Со(NO2)6] - гексанитрокобальтат(III) калия. Уравнения диссоциации комплексных соединений: 1. [Со(NH3)6](NO2)3 = [Со(NH3)6]3+ + 3NO2; 2. [Со(NH3)5NO2](NO2)2 = [Со(NH3)5NO2]2+ + 2NO2; 3. [Со(NH3)4(NO2)2]NO2 = [Со(NH3)4(NO2)2]+ +NO2; 4. [Со(NH3)3(NO2)3] – неэлектролит, поэтому не диссоциирует; 5. К[Со(NH3)2(NO2)4] = К+ + [Со(NH3)2(NO2)4]; 6. К2[СоNH3(NO2)5] = 2К+ + [СоNH3(NO2)5]2; 7.К3[Со(NO2)6] =3К+ + [Со(NO2)6]3-. Константы нестойкости комплексных ионов [Со(NH3)6]3+, [Со(NO2)6]3-,соответственно равны 6,2 . 10-36; 1,0 . 10-5. Известно, что чем устойчивее комплексный ион, тем меньшее численное значение имеет константа нестойкости данного комплексного иона и наоборот – чем большее численное значение имеет константа нестойкости комплексного иона, тем мене он устойчив. Так как константа нестойкости комплексного иона [Со(NH3)6]3+ (6,2 . 10-36) имеет меньшее значение, чем ион [Со(NO2)6]3- (1.10-5), то более прочным ионом будет [Со(NH3)6]3+. Соответственно комплексная соль кобальта [Со(NH3)6]Cl будет более устойчива, чем К3[Со(NO2)6]. [Со(NH3)6]Cl – хлорид гексааммин кобальта (III) К3[Со(NO2)6] – гексанитрокобальтат (III) калия 144. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Чему равна молярная концентрация полученного раствора? Решение: Так как для раствора 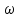 = 60%, то масса кислоты составляет 60% от массы раствора: = 60%, то масса кислоты составляет 60% от массы раствора: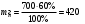 Определим массу растворителя (воды) до упаривания: 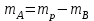 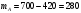 г гМасса растворителя после выпаривания составит: mA1 = 280 – 200 = 80 г Масса раствора после упаривания составит: mp1 = mA1 + mB = 420 + 80 = 500 г Определим массовую долю оставшегося раствора: 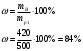 Определим молярную концентрацию полученного раствора: 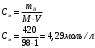 166. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н5ОН. Криоскопическая константа воды 1,86. Решение: Для расчета понижения температуры кристаллизации этилового спирта используем уравнение: 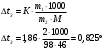 где К – криоскопическая константа; m1 – масса растворённого вещества, 2 г; m2 – масса растворителя 98г; М – молярная масса растворённого вещества [М(С2Н5ОН) = 46 г/моль]; 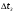 – понижение температуры замерзания раствора. – понижение температуры замерзания раствора.Вода кристаллизуется при 0 оС, следовательно, температура кристаллизации раствора равна: 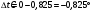 190. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и CuSO4; б) AgNO3 и NH4Cl; в) Na2SiO3 и H3РO4; г) CaCO3 и HNO3. В какой цвет будет окрашен метиловый оранжевый в этих растворах? Решение: а) K2S + CuSO4 → CuS↓ + K2SO4 2K+ + S2- + Cu2+ + SO42- → CuS↓ + 2K+ + SO42- Cu2+ + S2- → CuS↓ K2S - метиловый оранжевый окрасится в желтый цвет, т. к. сульфид калия образован слабой кислотой и сильным основанием, гидролиз будет идти по аниону, pH > 7. CuSO4 - метиловый оранжевый окрасится в красный цвет, т. к. сульфат меди образован сильной кислотой и слабым основанием, гидролиз будет идти по катиону, pH < 7. б) AgNO3 + NH4Cl → AgCl↓ + NH4NO3 Ag+ + NO3- + NH4+ + Cl- → AgCl↓ + NH4+ + NO3- Ag+ + Cl- → AgCl↓ AgNO3 - метиловый оранжевый окрасится в красный цвет, т. к. нитрат серебра образован сильной кислотой и слабым основанием, гидролиз будет идти по катиону, pH < 7. NH4Cl - метиловый оранжевый окрасится в красный цвет, т. к. хлорид аммония образован сильной кислотой и слабым основанием, гидролиз будет идти по катиону, pH < 7. в) 3Na2SiO3 + 2H3РO4 → 3H2SiO3↓ + 2Na3PO4 6Na+ + 3SiO32- + 6H+ + 2PO43- → 3H2SiO3↓ + 6Na+ + 2PO43- 6Н+ + 3SiO32- → 3H2SiO3↓ Na2SiO3 - метиловый оранжевый окрасится в желтый цвет, т. к. метасиликат натрия образован слабой кислотой и сильным основанием, гидролиз будет идти по аниону, pH > 7. H3РO4 - метиловый оранжевый окрасится в красный цвет, т. к. фосфорная кислота, сильная кислота, pH < 7. г) CaCO3↓ + 2HNO3 → Ca(NO3)2 + H2O + CO2↑ CaCO3↓ + 2H+ + 2NO3- → Ca2+ + 2NO3- + H2O + CO2↑ CaCO3↓ + 2H+ → Ca2+ + H2O + CO2↑ CaCO3 - метиловый оранжевый не изменит окраску, т. к. карбонат кальция нерастворимая соль, данная соль не подвергается гидролизу и раствор нейтрален, pH = 7. HNO3 - метиловый оранжевый окрасится в красный цвет, т. к. азотная кислота, сильная кислота, pH < 7. 215. Mогут ли происходить окислительно-восстановительные реакции между веществами: а) H2S и Br2 ; б) HI и HIO3; в) KMnO4 и K2Cr2O7? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: H2O2 + KMnO4 + H2SO4 O2 + MnSO4 + K2SO4 + H2O Определите тип окислительно-восстановительной реакции. Решение: а) Степень окисления в H2S с.о. (S) = –2 (низшая); в Br2 с.о. (Br) = 0 (промежуточная). Следовательно, взаимодействие этих веществ возможно, причем Br2 является окислителем; б) а) Степень окисления в HI с.о. (I) = –1 (низшая); в HIO3 с.о. (I) = +5 (промежуточная). Следовательно, взаимодействие этих веществ возможно, причем HIO3 является окислителем; в) Степень окисления в KMnO4 с.о. (Mn) = +7 (высшая); в K2Cr2O7 с.о. (Cr) = +6 (высшая). Так как марганец и хром находятся в высшей степени окисления, то они могут проявлять только окислительные свойства и реакция между ними невозможна. Определяем степени окисления тех элементов, которые ее изменяют: 5H2O2- + 2KMn+7O4 + 3H2SO4 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O Составляем электронные уравнения процессов окисления и восстановления, определяем окислитель и восстановитель: восстановитель 2О- – 2ē → О20 5 окисление 10 окислитель Mn+7 + 5ē → Mn+2 2 восстановление Как видно из представленных уравнений в реакции окислитель и восстановитель – разные элементы в молекулах двух разных веществ, значит, данная реакция относится к типу межмолекулярных окислительно-восстановительных реакций. 242. Чему равна величина ЭДС цинкового концентрационного элемента, составленного из двух цинковых электродов, опущенных в растворы с концентрациями ионов Zn2+, равными 10–2 и 10–6 моль/л? Приведите схему такого элемента и реакции, протекающие на электродах при его работе. Решение: Концентрационный элемент – это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями. Катодом в этом случае будет являться электрод с большей концентрацией. Составим схему гальванического элемента: (+) Zn | ZnSO4 10-2 || 10-6 ZnSO4 | Zn (-) Запишем уравнения электродных процессов: А: Zn0 - 2e → Zn2+ К: Zn2+ + 2e → Zn0 Определим ЭДС концентрационного гальванического элемента: E = (0,059/z)·lg(C1/C2) = (0,059/2)·lg(10-2/10-6) = 0,118 В 254. Дать общую характеристику ацетиленовым углеводородам (алкинам). Как из метана получить ацетилен, затем винилацетилен, а из последнего хлоропен? Свойства и применение хлоропрена, его влияние на окружающую среду. Решение: Алкины – углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Получить ацетилен из метана, можно путём дегидрирования двух молекул метана при температуре свыше 1400°C: 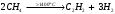 Винилацетилен получают олигомеризацией ацетилена в присутствии солей одновалентной меди и хлорида аммония в водной среде: 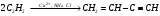 Хлоропрен получают из винилацетилена и хлороводорода в присутствии хлорида меди (II): 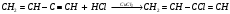 Хлоропрен обладает химическими свойствами диеновых углеводородов. 1. Наличие атома хлора (С1) и системы сопряженных двойных связей значительно повышает активность хлоропрена в радикальных реакциях. 2. Атом хлора (С1) химически мало активен. Полимеризация хлоропрена протекает по радикальному механизму. При комнатной температуре хлоропрен полимеризуется спонтанно с образованием каучукоподобного и губчатого полимеров. 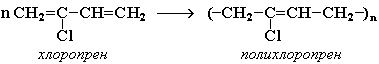 Полихлоропреновые каучуки (наирит, неопрен) – 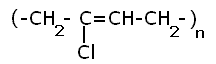 один из наиболее давно известных видов синтетических каучуков – разработаны компанией «Дюпон» в 1930-х. Обладают высокой масло-, бензо-, озоностойкостью. Полихлоропреновый каучук Байпрен применяется в производстве конвеерных лент, приводных ремней, рукавов, шлангов, водолазных костюмов, электроизоляционных материалов, технических пластин. Из полихлоропренового каучука производят также оболочки проводов и кабелей, защитные покрытия. Хлоропрен не считается стойким загрязнителем окружающей среды из-за своей реакционной способности и не подвергается биоаккумуляции или биоусилению, поскольку он легко метаболизируется. Учитывая значительное давление пара, большая часть высвобождаемого хлоропрена будет газообразной и будет реагировать с фотохимически полученными гидроксильными радикалами и молекулами озона. |
