Домашка2. Решение При изобарном процессе работа рассчитывается по формуле Количество теплоты можем определить, зная энтальпию
 Скачать 79.2 Kb. Скачать 79.2 Kb.
|
|
Домашняя работа по химии студента НБ-21-1 Окулова Максима Вычислить количество теплоты и работу, совершаемую в изобарном процессе 5 м3 азота при давлении 0,943 атм., если объем газа увеличили до 8 м3 Решение: При изобарном процессе работа рассчитывается по формуле: 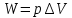 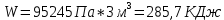 Количество теплоты можем определить, зная энтальпию 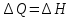 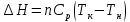 Где 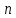 -кол-во вещества; -кол-во вещества; 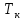 -конечная температура; -конечная температура; 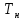 -начальная температура -начальная температура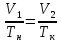 Или через изменение объема 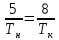 Отсюда выражаем 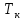 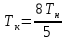 Начальный объем 5 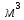 тогда n=223 моль тогда n=223 мольПодставим в формулу для энтальпии 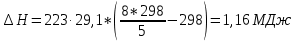 Ответ: 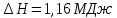 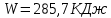 4.3.1 Вычислить тепловой эффект и энергию Гиббса при 298К в водном растворе K2CrO4 (aq) + KI (aq) + H2O (ж) = I2 (aq) + KCrO2 (aq) + KOH(aq) для CrO2- (aq): ΔfHo298 = -620,5 кДж/моль; ΔfGo298 = -612,1 кДж/моль для I2 (aq): ΔfHo298 = 22,6 кДж/моль; ΔfGo298 = 16 кДж/моль Решение: Запишем в ионном виде: CrO4(aq)2- +6I- +4H2O-(Ж)=3I2(aq)+2CrO2- +8 OH – Составим таблицу Excel с исходными данными  Примем, что энтальпия образования катиона водорода равна 0 Применим закон Гесса: Учитывая стехиометрические коэффициенты Решение в Excel:  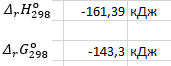 Так как Энергия Гиббса меньше 0 значит реакция возможна 4.3.2 Для заданной реакции получить зависимости теплового эффекта, изменения энтропии и энергии Гиббса для интервала температуры от 25 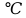 до указанного значения до указанного значенияFe2O3 (тв) + C(графит) = Fe (α) + CO2 (г) Решение: Составим таблицу со значениями в Excel:  Применим закон Гесса:  По уравнению Кирхгофа при заданной температуре рассчитывают 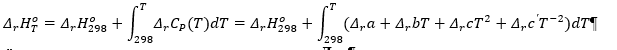 Расскроем интеграл Для энтропии: 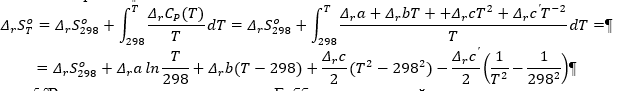 Составим таблицу с учетом, что c=0 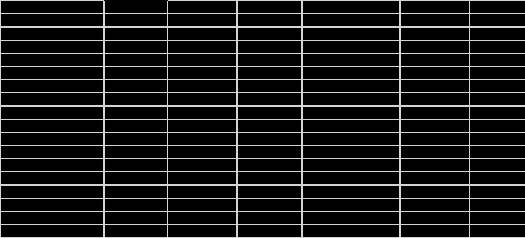 На основе таблицы сделаем графическое представление зависимостей: 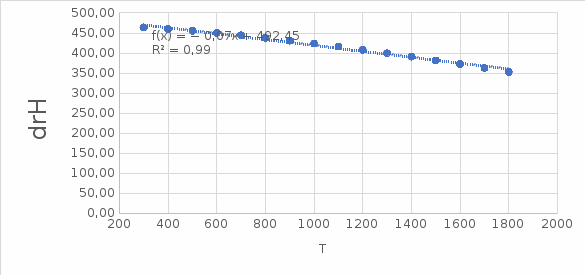 Тепловой эффект от температуры 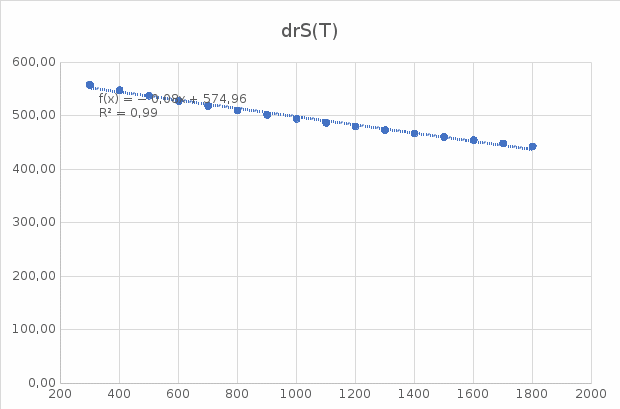 Энтропия от температуры 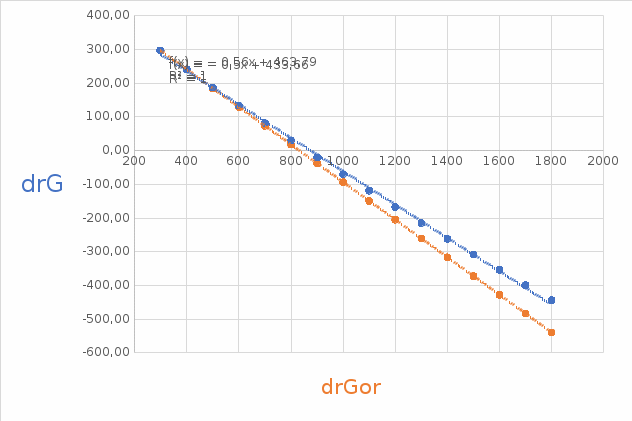 Энергия Гиббса от температуры 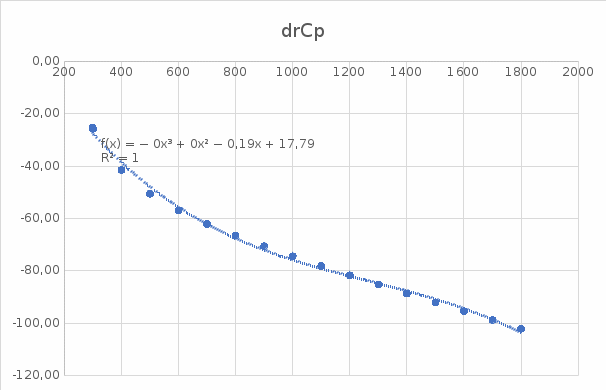 Теплоемкость от температуры Можно сделать вывод о том, что повышение температуры сильно влияет на отклонение энергии Гиббса от точного значения |
