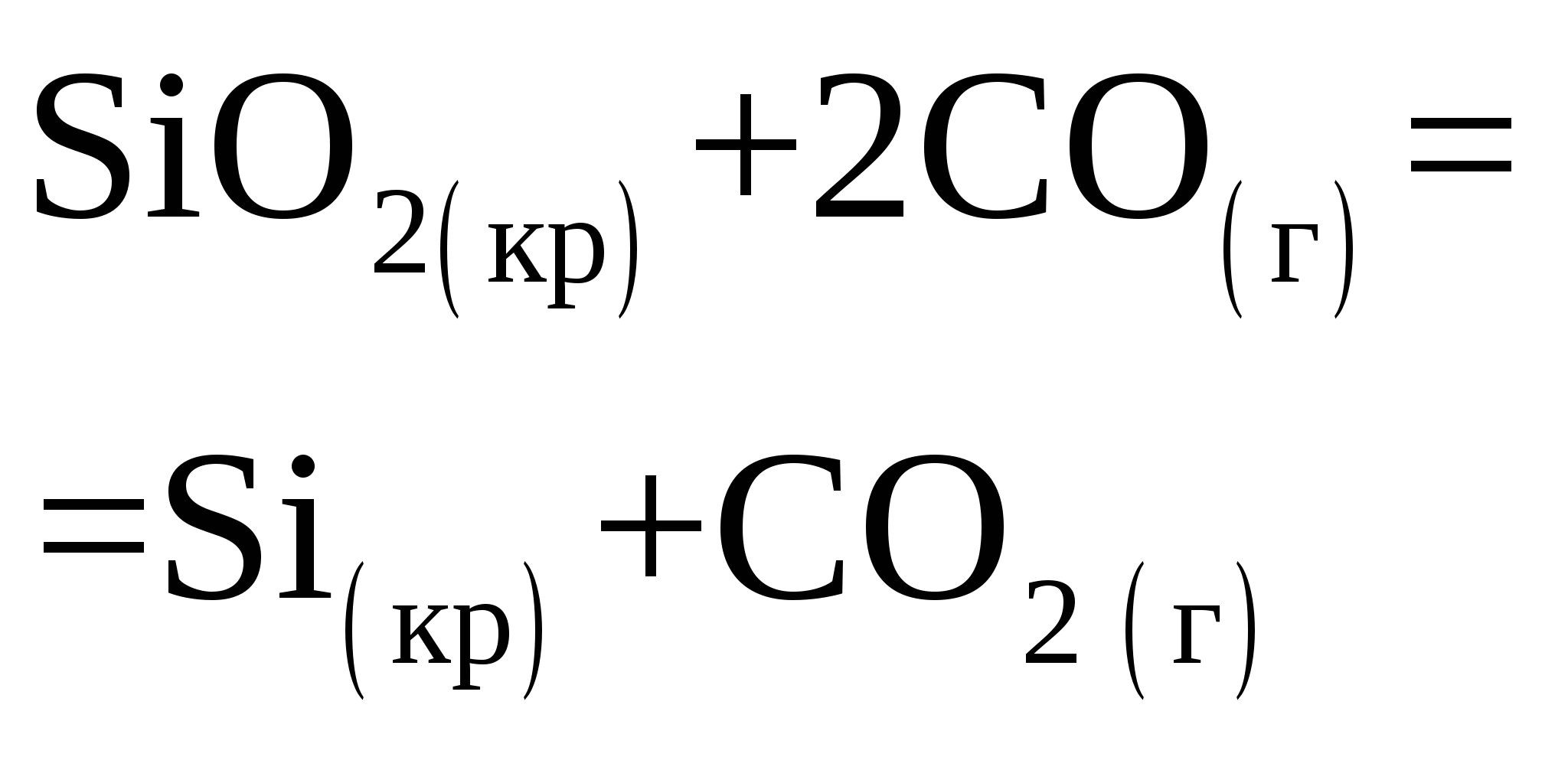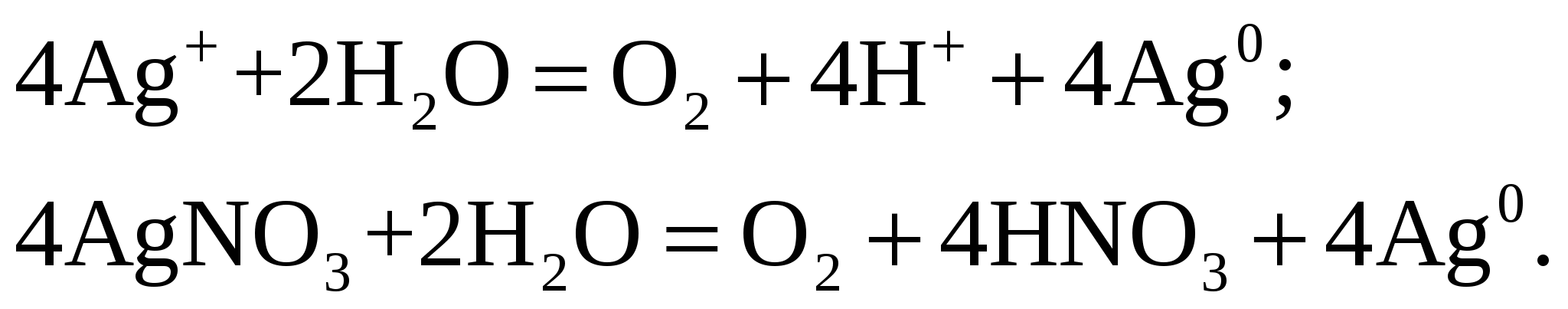контрольная работа №1 - вариант 32 - 1й семестр. Решение Реакция будет протекать следующим образом Определим объём водорода при нормальных условиях В
 Скачать 416.5 Kb. Скачать 416.5 Kb.
|
|
Задание 8. Железо массой 7 г вытесняет из кислоты HCl 3,2 Н2, измеренного при t = 39 ºC и Р = 760 мм рт. ст. Какова валентность железа в этой реакции? Определить эквивалентные массы его оксида и гидроксида.
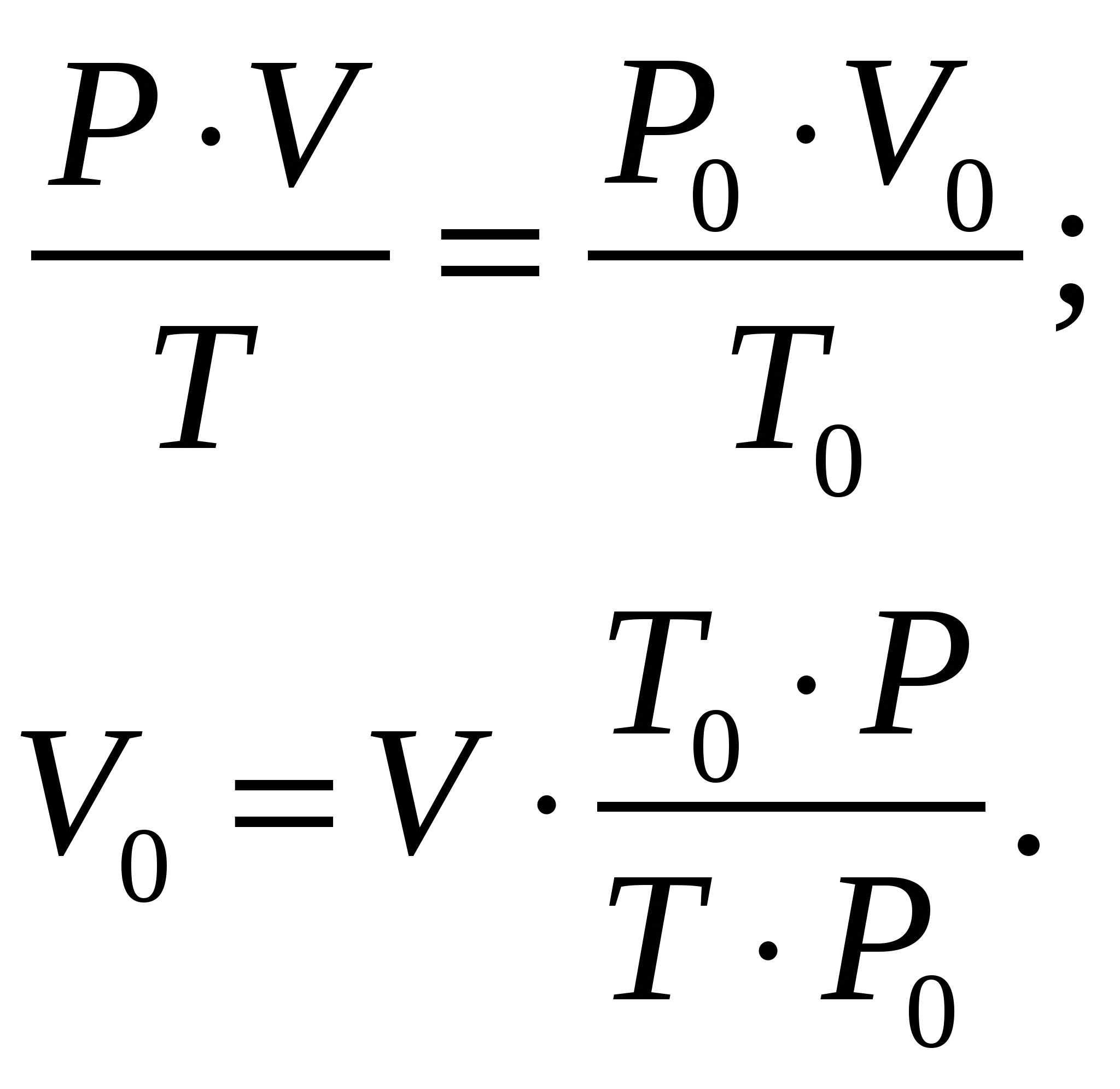 Здесь P0 = 101325 Па, Т0 = 273 К. По закону эквивалентов: 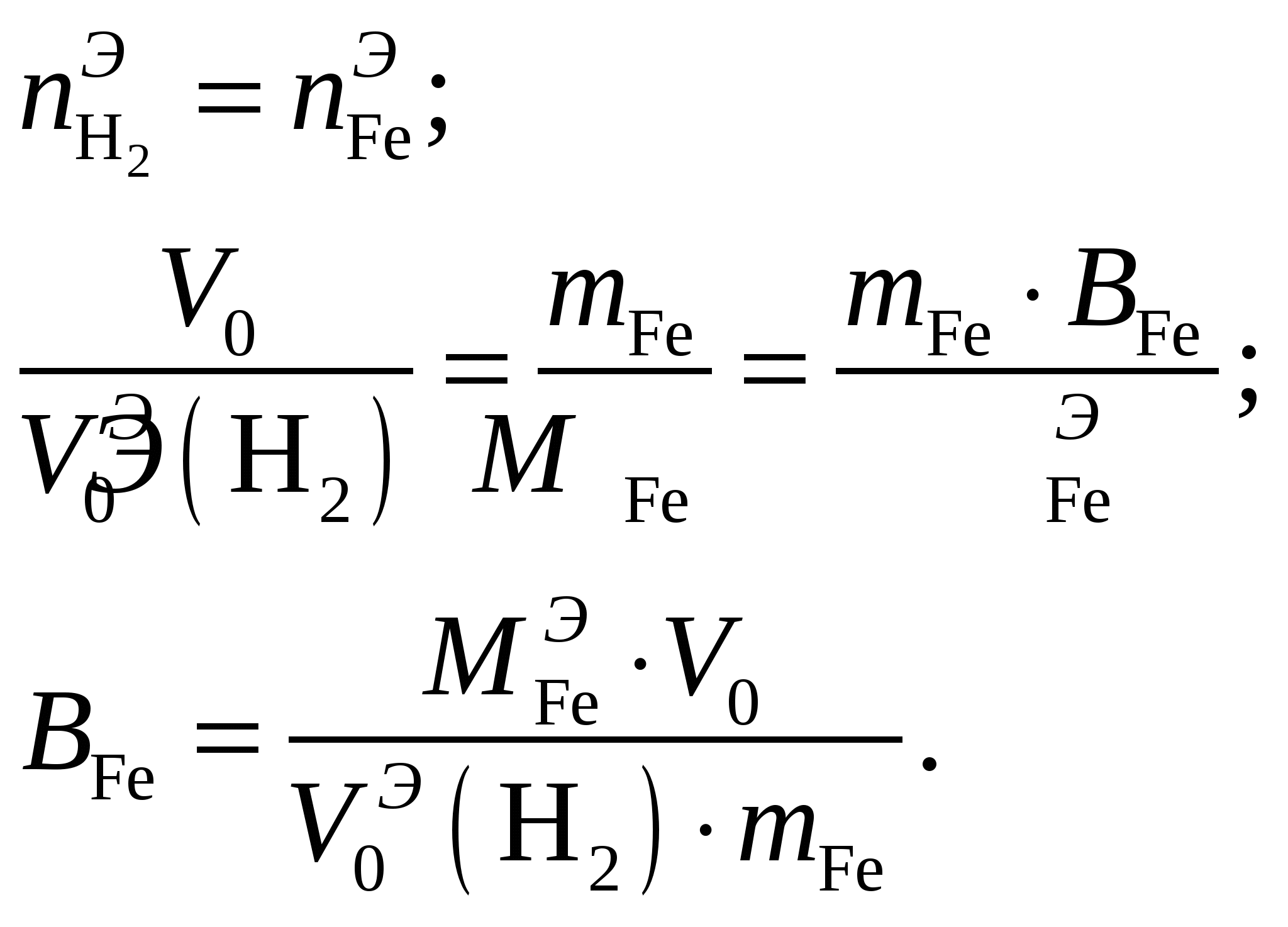 Эквивалентный объём водорода реакция имеет вид: Формула оксида железа (II) – FeO, гидроксида – Fe(OH)2. Эквивалентная масса оксида: Молярная масса оксида – Эквивалентная масса гидроксида: 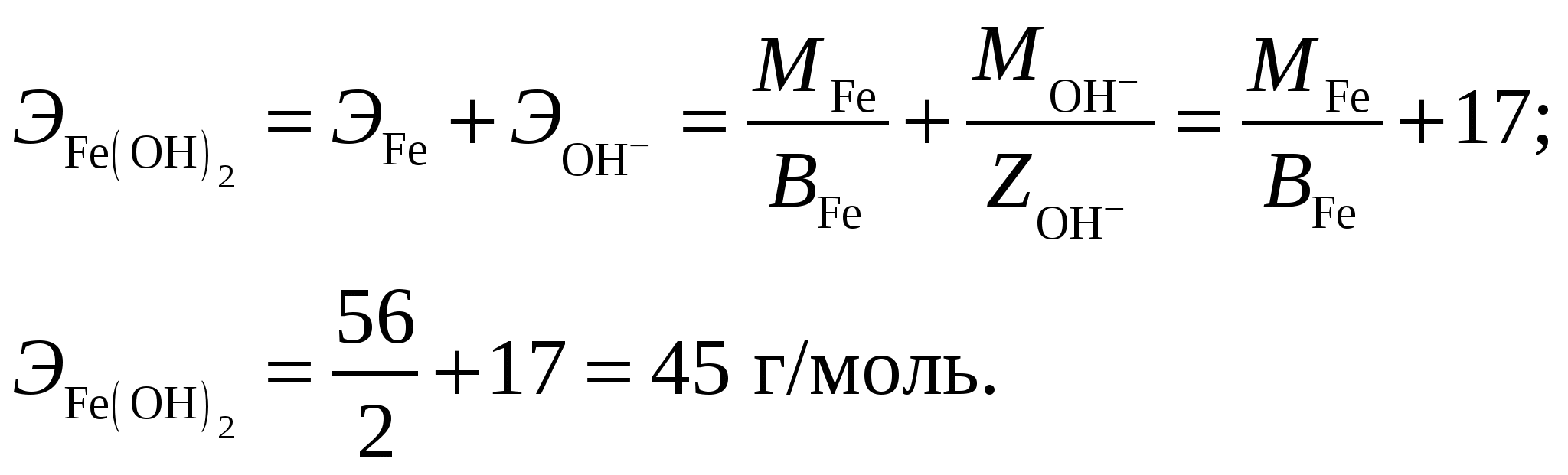 Ответ: Валентность железа, которое при массе 7 г при реакции с кислотой HCl выделяет 3,2 л водорода, измеренного при t = 39 ºC и Р = 760 мм рт. ст., составляет 2. Эквивалентная масса оксида железа (II) FeO составляет 36 г/моль, гидроксида Fe(OH)2 – 45 г/моль. Задание 104. Скорость реакции С2Н4 (г) + Н2 = С2Н6 (г) увеличилась в 9 раз. Исходя их ЗДМ рассчитайте, во сколько раз увеличилась концентрация реагирующих веществ по сравнению с первоначальной. Каков физический смысл константы скорости реакции и от каких факторов зависит её численное значение?
На 1 моль/л С2Н4 приходится 1 моль Н2, и обозначить их через х, то получим После увеличения концентраций: Тогда 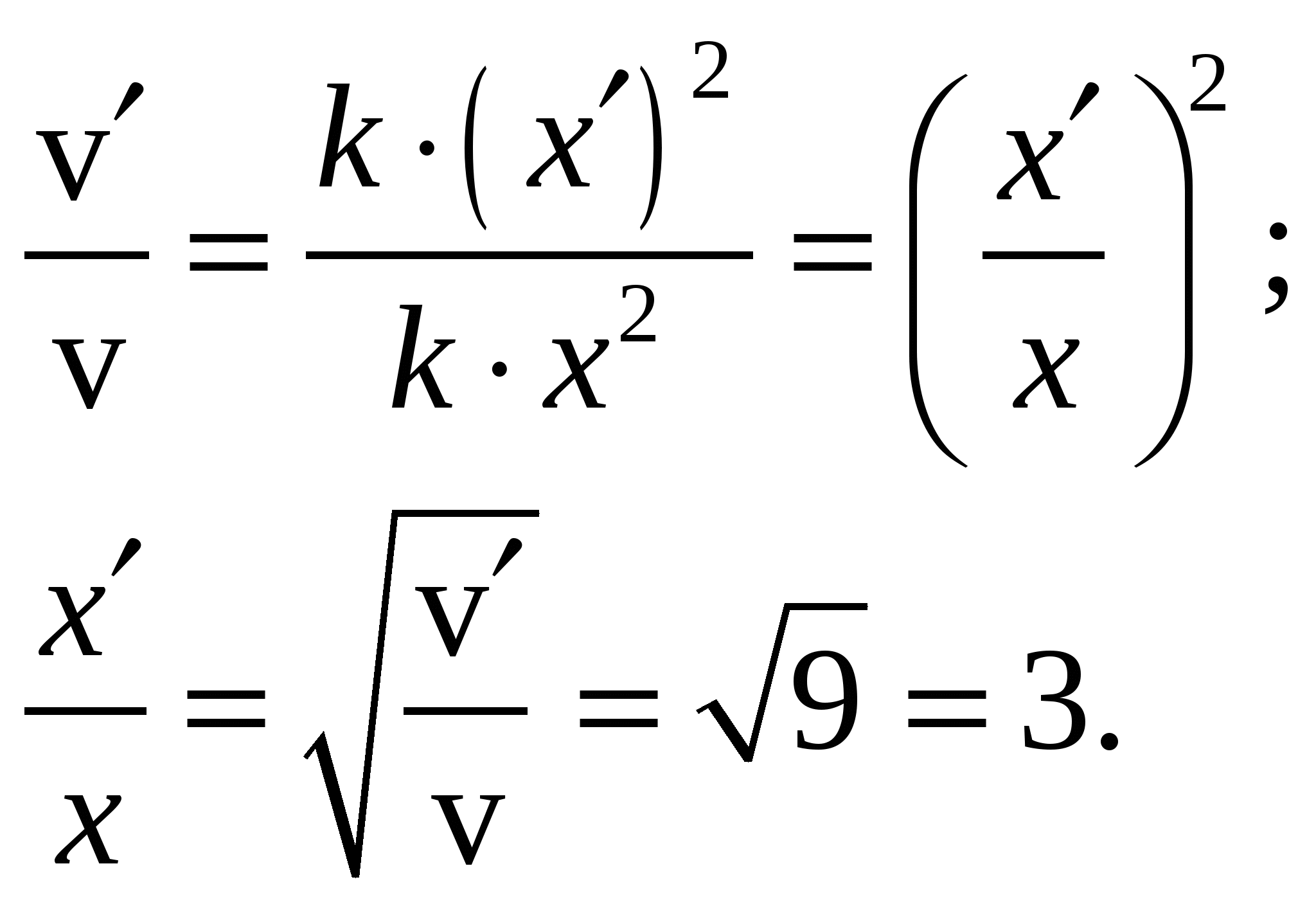 . Ответ: При увеличении скорость реакции в 9 раз концентрация каждого реагирующего вещества в реакции С2Н4 (г) + Н2 = С2Н6 (г) увеличилась в 3 раза. Задание 130. Константа равновесия гетерогенной реакции
общее количество СО и СО2 в ходе реакции будет неизменно 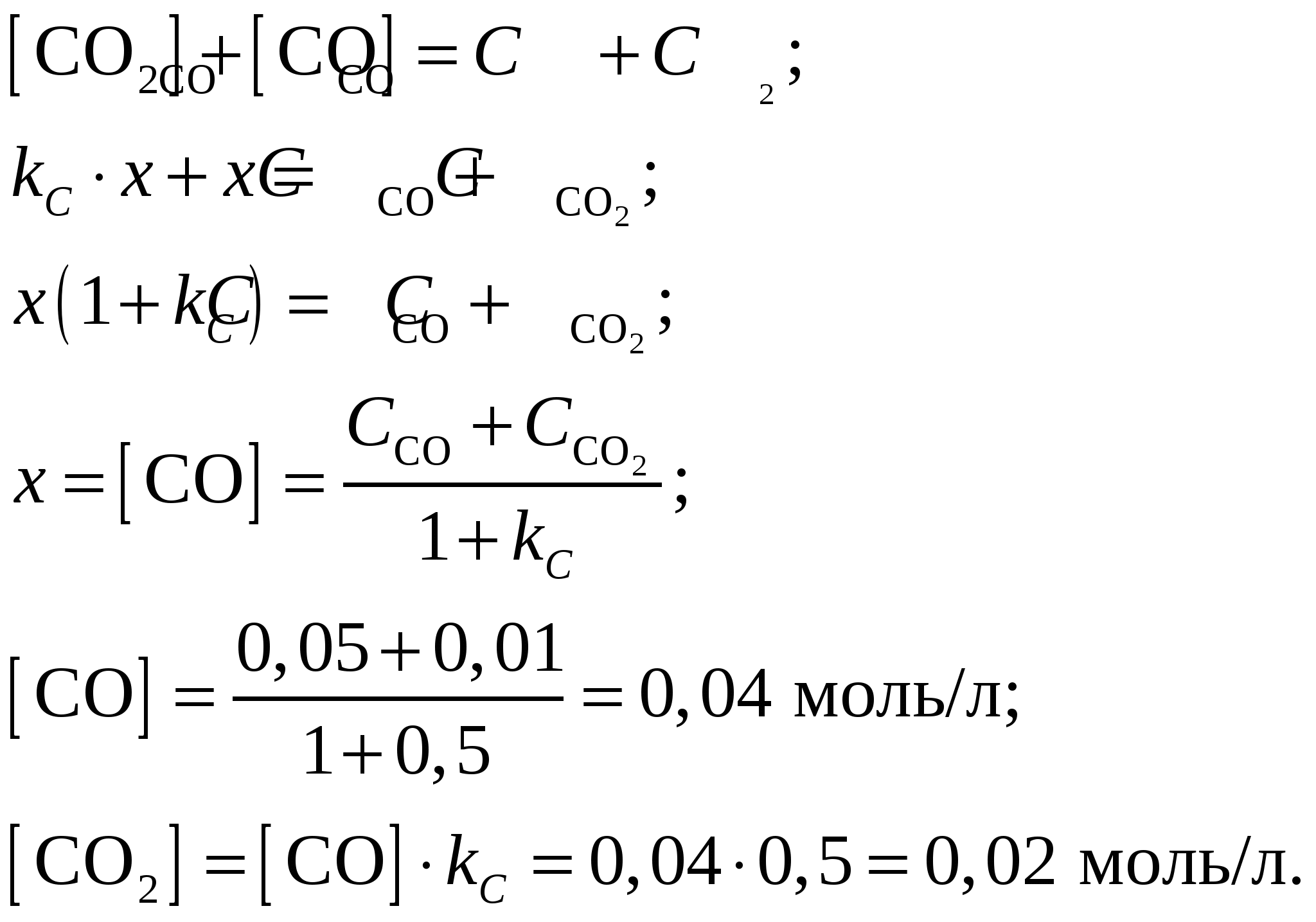 Ответ: Равновесные концентрации угарного газа СО и углекислого газа СО2 при константе равновесия гетерогенной реакции вида Задание 185. Определить степень диссоциации и концентрацию ионов в растворе, в 1 л которого содержится 3,5 г NH4OH (Kд = 1,8·10–5). Запишите уравнение диссоциации. Как изменятся значения α и Kд при уменьшении его концентрации? Ответ обоснуйте.
Молярная концентрация гидроксида аммония составит при его молярной массе, равной 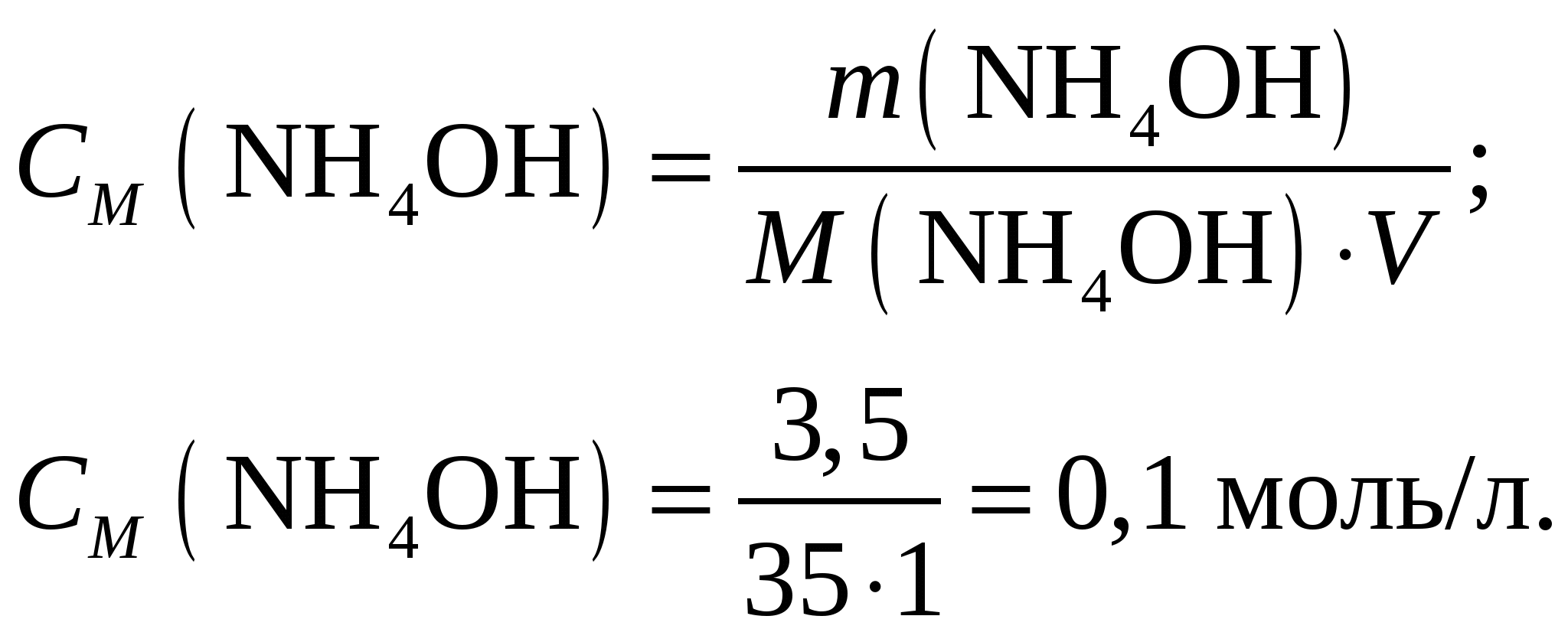 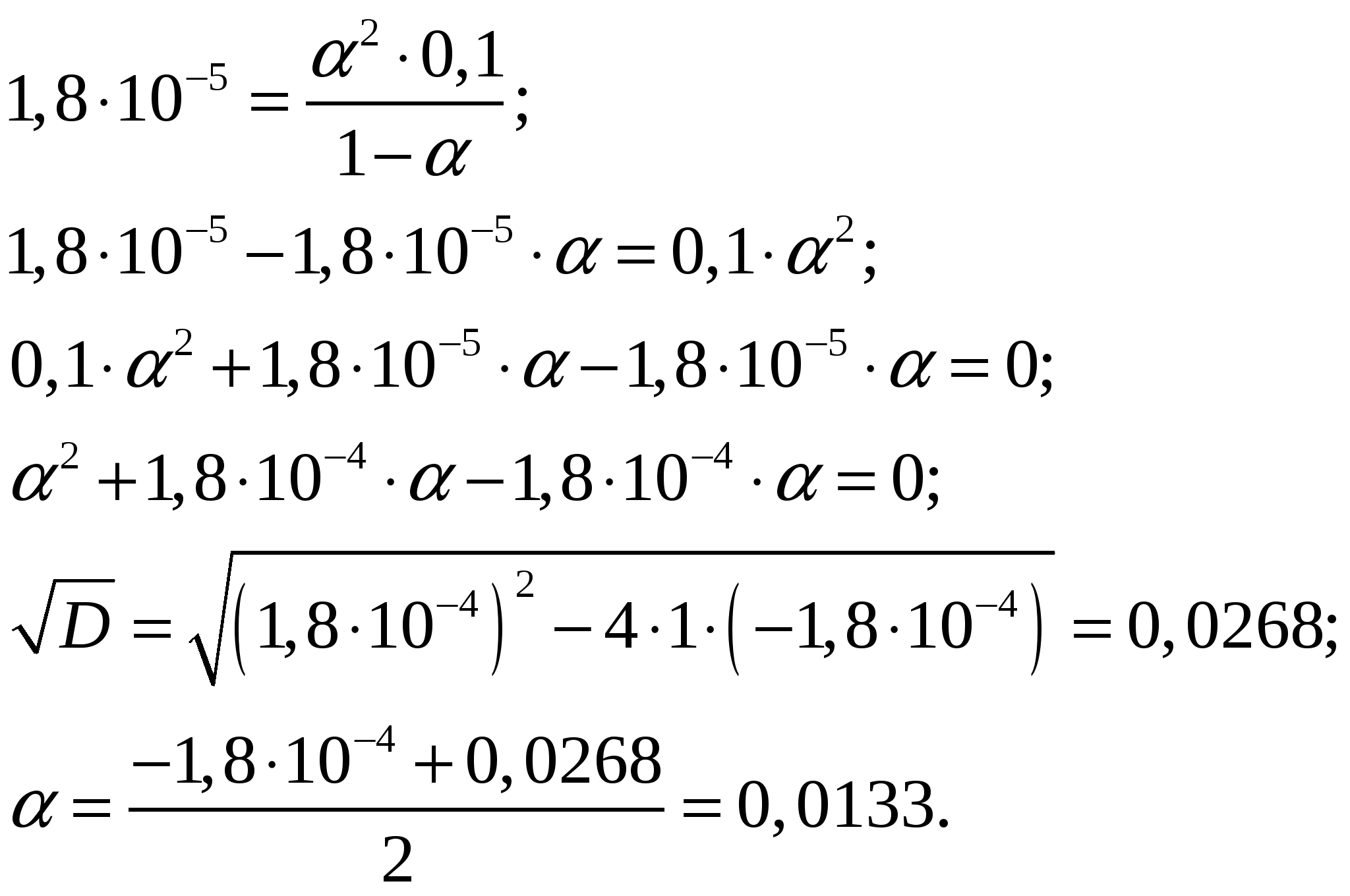 Концентрации ионов NH4+ и OH– будут равны между собой и составят 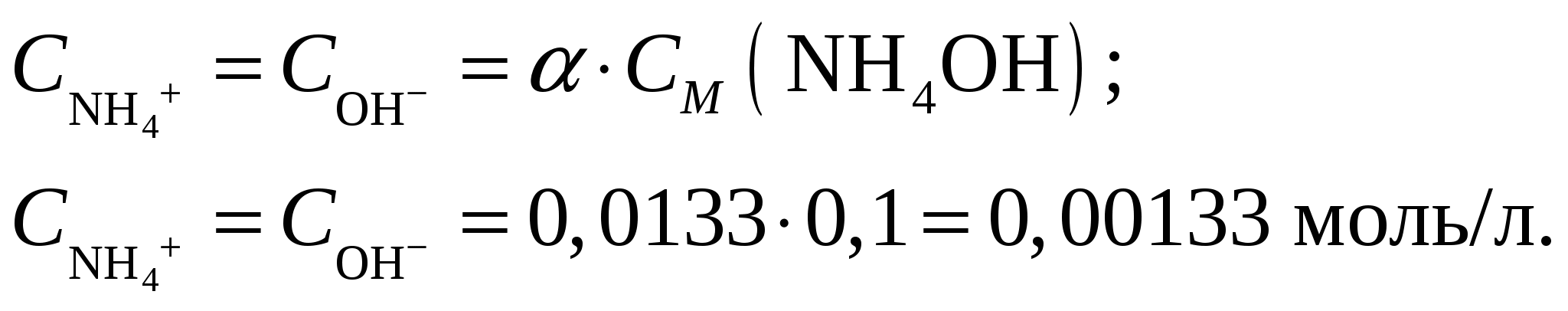 Ответ: Степень диссоциации ионов в растворе, 1 л которого содержит 3,5 г NH4OH (Kд = 1,8·10–5) составляет 0,0133. Концентрация ионов NH4+ и OH– равны и составляют 0,00133 моль/л. При уменьшении концентрации константа диссоциации не измениться, а степень диссоциации возрастёт. Задание 218. Определить молярную концентрацию раствора гидроксида аммония NH4OH, если рН = 11,13. Запишите уравнение диссоциации и выражение для константы диссоциации.
Константа диссоциации будет иметь вид 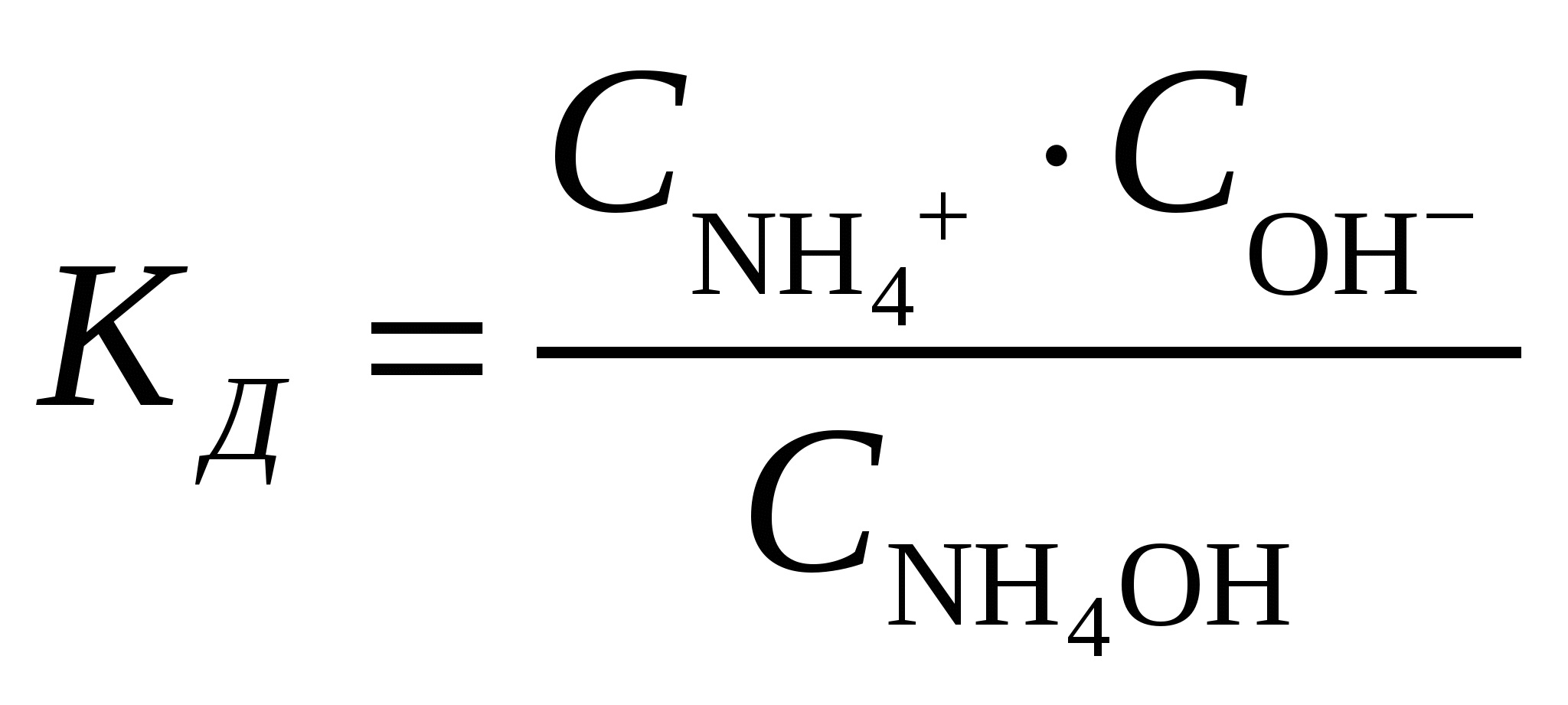 . .Концентрация иона ОН– находится по выражению 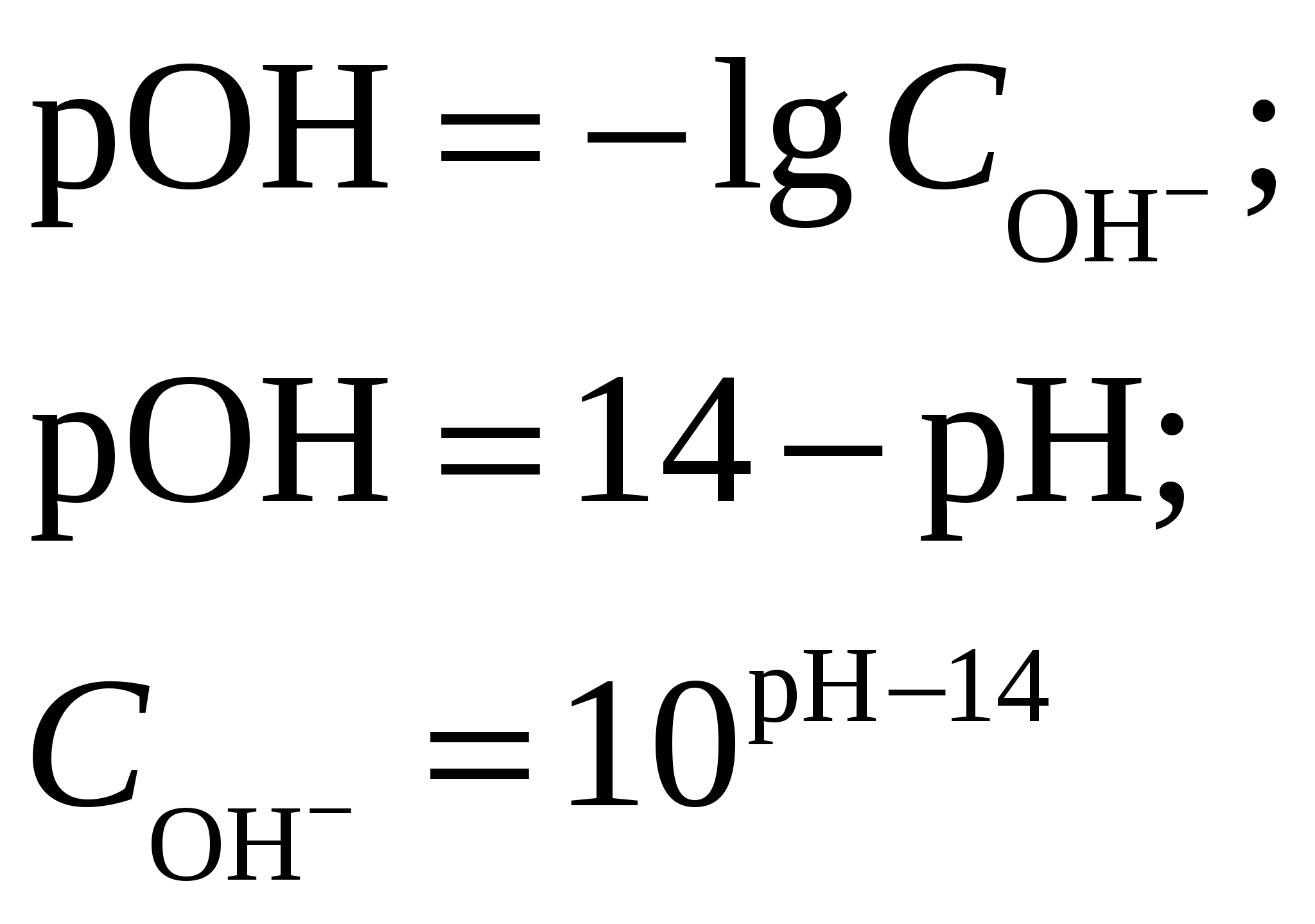 Приравняем обе части и выразим 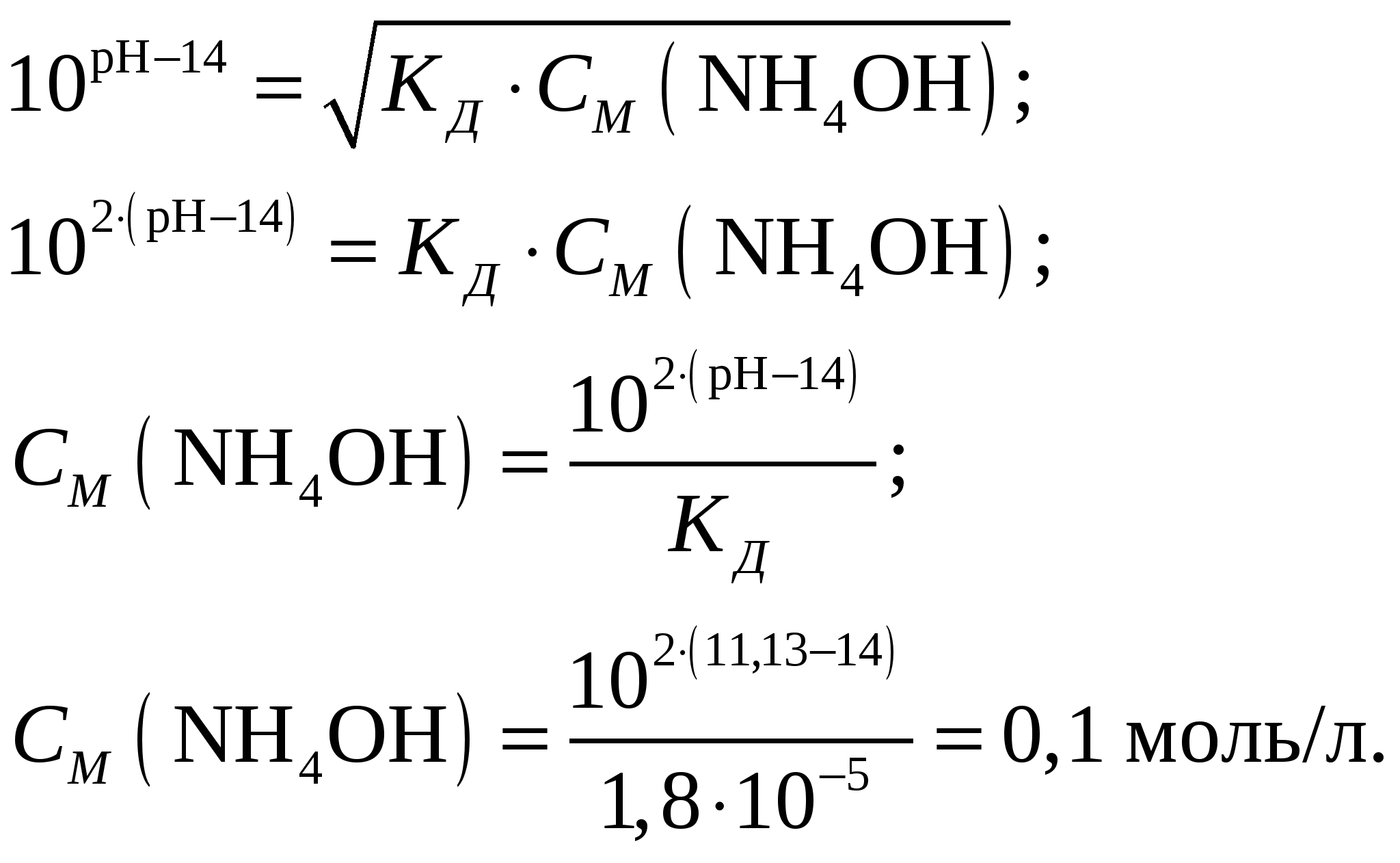 Ответ: Молярная концентрация гидроксида аммония NH4OH при рН = 11,13 составит 0,1 моль/л. Задание 8/2. Вычислить тепловой эффект реакции
Тепловой эффект при Т = 298 К определим по формуле Из приложения 1 учебно-методического пособия имеем 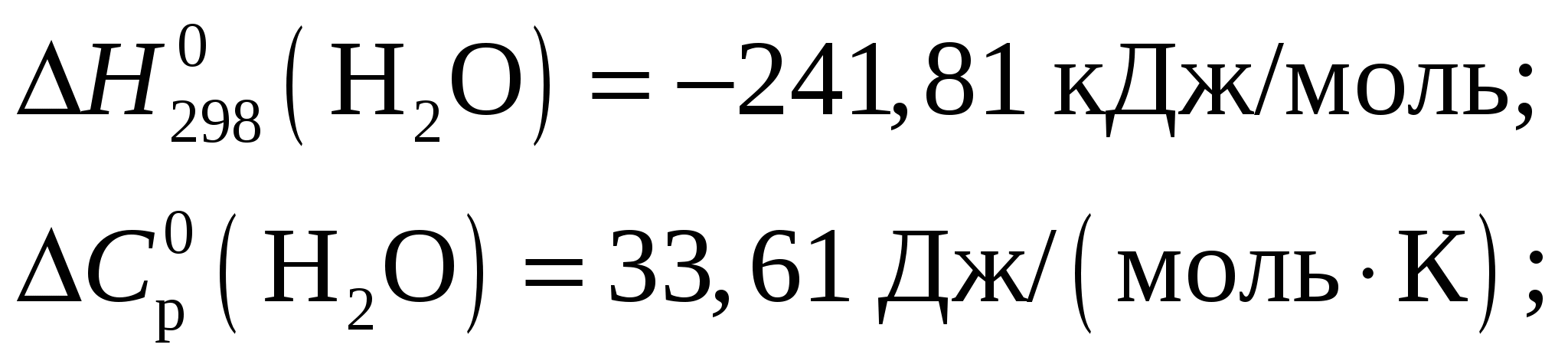 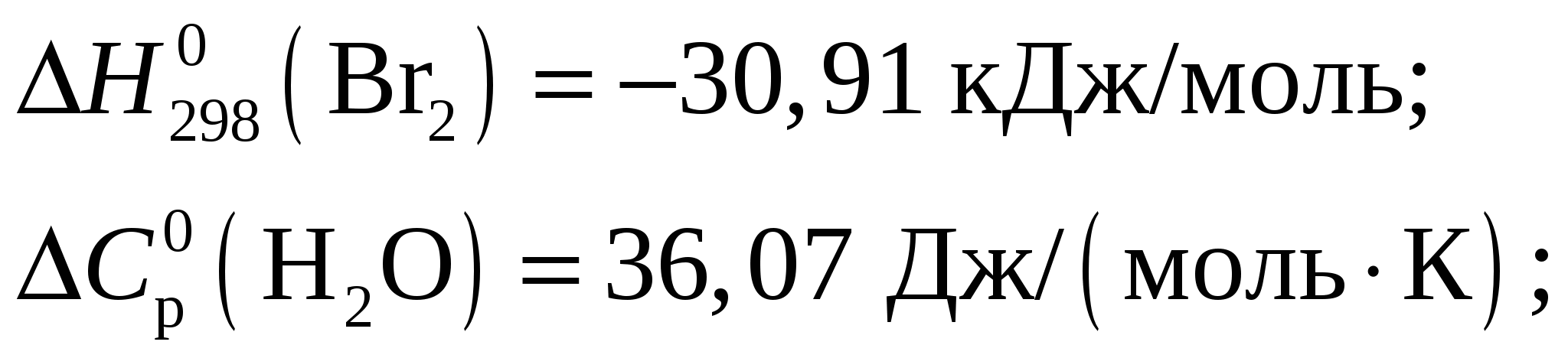 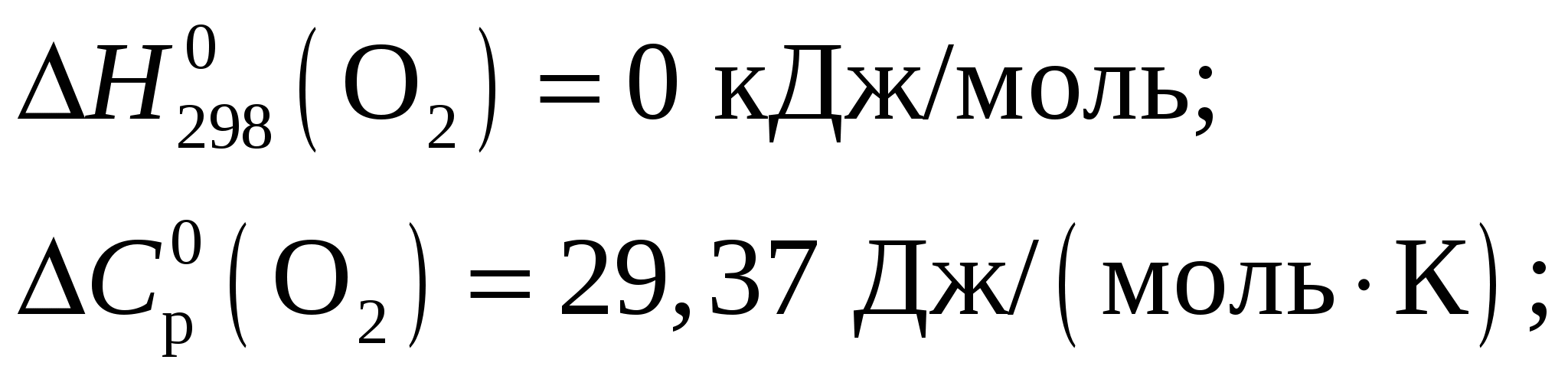 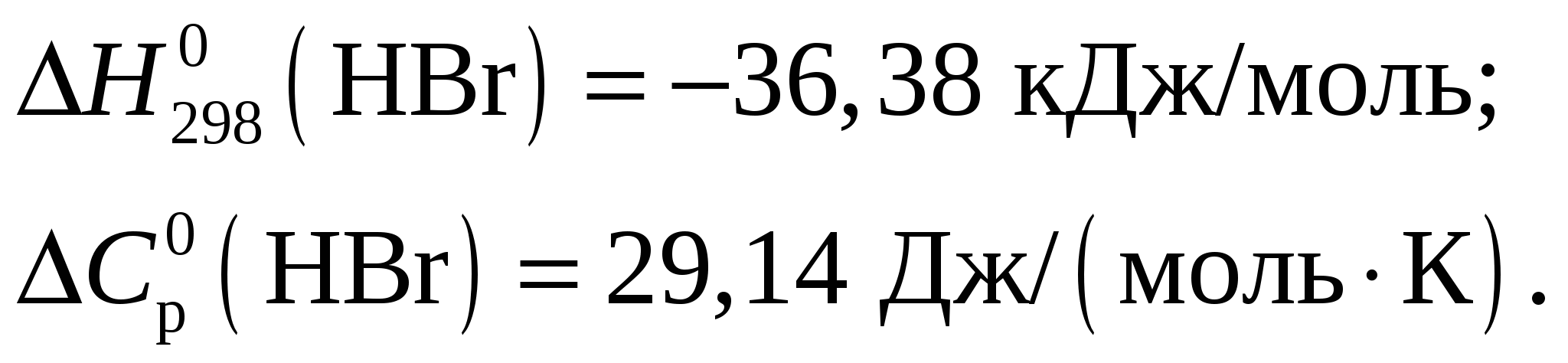 Тогда тепловой эффект при Т = 298 К реакции составит 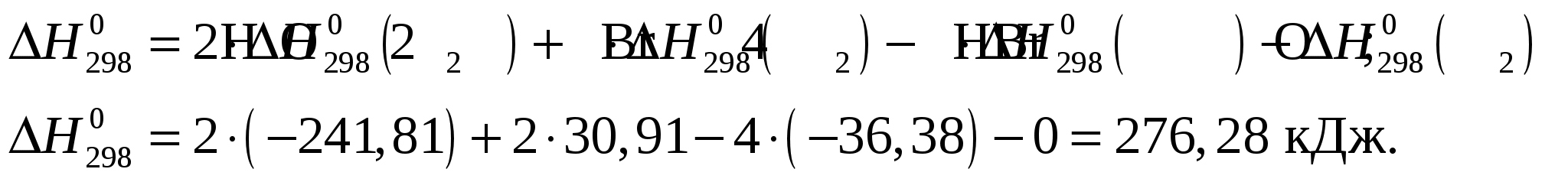 Изменение теплоёмкости составит 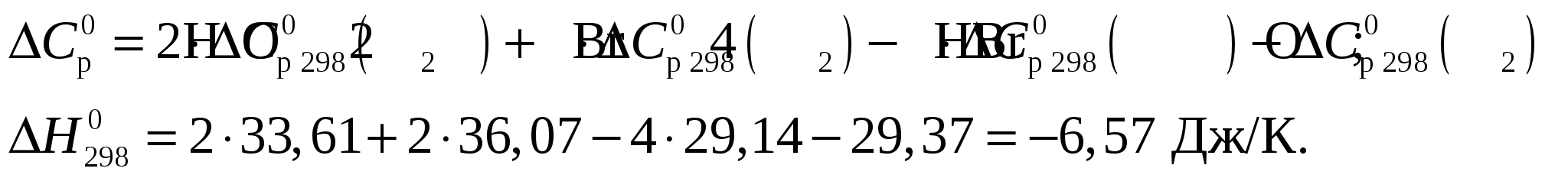 Тепловой эффект при Т = 600 К реакции составит Ответ: Тепловой эффект реакции Задание 27/2. Рассчитайте стандартное значение энтропии Fe2O3, используя стандартные энтропии веществ, если известно, что стандартное изменение энтропии для всей реакции
Применительно к данной реакции Откуда искомая энтропия Fe2O3 Из приложения 1 учебно-методического пособия имеем 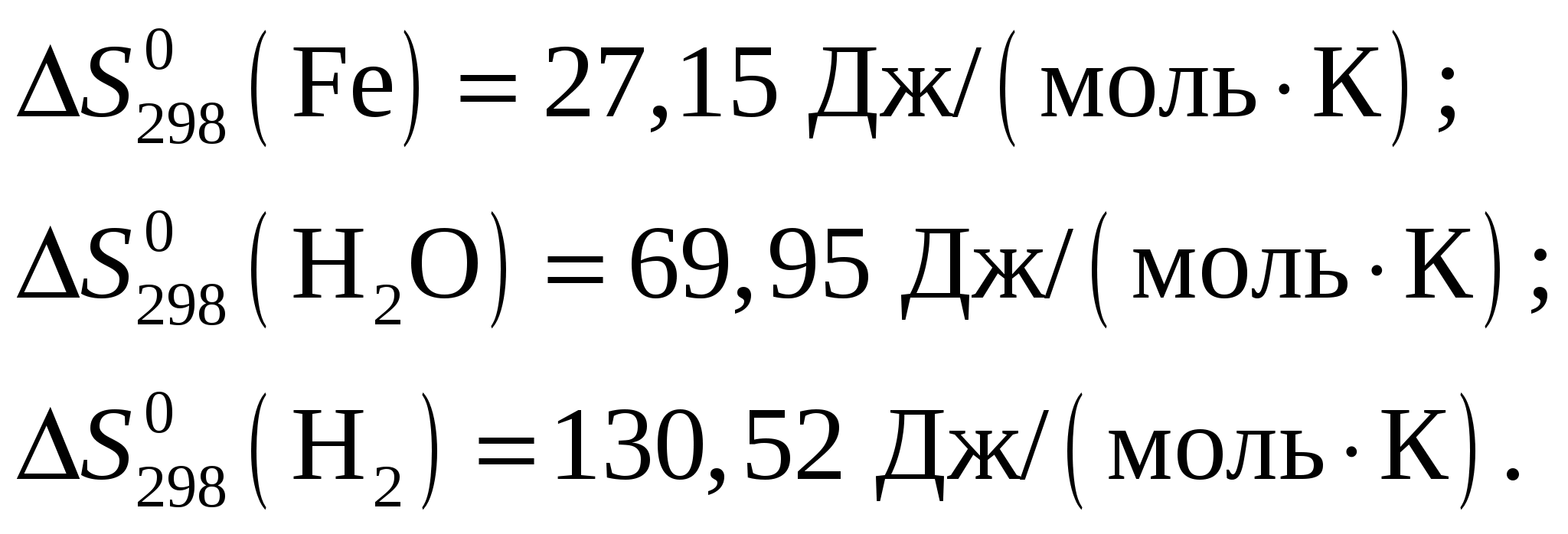 Ответ: Стандартное значение энтропии Fe2O3, полученное исходя из того, что стандартное изменение энтропии для всей реакции Задание 53/2. Возможно ли самопроизвольное протекание реакции
Рассчитаем стандартное изменение энтальпии и энтропии реакции Применительно к данной реакции 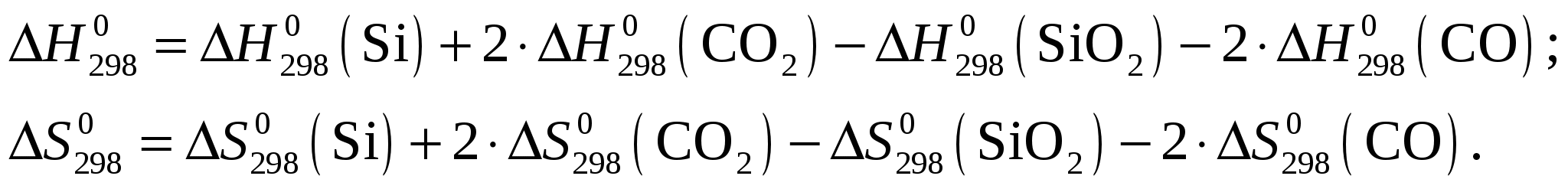 Из приложения 1 учебно-методического пособия имеем  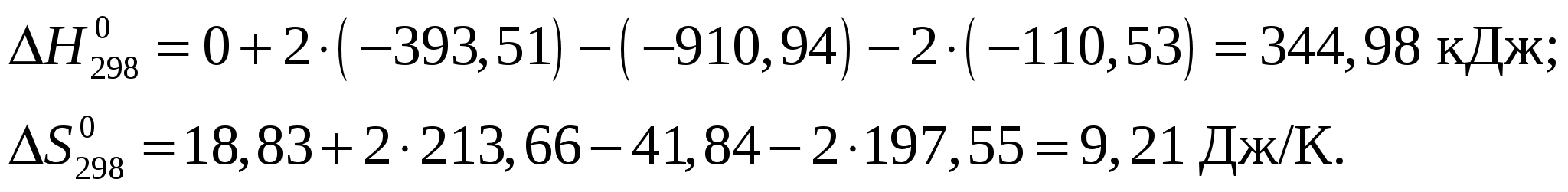 Изменение энергии Гиббса Протекание реакции при стандартных условиях невозможно. Рассчитаем температуру равновесия Ответ: Самопроизвольное протекание реакции Задание 88/2. Составьте схему гальванического элемента, в котором самопроизвольно протекает реакция
Суммарное уравнение токообразующей реакции Таким образом, из 1 моль Из таблицы 2 учебно-методического пособия имеем 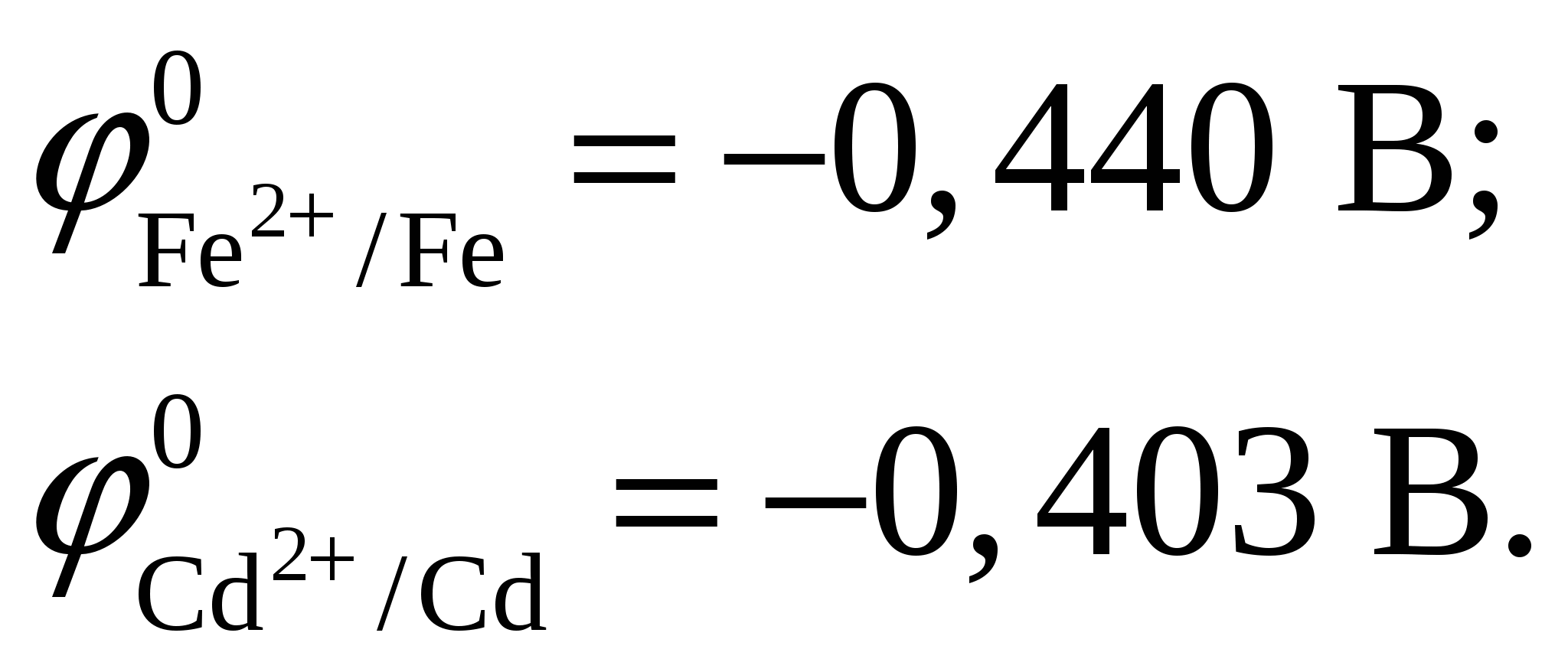 ЭДС, создаваемая элементом: С другой стороны по уравнению Нернста Подставляя, получим, что концентрация иона равна 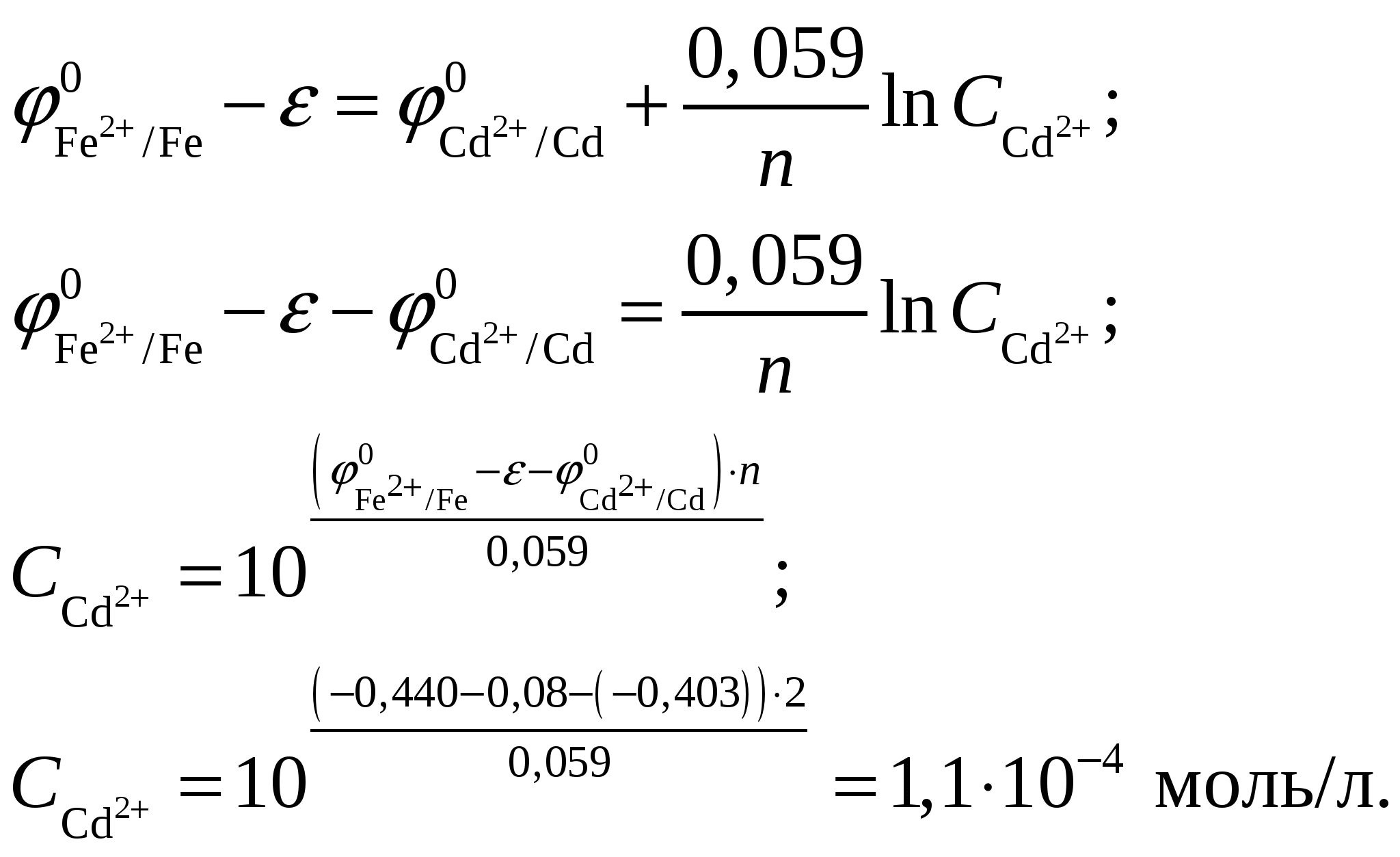 Так как концентрация иона будет равна концентрации сульфата кадмия, то Константа равновесия 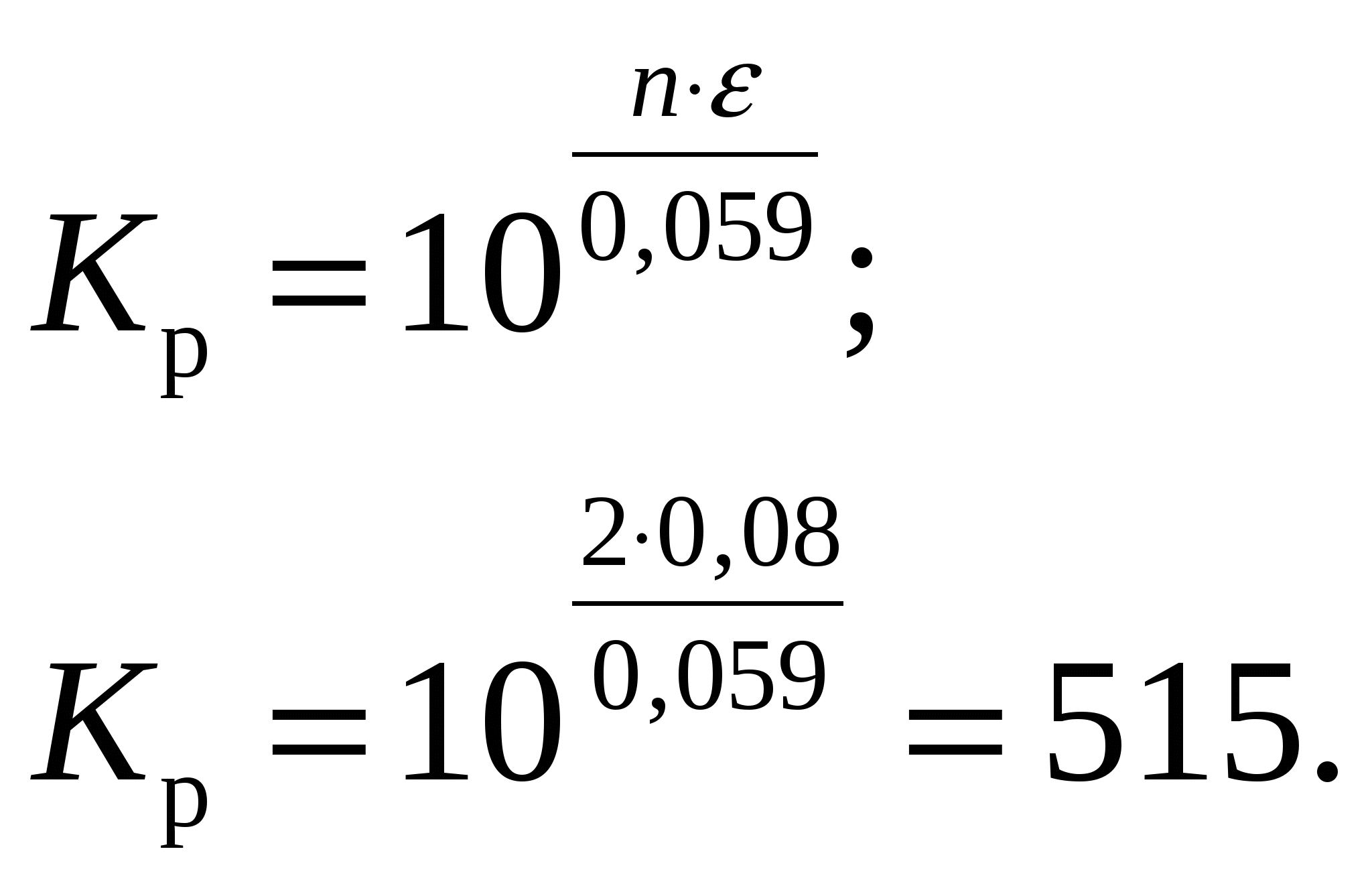 Ответ: Концентрация раствора Задание 108/2. Составьте схему электролиза 1 М раствора AgNO3 на инертных электродах и рассчитать выход по току (Вт), если за 25 мин при силе тока 3 А масса катода увеличилась на 4,8 г. Какое вещество и сколько по массе и объёму (н. у.) выделилось на аноде? Ответ подтвердите, записав уравнение электродных реакций и суммарное уравнение электролиза. Определите электрохимический эквивалент металла.
Теоретическая масса выделившегося серебра Совместно получим Эквивалентная масса серебра Электрохимический эквивалент серебра 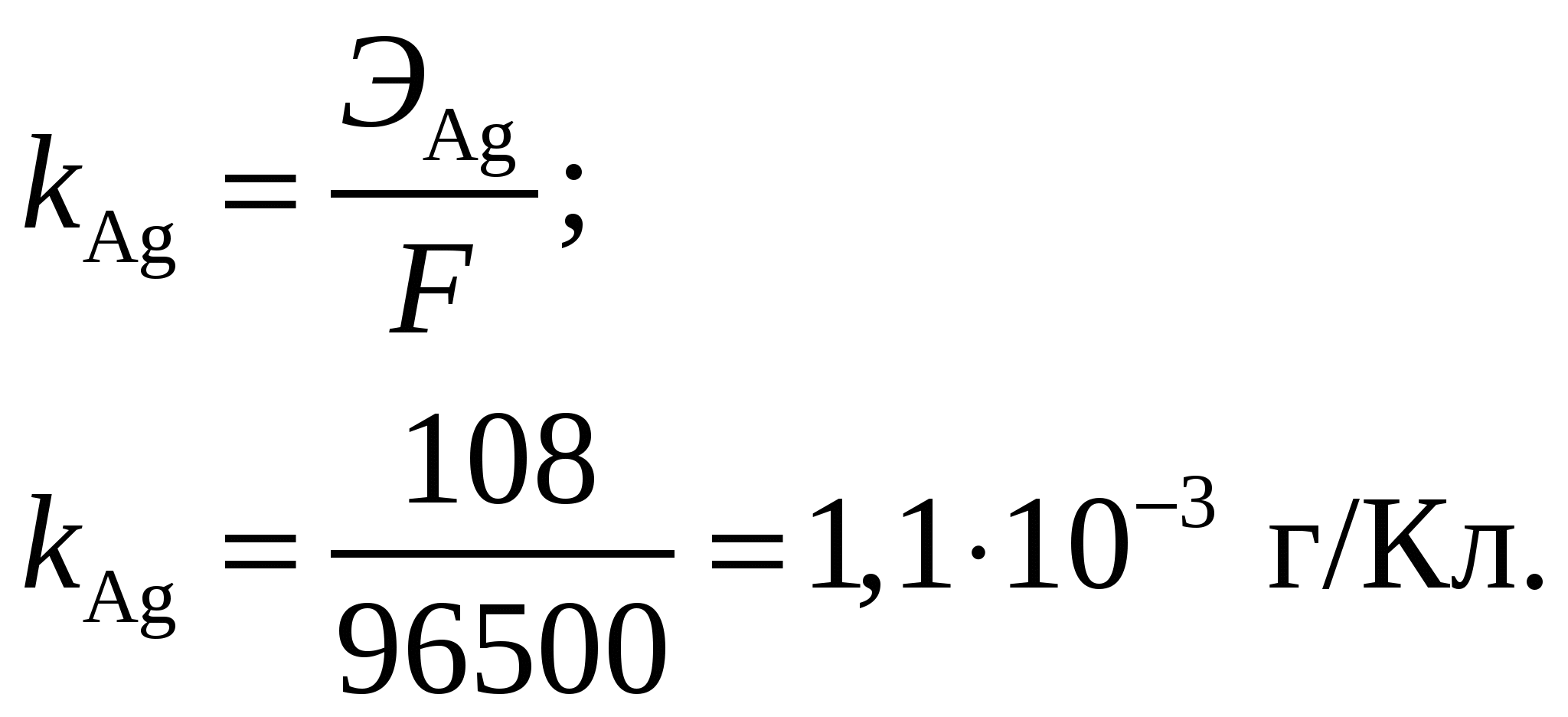 На аноде выделяется кислород. Его масса Эквивалентная масса кислорода Объём выделившегося кислорода Эквивалентный объём кислорода Ответ: Выход по току при электролизе 1 М раствора AgNO3 на инертных электродах, если за 25 мин при силе тока 3 А масса катода увеличилась на 4,8 г, составляет 0,95. Электрохимический эквивалент серебра составляет 1,1·10–3 г/Кл. На аноде будет выделяться кислород массой 0,35 г и объёмом 0,25 л. Задание 131/2. Определите термодинамическую возможность коррозии медной платы с серебряными выводами с водородной и кислородной деполяризацией в кислой среде (рН = 3). Составьте схемы образующихся микрогальванических элементов и уравнения соответствующих процессов.
Процессы: на аноде – на катоде (рН < 7) – Так как Кислородная деполяризация. Процессы: на аноде – на катоде (рН < 7) – Суммарный процесс Ответ: При водородной деполяризации медной платы с серебряными выводами коррозия проходить не будет, так как Задание 156/2. Как электролитически создать катодное покрытие на оловянном изделии? Приведите схему, уравнения соответствующих процессов. Чем объясняется ненадёжность катодных покрытий? Решение: Для того, чтобы создать на олове При нарушении покрытия во влажном воздухе будут протекать такие процессы ( на аноде – на катоде – Суммарный процесс: 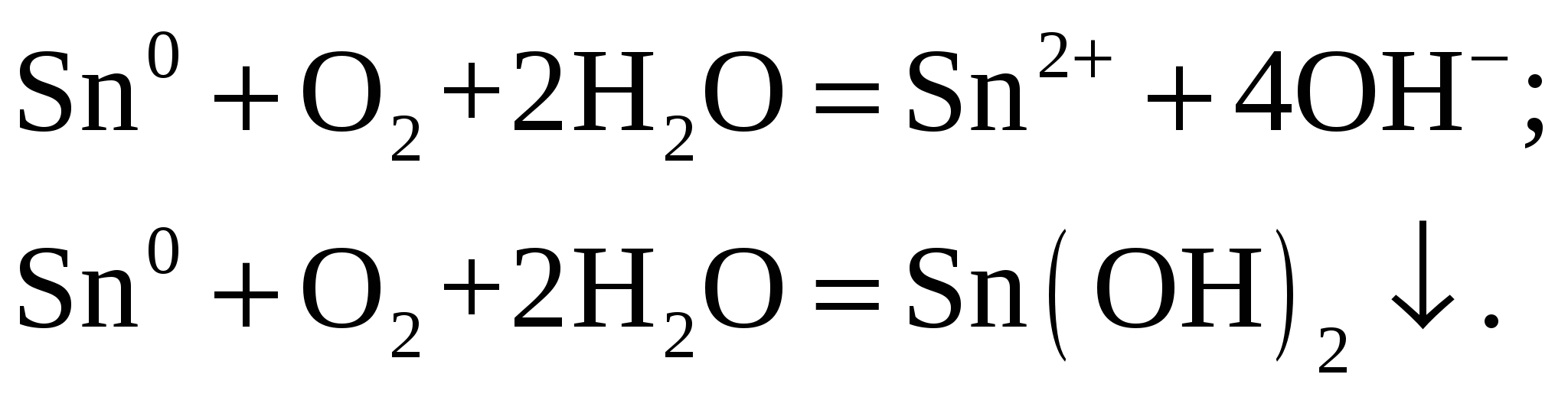 . Надёжными катодные покрытия являются только при условии отсутствия в них сквозных пор, трещин и других дефектов, так как они механически препятствуют проникновению агрессивной среды к основному металлу. |