Решение химических задач. химия. Решение Степень кислотности или щёлочности раствора выражается отрицательным десятичным логарифмом концентрации водородных ионов и называется водородным показателем рН
 Скачать 71.42 Kb. Скачать 71.42 Kb.
|
|
9. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Железо → сульфат железа (III) → гидроксид железа (III) → оксид железа (III) → хлорид железа (III) → дигидроксохлорид железа (III) 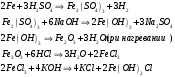 30. Вычислить рН растворов, в которых концентрация ионов ОН– (в моль/л) равна: а) 210-7 ; б) 8,110-3 Решение: Степень кислотности или щёлочности раствора выражается отрицательным десятичным логарифмом концентрации водородных ионов и называется водородным показателем рН: 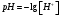 Округляя значение логарифма до 0,01, получим: а) 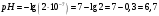 б)  51. Один грамм некоторого металла реагирует с 1,78 г серы или 8,89 г брома. Вычислите молярные массы эквивалента брома и металла, если известно, что молярная масса эквивалента серы составляет 16 г/моль. Эквивалентная масса серы = 16 г/моль 1 г металла эквивалентен 1,78 г серы  г/моль металла эквивалентны 16 г/моль серы г/моль металла эквивалентны 16 г/моль серы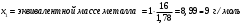 1 г металла эквивалентен 8,89 г брома 8,99 г/моль металла эквивалентны 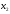 г/моль брома г/моль брома Ответ: Эм(Ме)=9 г/моль, Эм(Вг) = 79,9 г/моль 72. Какое количество хлорида аммония необходимо для приготовления 500 мл 0,2 М хлорида аммония NH4Cl? Рассчитайте эквивалентную концентрацию и титр этого раствора.  Эквивалентная масса 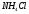 равна его молярной массе, т.е. 53,5 г/моль. равна его молярной массе, т.е. 53,5 г/моль.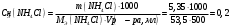 93. Вычислите общую жесткость воды, если в 40 л ее содержится 900 мг ионов Mg2+ и 2400 мг Ca2+ Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (моль/л). Один мэкв/л жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+. Находим общую жёсткость воды: 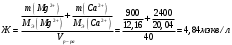 114. Катодом гальванического элемента является свинец. Подберите металл анода для этого элемента. Составьте схему указанного элемента, напишите уравнения полуреакций анодного и катодного процессов, а также ионное и молекулярное уравнения реакции, происходящей при работе элемента. В гальваническом элементе более активный металл, с более отрицательным электродным потенциалом является анодом. Примем, что свинец со стандартным электродным потенциалом φ⁰(Pb²⁺/Pb⁰) = - 0,126 В - это катод, а цинк со стандартным электродным потенциалом φ⁰(Zn²⁺/Zn⁰) = - 0,762 B – анод Составим схему гальванического элемента: (-) Zn⁰ │Zn²⁺││Pb²⁺│Pb⁰ (+) На анод (цинк) протекает процесс 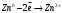 (реакция окисления) (реакция окисления)Электроны по проводнику переходят на свинцовый катод, где протекает реакция восстановления: 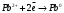 . . А: 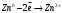 К: 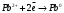 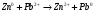 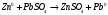 135. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора сульфата алюминия в случае: а) угольного анода; 15 б) алюминиевого анода. Электролиз раствора Al2(SO4)3 в случае угольного анода: K: 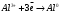 A:  Вывод: 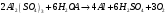 Электролиз раствора Al2(SO4)3 в случае алюминиевого анода: K: 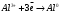 A: 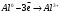 Вывод:  156. Для защиты от коррозии железо покрыли: а) цинком; б) оловом; в) никелем. Составьте уравнения анодных и катодных процессов, которые будут происходить в нейтральной среде при нарушении целостности защитного слоя. Cтандартный электродный потенциал железа φ° (Fe²⁺/Fe⁰) = ₋ 0,447 B, стандартный электродный потенциал цинка φ° (Zn²⁺/Zn⁰) = ₋ 0,762 B, стандартный электродный потенциал олова φ°(Sn²⁺/Sn⁰) = −0,136 В, стандартный электродный потенциал никеля φ°(Ni²⁺/Ni⁰) = −0,25 В. Стандартный электродный потенциал цинка меньше чем у железа, значит железо, покрытое цинком - пример анодного покрытия. При нарушении целостности такого покрытия в нейтральной среде возникает гальваническая пара Zn – Fe, в этой паре цинк – анод, а железо – катод. Более активный цинк будет разрушаться, но электроны с цинка переходят на поверхность железа и, тем самым, они будут защищать железо от коррозии. В этом случае на поверхности цинка происходит процесс окисления. Электроны с цинка переходят на поверхность железа, где протекает кислородная деполяризация электронов. А) Анод: 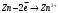 Катод: 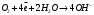 А покрытия оловом и никелем по отношению будут катодными покрытиями. При нарушении целостности катодного покрытия в нейтральной среде возникают гальванические пары Fe – Sn и Fe - Ni, в которых анод – железо – разрушается, а катод – олово или никель – остается защищенным. В случае коррозии в нейтральной среде (во влажном воздухе) на поверхности железа происходит процесс окисления. Электроны железа переходят на поверхность олова или никеля, где протекает кислородная деполяризация электронов. Б) Анод: 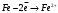 Катод: 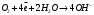 В) Анод: 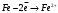 Катод: 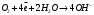 |
