|
|
Решение задач на pH и гидролиз. Решение задач на pH
Решение задач на pH
Пример задания (фрагмент табл.1):
Номер
варианта
|
Номера задач
|
1
|
2
|
3
|
4
|
5
|
6
|
рН
|
pOH
|
c1
|
c2
|
V1
|
V2
|
c
|
Ka
|
пример
|
2,4
|
10,9
|
0,023
|
0,032
|
22
|
64
|
0,034
|
4,3·10−6
|
1. Определение среды раствора по значению рН
рН
|
ОБЩИЙ ВИД
|
ПРИМЕР
|
> 7
|
< 7
|
рН = 2,4 <7
|
Среда раствора
|
щелочная
|
кислая
|
кислая
|
а) Расчет молярной концентрации: а) ионов Н+; б) ионов ОН−
|
ОБЩИЙ ВИД
|
ПРИМЕР
|
а)
|
[H+] = 10−pH моль/л
|
[H+] = 10–2,4 = 4,0∙10–3 моль/л
|
б)
|
[OH–] = 10pH–14 моль/л
|
[OH–] = 102,4–14 = 2,5∙10–12 моль/л
|
в) Расчет молярной концентрации HCl (если среда кислая) или NaOH (если среда щелочная)
|
ОБЩИЙ ВИД
|
ПРИМЕР
|
Среда раствора
|
кислая
|
щелочная
|
кислая
|
c(HCl) или c(NaOH), моль/л
|
c(HCl) = [H+]
|
c(NaOH) = [OH–]
|
c(HCl) = 4,0∙10–3
|
2. Определение среды раствора по значению рOН
рOН
|
ОБЩИЙ ВИД
|
ПРИМЕР
|
< 7
|
> 7
|
рOН = 10,9 > 7
|
Среда раствора
|
щелочная
|
кислая
|
кислая
|
а) Расчет молярной концентрации: а) ионов Н+; б) ионов ОН−
|
ОБЩИЙ ВИД
|
ПРИМЕР
|
а)
|
[H+] = 10pOH–14 моль/л
|
[H+] = 1010,9–14 = 7,9∙10–4 моль/л[
|
б)
|
[OH–] = 10−pOH моль/л
|
[OH–] = 10–10,9 = 1,3∙10–11 моль/л
|
в) Расчет молярной концентрации HCl (если среда кислая) или NaOH (если среда щелочная)
|
ОБЩИЙ ВИД
|
ПРИМЕР
|
Среда раствора
|
кислая
|
щелочная
|
кислая
|
c, моль/л
|
c(HCl) = [H+]
|
c(NaOH) = [OH–]
|
c(HCl) = 7,9∙10–4
|
3. Нахождение рН и pOH c1 М раствора H2SO4 (уравнение диссоциации: H2SO4 → 2 H+ + SO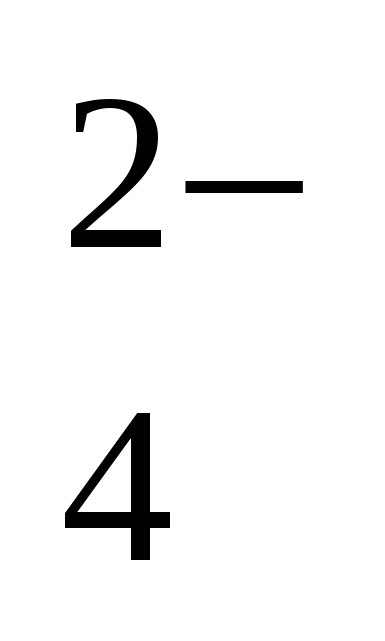 ) )
ОБЩИЙ ВИД
|
ПРИМЕР
|
[H+] = 2c1 моль/л
|
[H+] = 2·0,023 = 0,046 моль/л
|
pH = –lg[H+]; pOH = 14 – рН
|
pH = –lg0,046 = 1,337; pOH = 14 – 1,337 = 12,663
|
4. Нахождение рН и pOH c2 М раствора Ba(OH)2 (уравнение диссоциации: Ba(OH)2 → Ba2+ + 2OH−)
ОБЩИЙ ВИД
|
ПРИМЕР
|
[OH–] = 2c2 моль/л
|
[OH–] = 2·0,032 = 0,064 моль/л
|
pOH = –lg[OH–]; pH = 14 – рOН
|
pOH = –lg0,064 = 1,194; pH = 14 – 1,194 = 12,806
|
5. Нахождение рН раствора, полученного при смешении V1 мл c1 М раствора H2SO4 и
V2 мл c2 М раствора Ba(OH)2 (уравнение реакции: H+ + OH− = H2O)
ОБЩИЙ ВИД
|
ПРИМЕР
|
n0(H+) = [H+]V1 ммоль
n0(OH−) = [OH−]V2 ммоль
|
n0(H+) = 0,046·22 = 1,012 ммоль
n0(OH−) = 0,064·64 = 4,096 ммоль
|
n0(H+) > n0(OH–)
|
n0(H+) < n0(OH–)
|
n0(H+) = n0(OH–)
|
n0(H+) = 1,012 < n0(OH−) = 4,096
|
n(H+) = n0(H+) – n0(OH−), 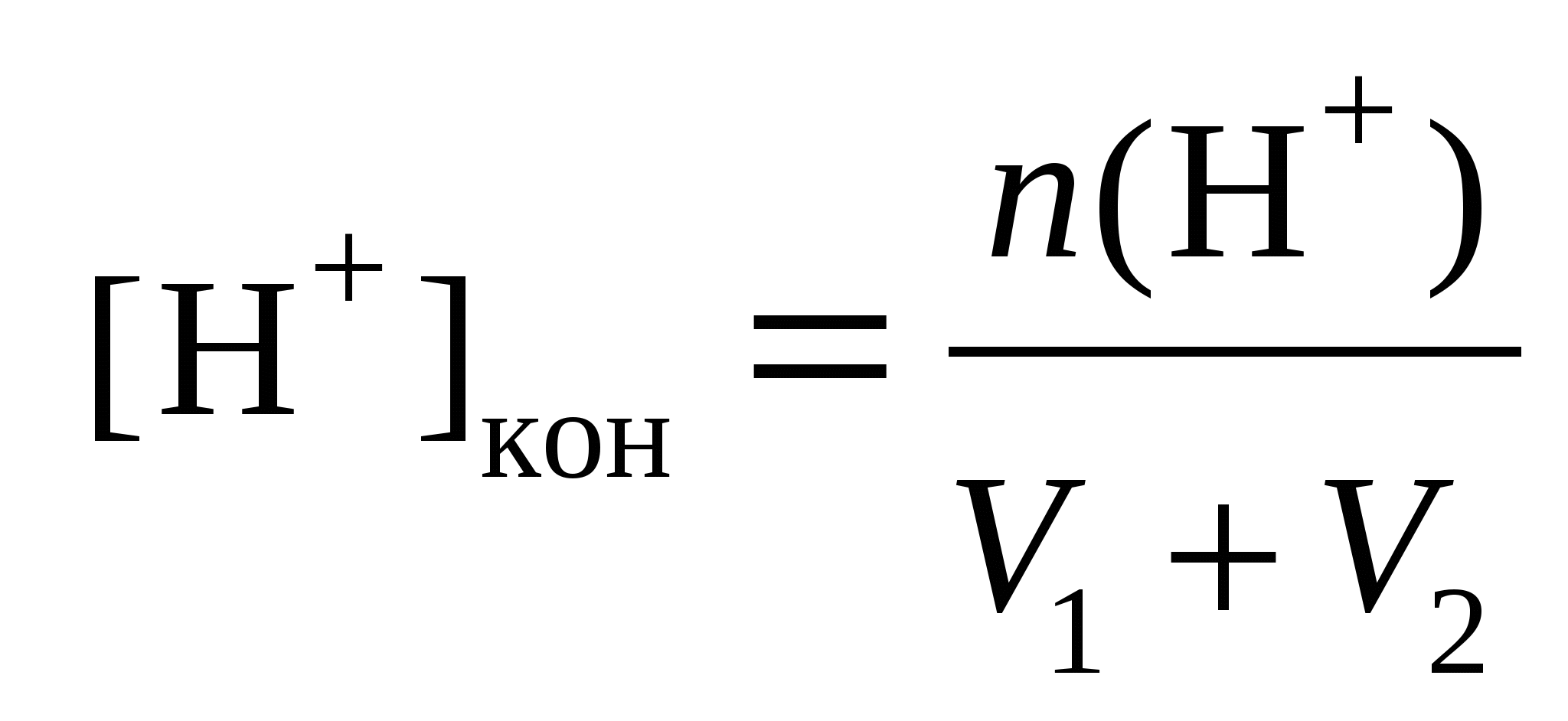 моль/л, моль/л,
рН = –lg[H+]кон
|
n(OH−) = n0(OH−) –n0(H+),
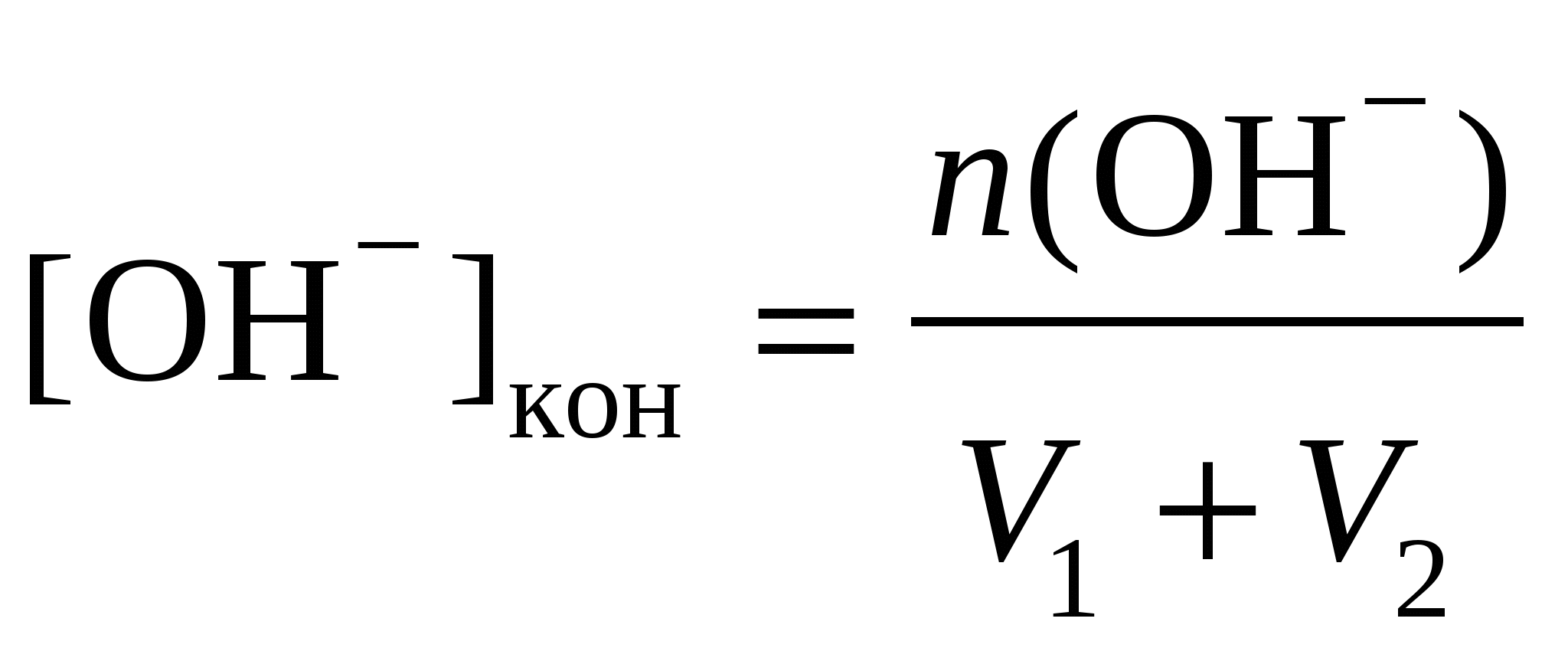 моль/л, моль/л,
рН = 14 + lg[OH−]кон
|
рН = 7
|
n(OH−) = 4,096 –1,012 = 3,084 ммоль,
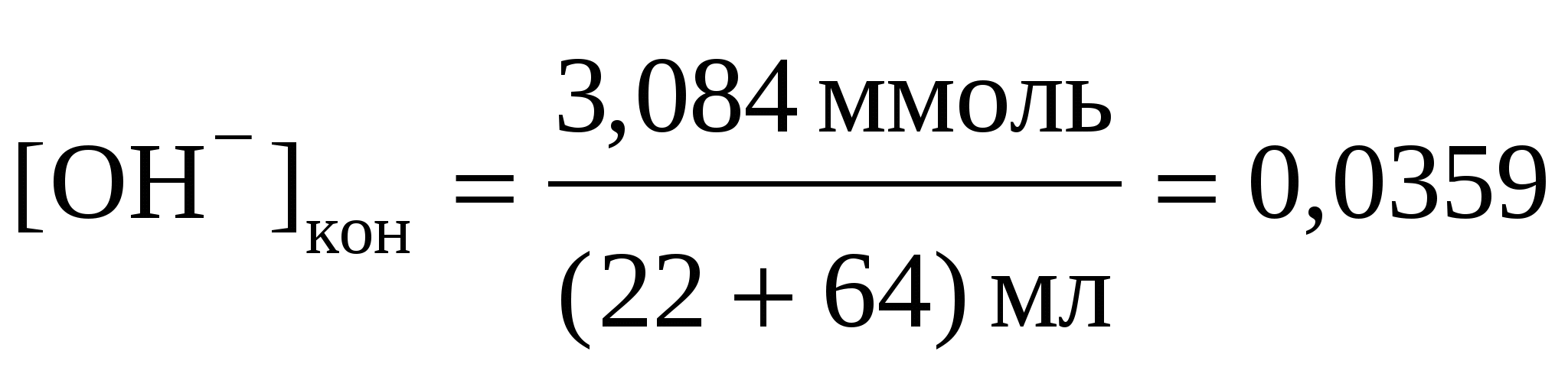 моль/л, моль/л,
рН = 14 + lg0,0359 = 12,56
|
6. Нахождение [H+], рН и pOH в c М растворе слабой кислоты, константа диссоциации которой равна Ka
ОБЩИЙ ВИД
|
ПРИМЕР
|
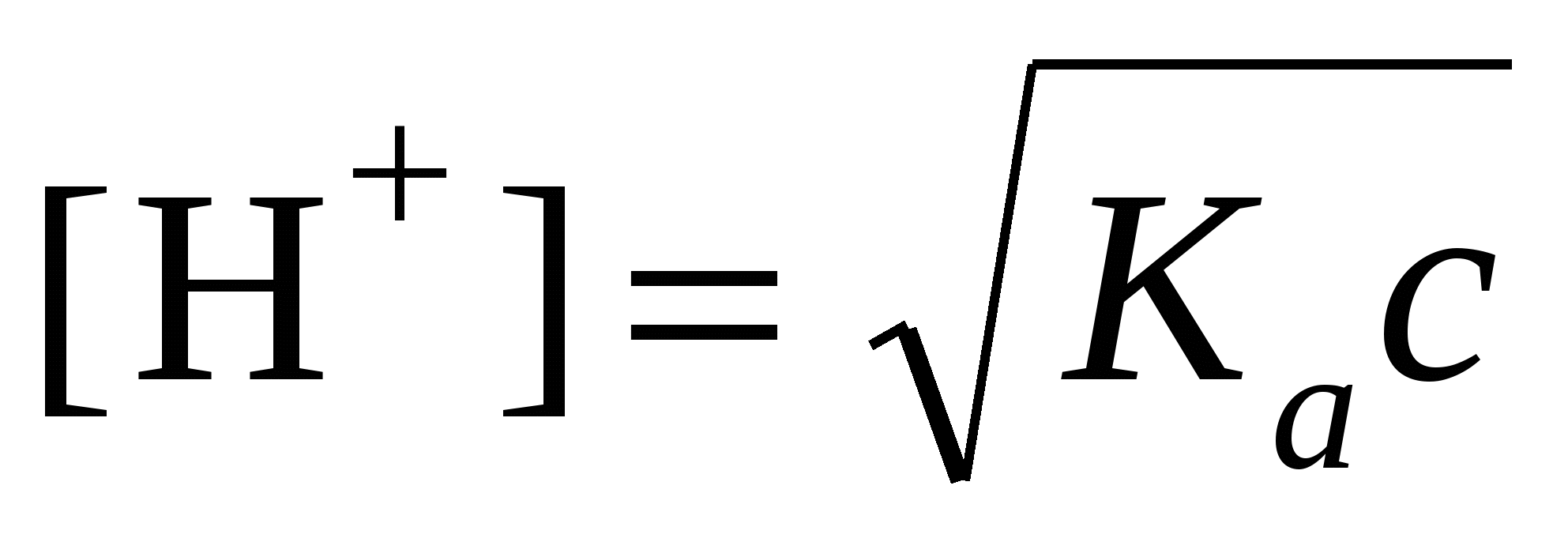 моль/л; моль/л;
pH = –lg[H+]; pOH = 14 – рН
|
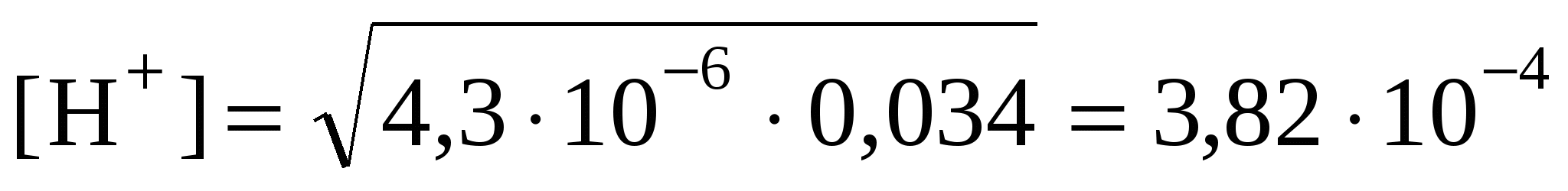 моль/л; моль/л;
pH = –lg(3,82·10–4) = 3,42; pOH = 14 – 3,42 = 10,58
|
Решение задач на гидролиз
1. Уравнения диссоциации солей
ОБЩИЙ ВИД
|
ПРИМЕР
|
формула соли
|
уравнение гидролиза
|
формула соли
|
уравнение гидролиза
|
M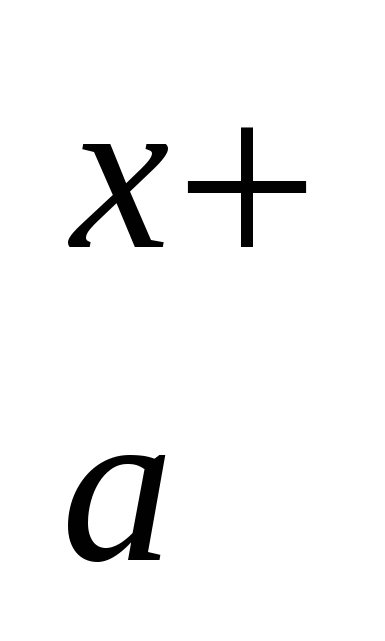 An An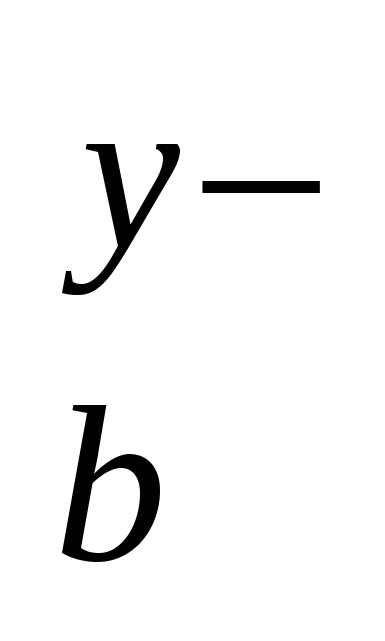
|
M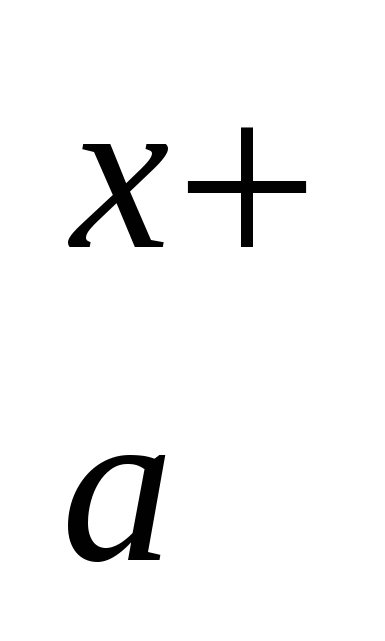 An An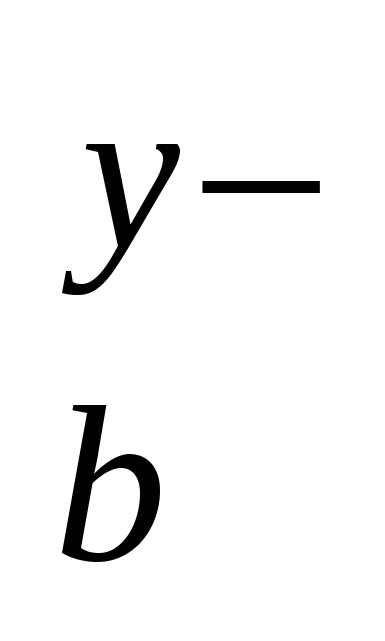 → a Μx+ + b Any– → a Μx+ + b Any–
|
Fe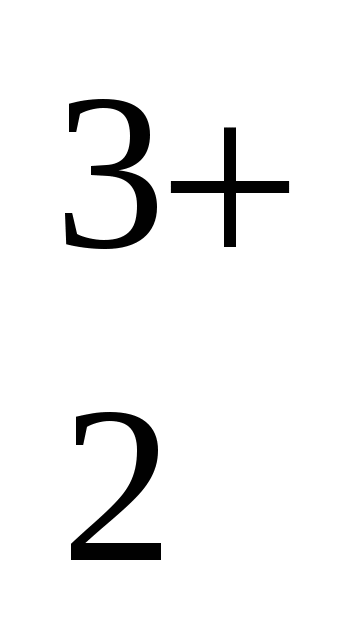 (SO (SO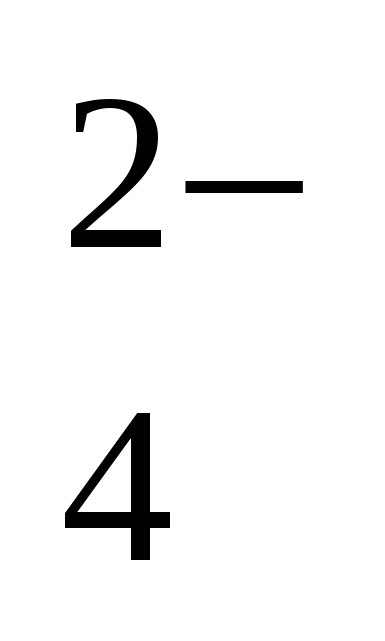 )3 )3
|
Fe2(SO4)3 → 2 Fe3+ + 3 SO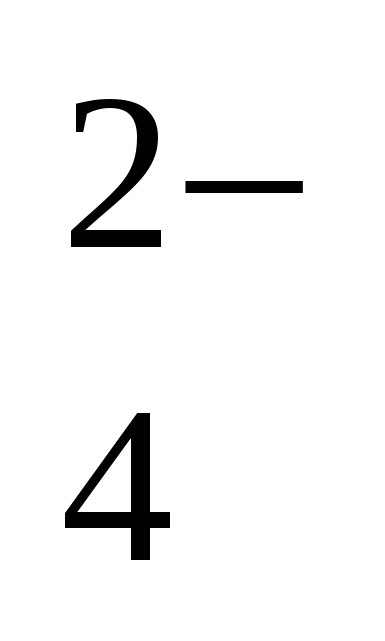
|
2. Определение типов солей
ОБЩИЙ ВИД
|
формула соли
|
основание
|
кислота
|
формула
|
сила (сил./сл.)
|
формула
|
сила (сил./сл.)
|
M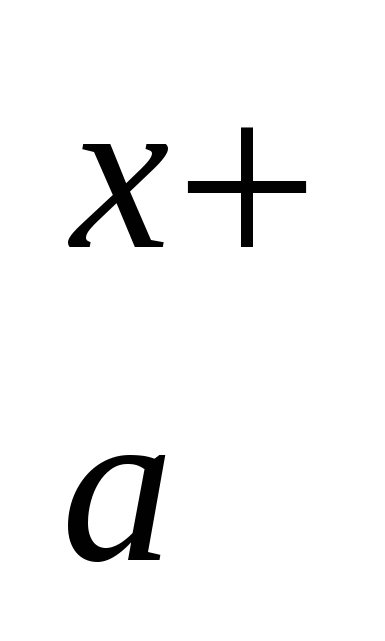 An An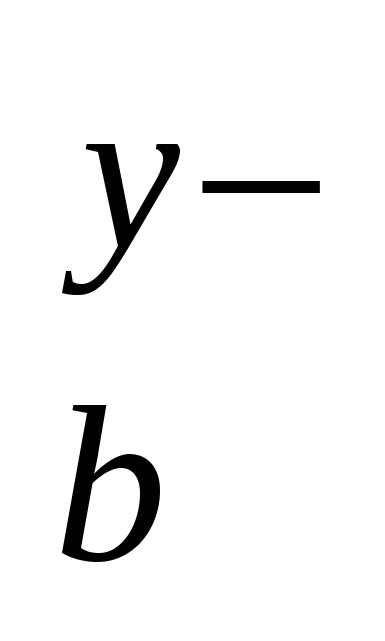
|
Μ(OH)x
|
см. табл. «Сильные
кислоты и основания»
|
HyAn
|
см. табл. «Сильные кислоты
и основания»
|
ПРИМЕР
|
Fe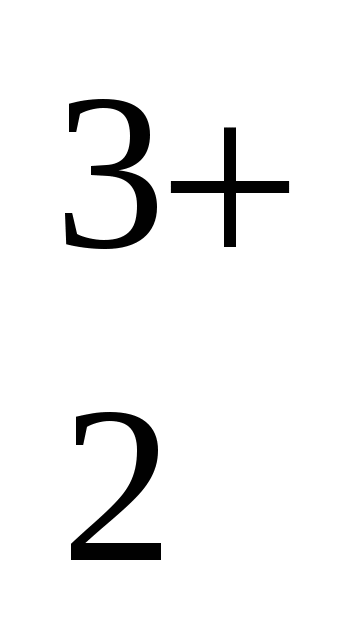 (SO (SO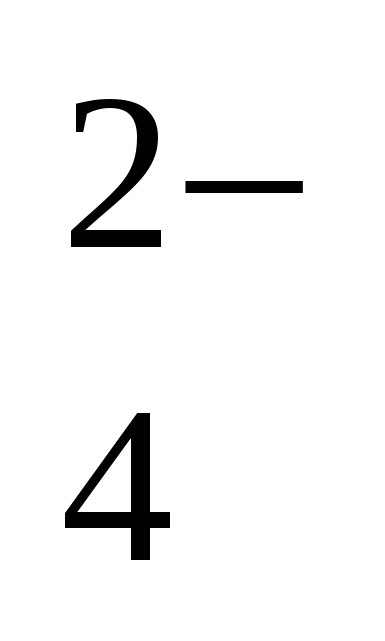 )3 )3
|
Fe(OH)3
|
сл.
|
H2SO4
|
сил.
|
3. Определение типов гидролиза
ОБЩИЙ ВИД
|
ПРИМЕР
|
тип
соли
|
сил. осн-ия и
сл. к-ты
|
сл. осн-ия и
сил. к-ты
|
сил. осн-ия и
сил. к-ты
|
сл. осн-ия и
сл. к-ты
|
Fe2(SO4)3 – соль сл.
осн-ия и сил. к-ты
|
тип
гидролиза
|
по аниону
|
по катиону
|
по обоим ионам
|
отсутствие
гидролиза
|
по катиону
|
4. Краткие ионные уравнения гидролиза
ОБЩИЙ ВИД
|
ПРИМЕР
|
тип
соли
|
сил. осн-ия и
сл. к-ты
|
сл. осн-ия и
сил. к-ты
|
сил. осн-ия и сил. к-ты
|
сл. осн-ия и
сл. к-ты
|
Fe2(SO4)3 – соль сл.
осн-ия и сил. к-ты
|
уравнение
гидролиза
|
Any– + H2O ⇄
OH– + HAn(y−1)−
|
Μx+ + H2O ⇄ H+ + ΜOH(x–1)+
|
—
|
Μx+ + Any–+ H2O ⇄
ΜOH(x−1)+ + HAn(y–1)–
|
Fe3+ + H2O ⇄
H+ + FeOH2+
|
5. Нахождение рН с М растворов солей
ОБЩИЙ ВИД
|
ПРИМЕР
|
тип соли
|
расчет рН (Kaи Kb–см. табл. «Константы последних ступеней диссоциации…»)
|
Fe2(SO4)3 – соль сл.
осн-ия и сил. к-ты
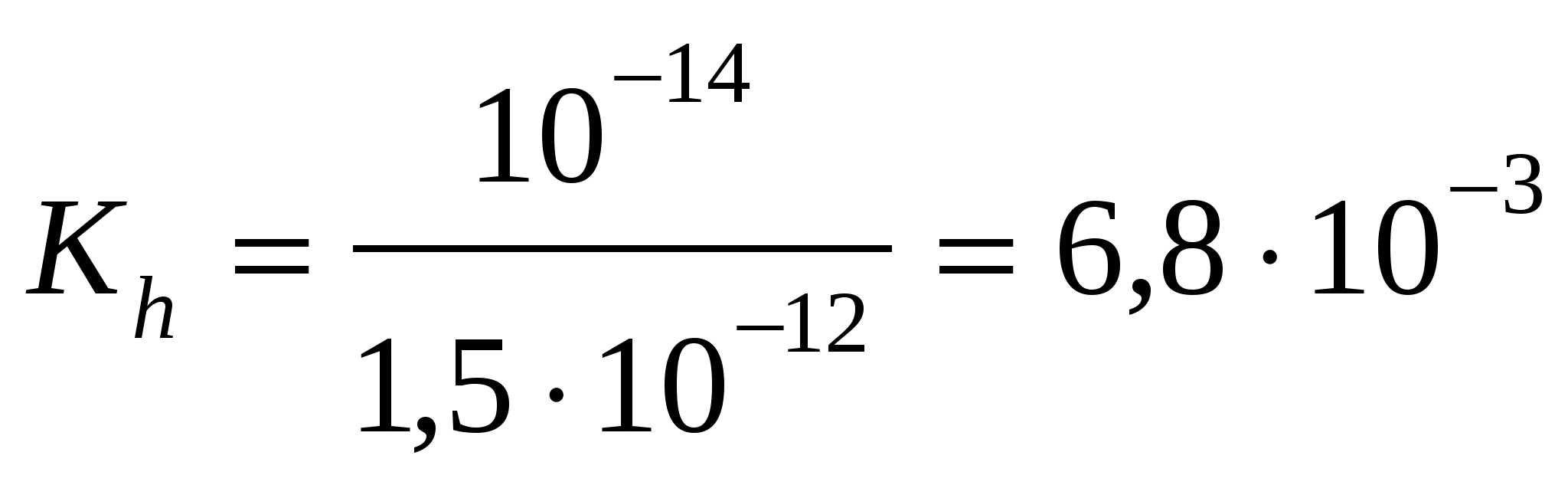 ; ;
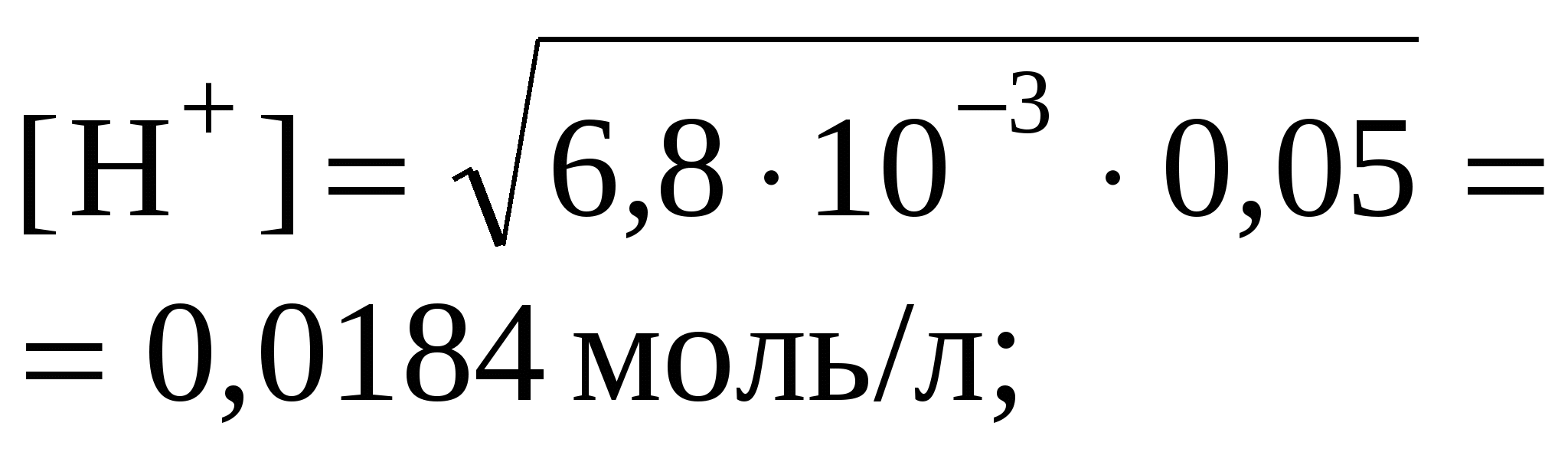
pH = –lg0,0184 = 1,74
|
сил. осн-ия и сл. к-ты
|
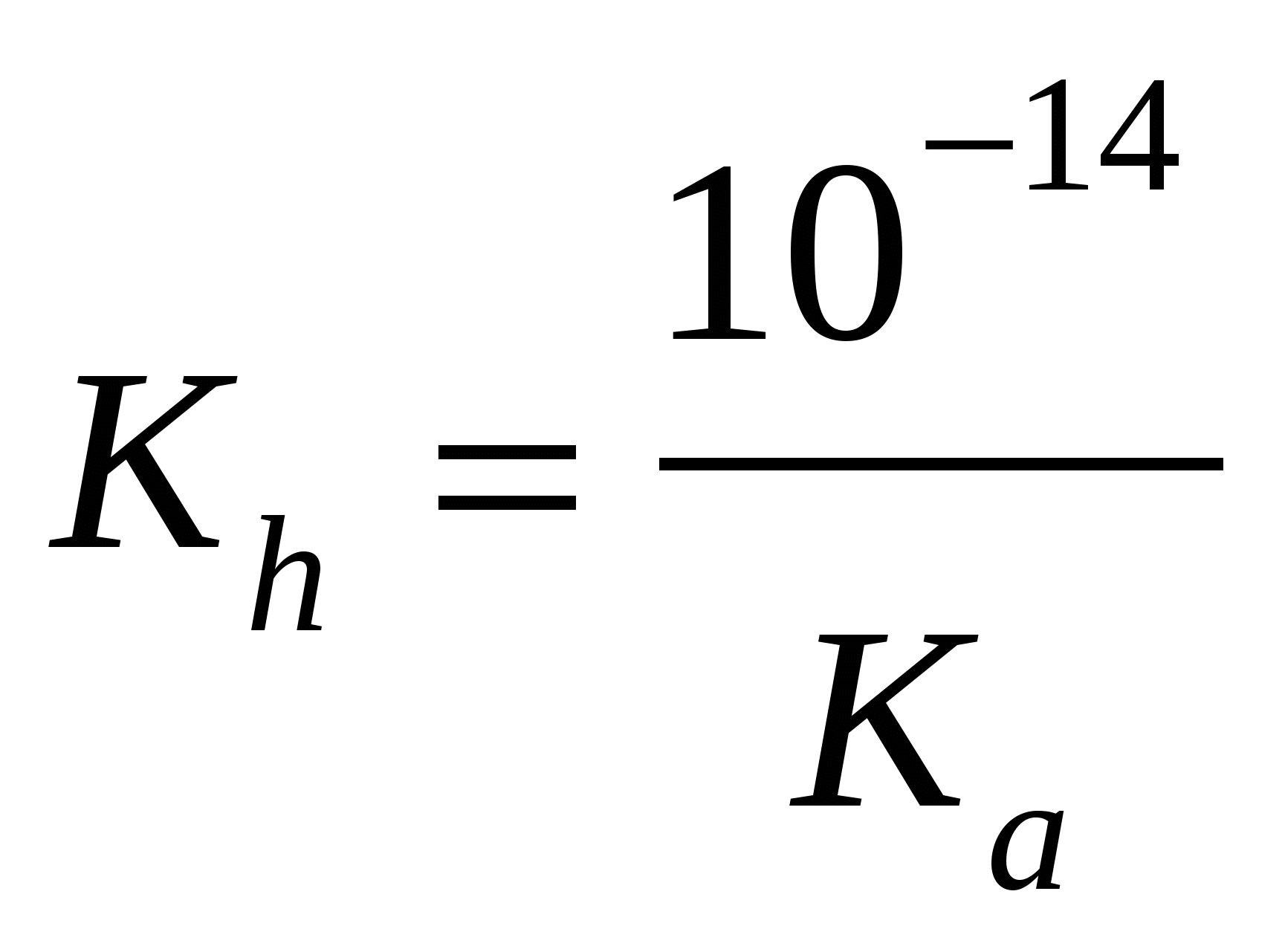 ; ; 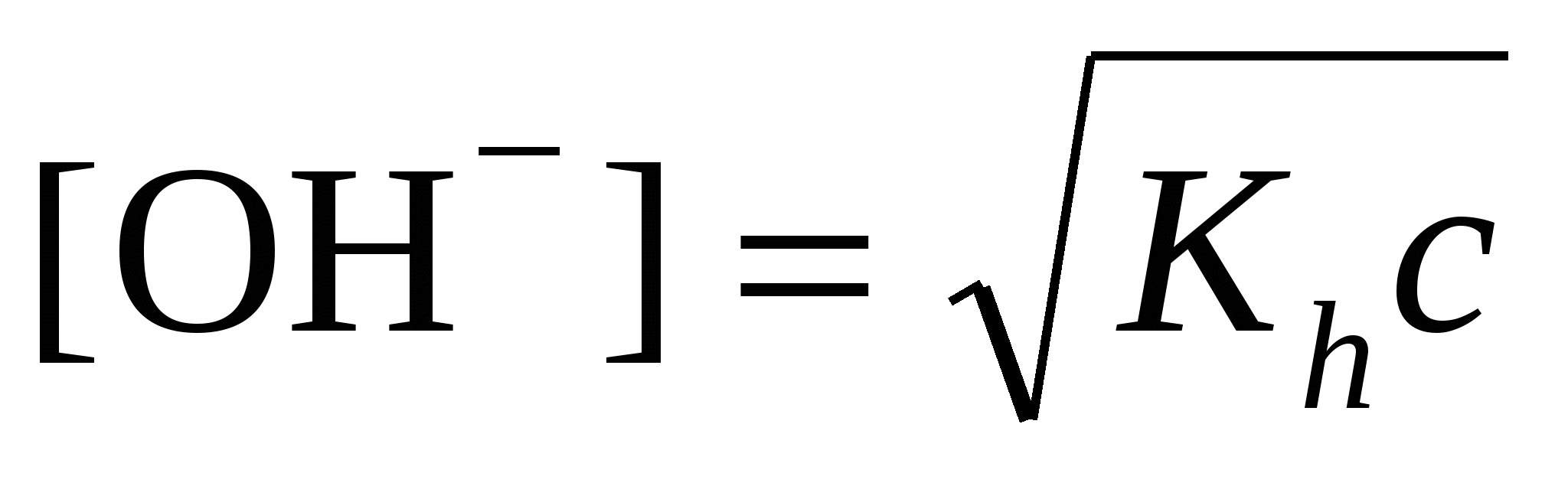 моль/л; pH = 14 + lg[OH–] моль/л; pH = 14 + lg[OH–]
|
сл. осн-ия и сил. к-ты
|
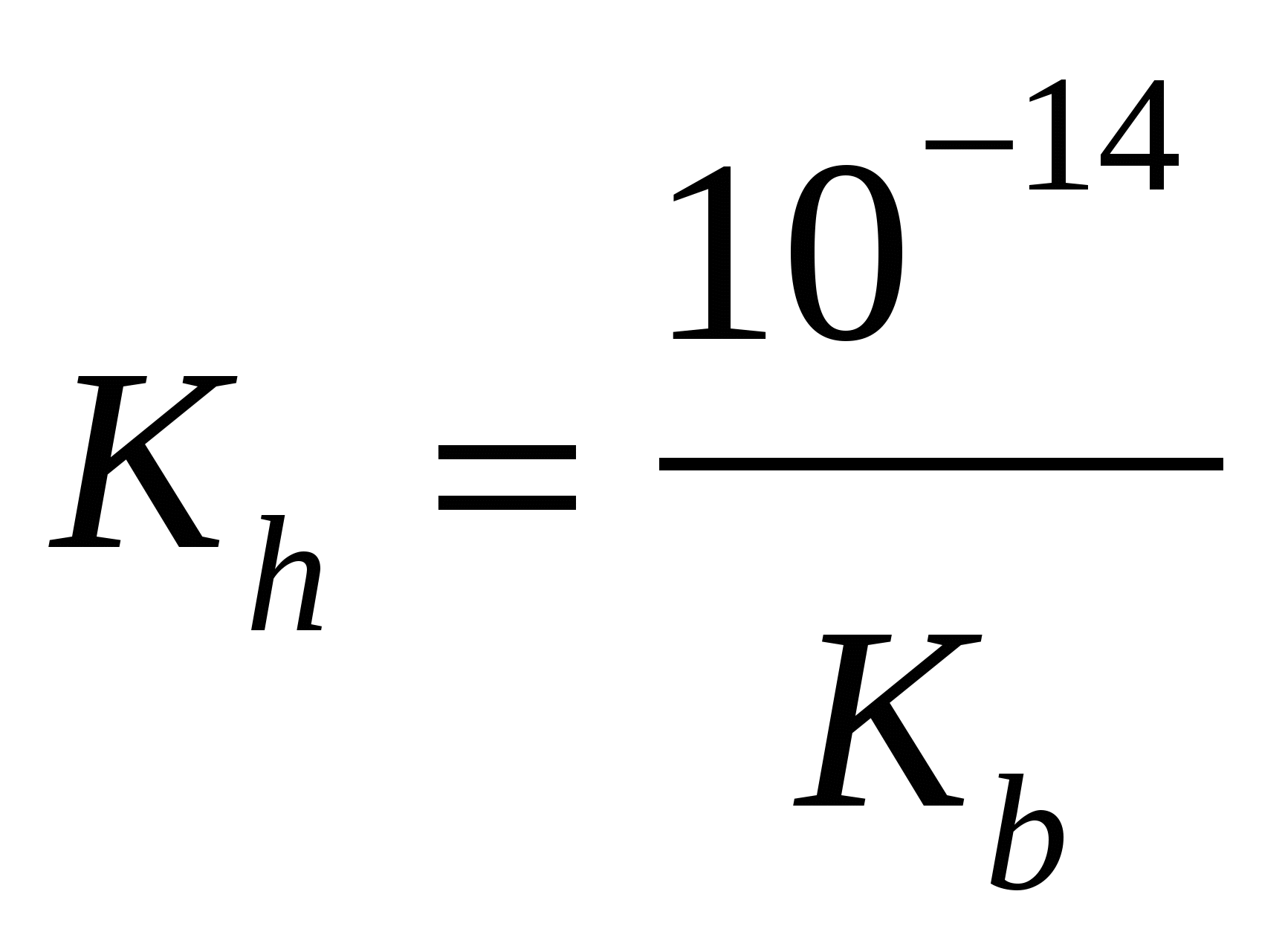 ; ; 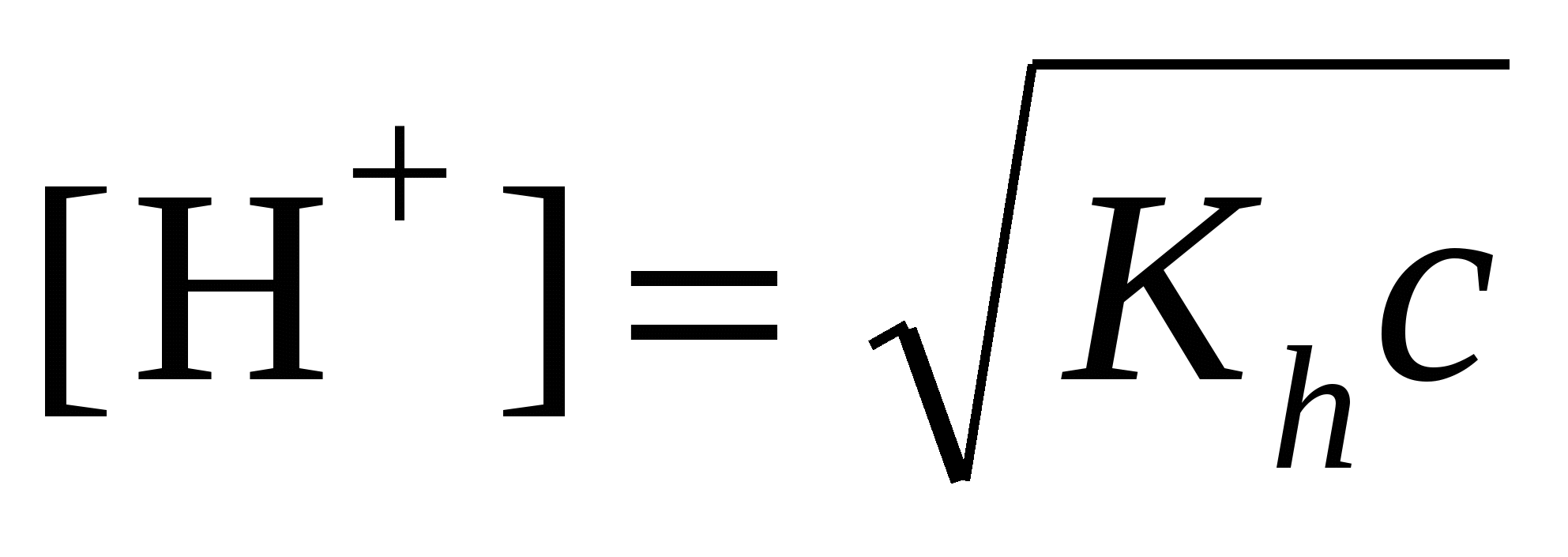 моль/л; pH = –lg[H+] моль/л; pH = –lg[H+]
|
сил. осн-ия и сил. к-ты
|
рН = 7
|
сл. осн-ия и сл. к-ты:
|
а) формула соли Μ An An
|
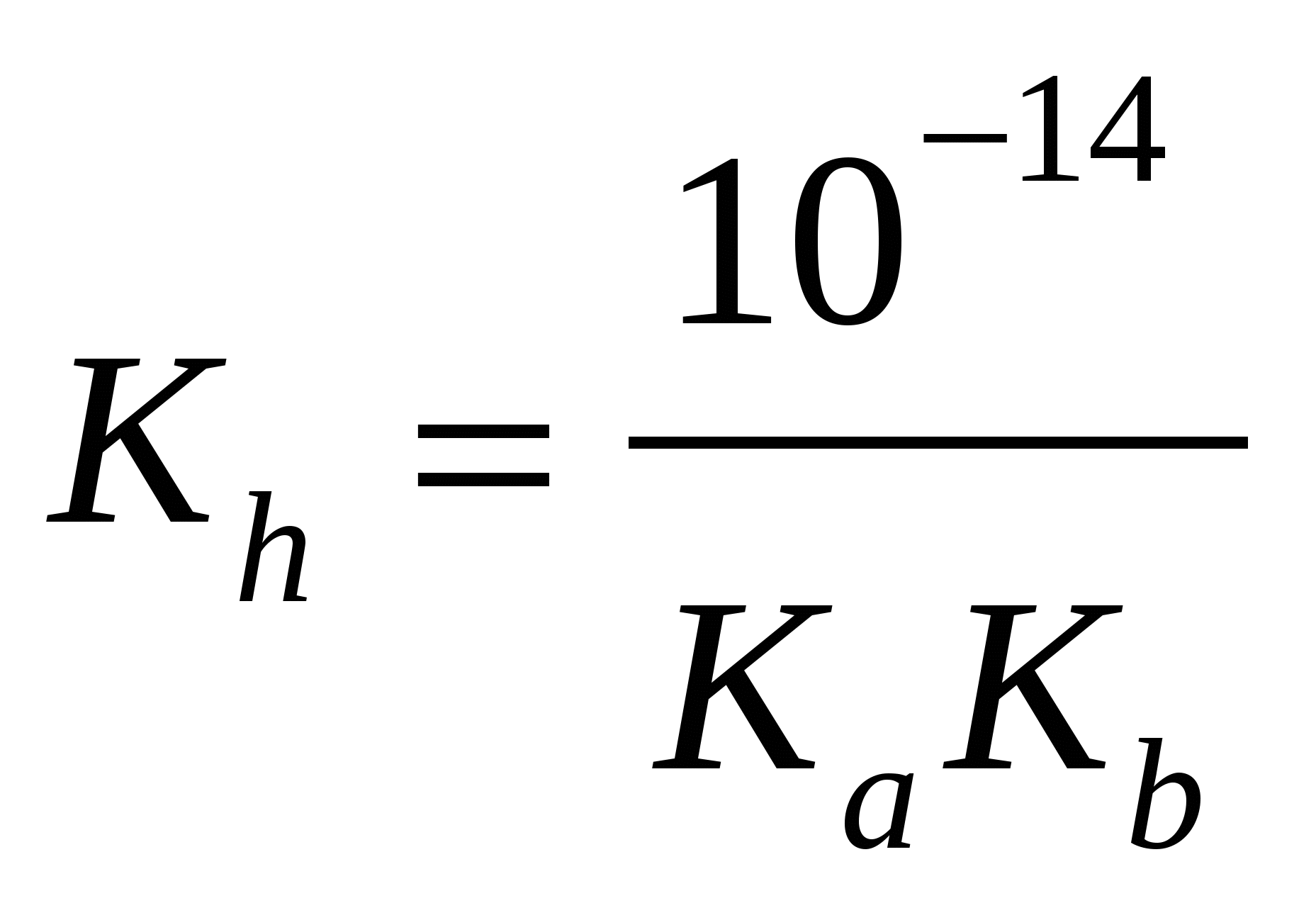 ; ; 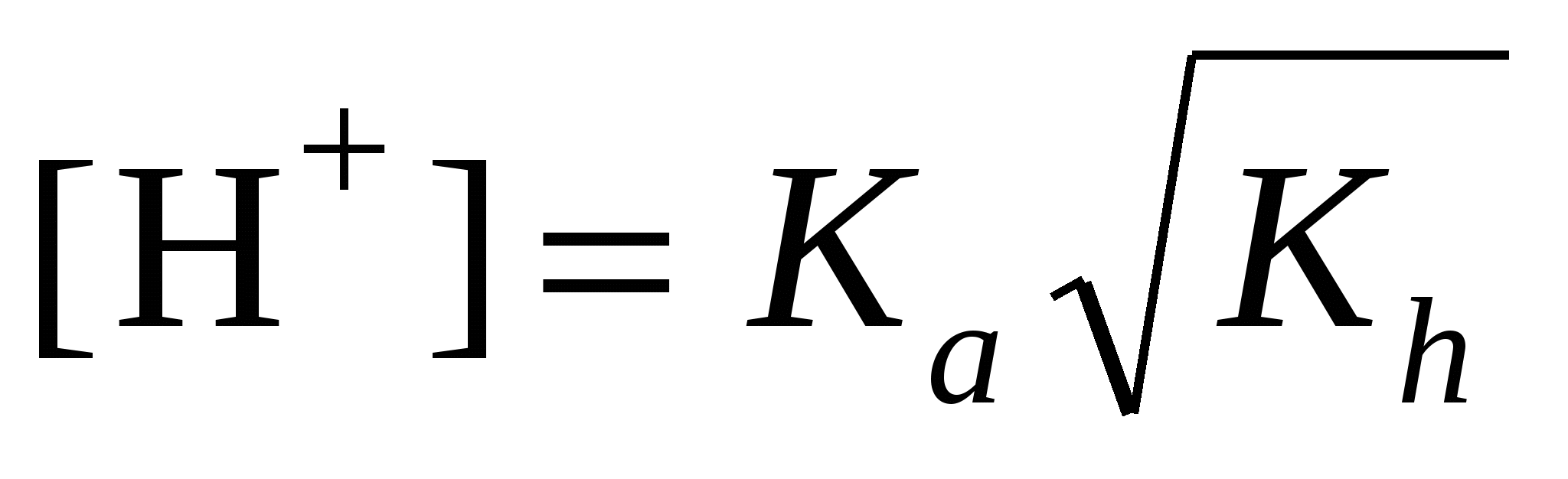 моль/л; pH = –lg[H+] моль/л; pH = –lg[H+]
|
б) формула соли Μ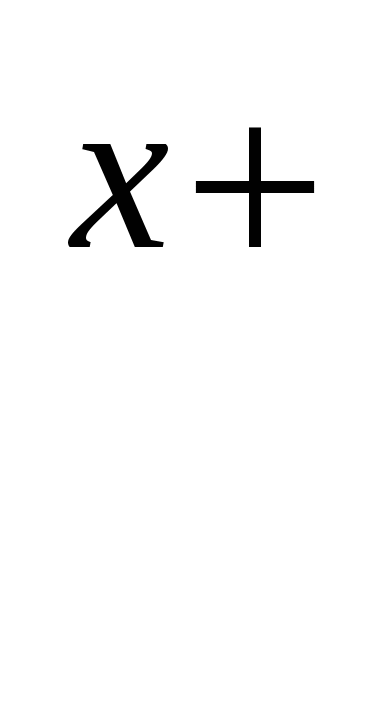 An An
|
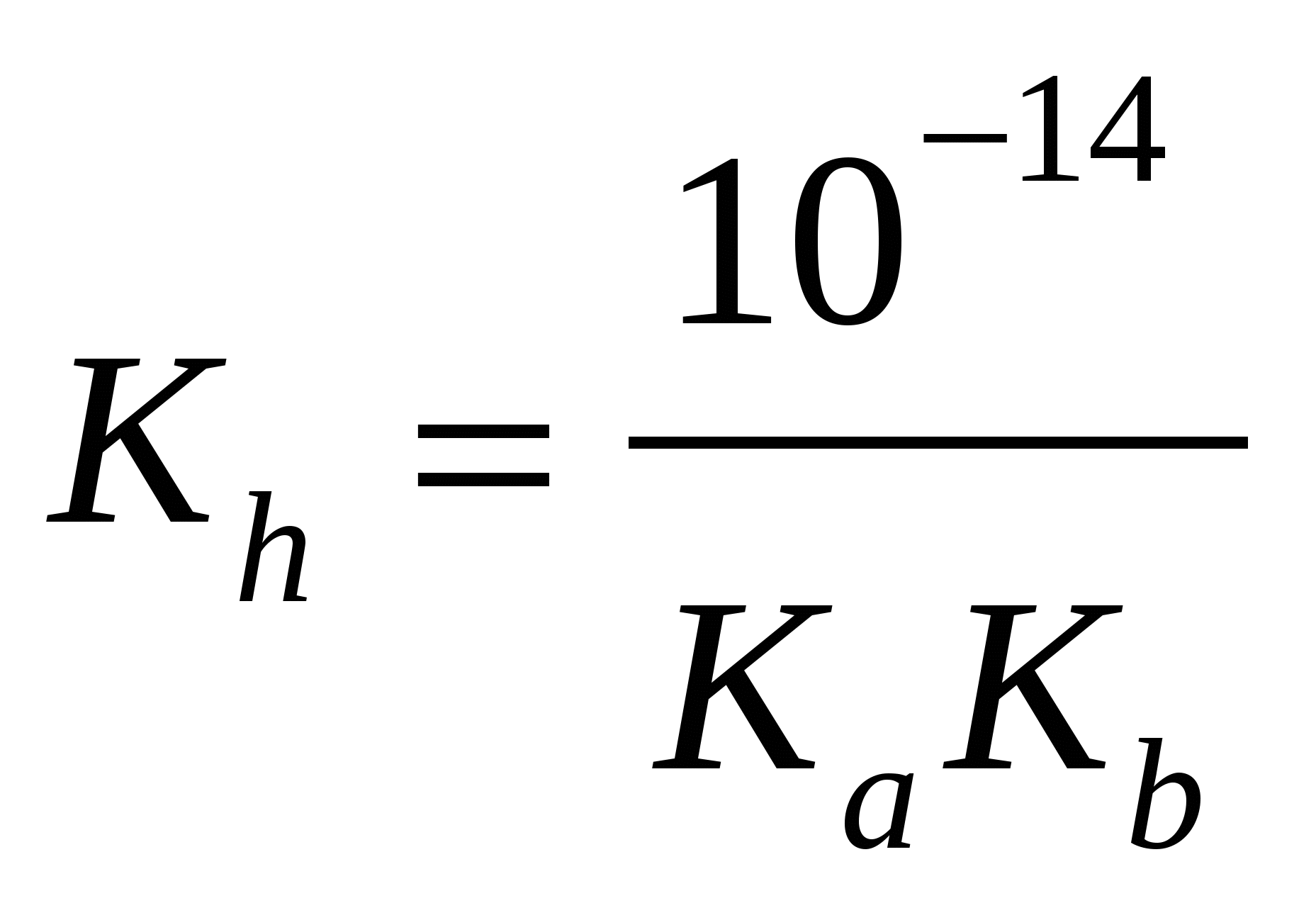 ; ; 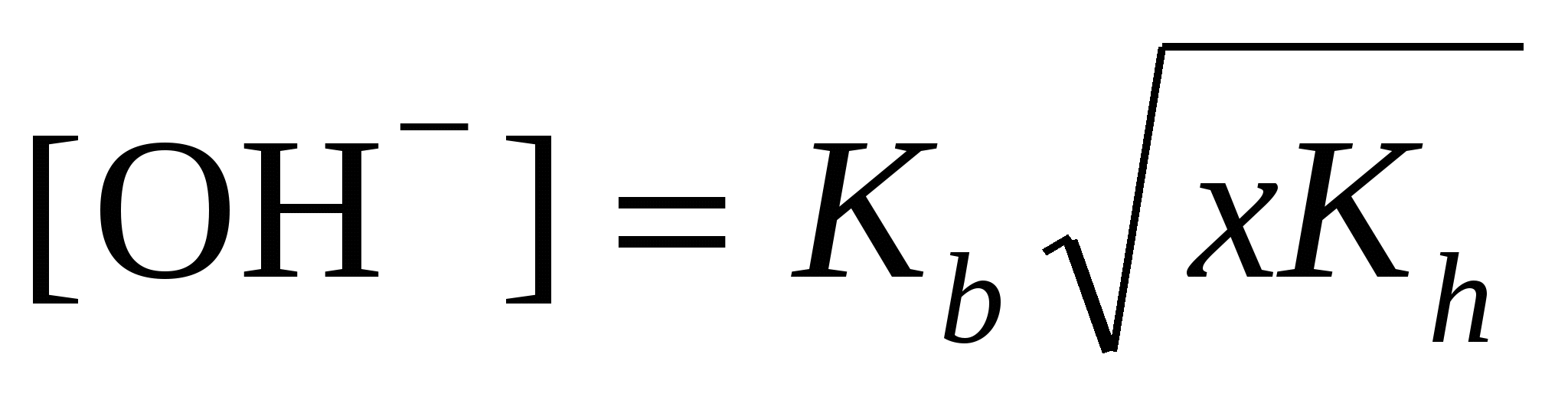 моль/л; моль/л;
pH = 14 + lg[OH–]
|
в) формула соли Μ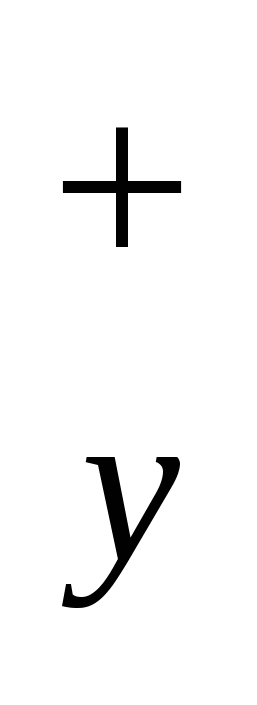 An An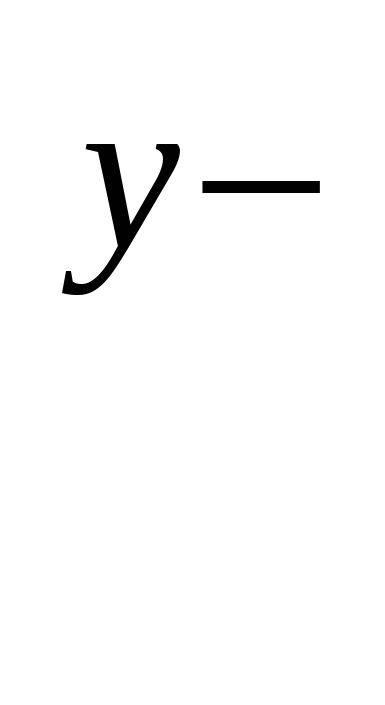
|
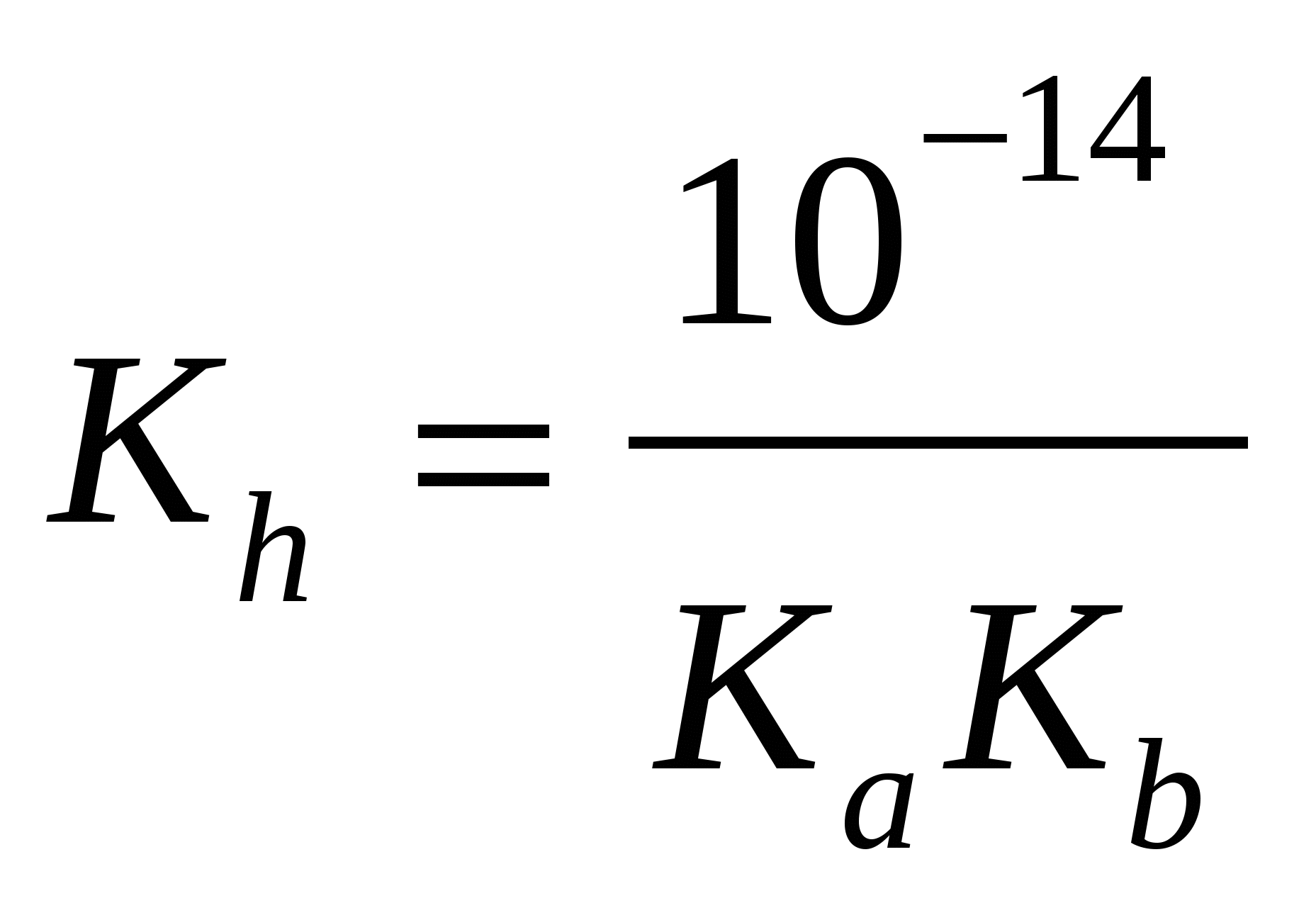 ; ; 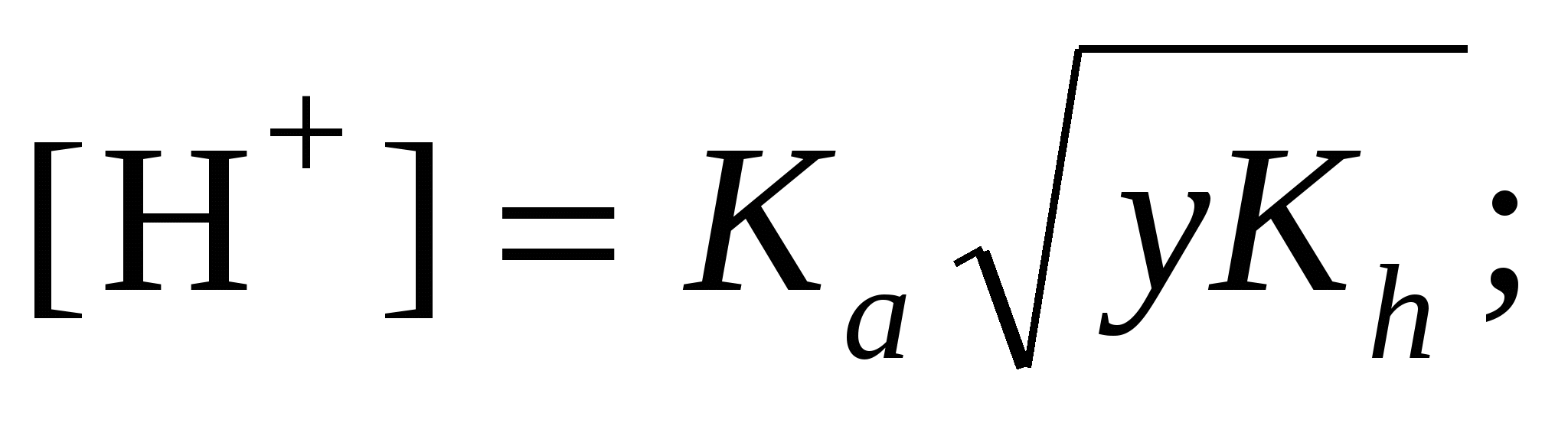 pH = –lg[H+] pH = –lg[H+]
|
6. Определение среды раствора по значению рН
рН
|
ОБЩИЙ ВИД
|
ПРИМЕР
|
7
|
> 7
|
< 7
|
рН = 1,74 <7
|
Среда раствора
|
нейтральная
|
щелочная
|
кислая
|
кислая
| |
|
|
 Скачать 169 Kb.
Скачать 169 Kb.