Решение расчётных задач по теме растворы. Решение задач по теме Растворы
 Скачать 75.5 Kb. Скачать 75.5 Kb.
|
|
Решение задач по теме «Растворы» В разбавленном растворе, приготовленном из гидросульфата магния и воды, сумма коэффициентов в уравнении необратимой диссоциации растворенного вещества равна Решение: M 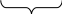 g(HSO4)2 → Mg2+ +2H+ + 2SO42- g(HSO4)2 → Mg2+ +2H+ + 2SO42-разлагается, т.к. H2SO4 -сильная кислота Сумма коэффициентов равна 6. Приготовленном из гидрокарбоната кальция и воды: С 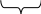 а(НСО3)2 → Са2+ + 2НСО3- а(НСО3)2 → Са2+ + 2НСО3-не разлагается, т.к. Н2СО3 –слабая кислота Сумма коэффициентов равна 4. Приготовленном из оксида стронция и воды: SrO + H2O = Sr(OH)2 Sr(OH)2 → Sr2+ + 2OH- Сумма коэффициентов равна 4. Определить сумму коэффициентов в сокращенном ионном уравнении реакции FeCl3 + NaOH →. FeCl3 + 3NaOH = Fe(OH)3 + 3 NaCl Fe3+ + 3Cl- + 3Na+ + 3OH- = Fe(OH)3 + 3Na+ + 3Cl- Fe3+ + 3OH- = Fe(OH)3 (1+3+1=5) 3. Для уравнения реакции Pb(NO3)2 + H2S → сокращенное ионное уравнение запишется в виде: Pb(NO3)2 + H2S = PbS + 2HNO3 Pb2+ + 2NO3- + H2S = PbS + 2H+ + 2NO3- Pb2+ + H2S = PbS + 2H+ Уравнение Ba2 +SO42- = BaSO4 описывает взаимодействие между: 1) Ba(OH)2 и H2SO4; 3) BaCO3 и H2SO4; 2) BaCl2 и PbSO4; 4) Ba(OH)2 и K2SO4. 1) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O Ba2+ + 2OH- + 2H+ + SO42- = BaSO4 + 2H2O Исходное сокращенное ионно-молекулярное уравнение не получено, следовательно, данное молекулярное уравнение не подходит. 2) BaCl2 + PbSO4 = BaSO4 + PbCl2 Ba2+ + 2Cl- + PbSO42- = BaSO4 + PbCl2 (не подходит) 3) BaCO3 + H2SO4 = BaSO4 + H2CO3 BaCO3 + 2H+ + SO42- = BaSO4 + H2CO3 (не подходит) 4) Ba(OH)2 + K2SO4 = BaSO4 +2KOH Ba2+ + 2OH- + 2K+ + SO42- = BaSO4 + 2K+ + 2OH- Ba2+ + SO42- = BaSO4 Т.е. это молекулярное уравнение соответствует данному в задании сокращенному ионно-молекулярному уравнению – ответ 4. 5. Определить какое молекулярное уравнение соответствует данному сокращенному ионному уравнению MnS + 2H+ = Mn2+ + H2S Необходимо сначала подобрать растворимую соль марганца, а затем уже написать формулу соответствующей сильной кислоты. MnS + 2HNO3 = Mn(NO3)2 + H2S MnS + 2H+ + 2NO3- = Mn2+ + 2NO3- + H2S MnS + 2H+ = Mn2+ + H2S MnS + 2HCl = MnCl2 + H2S MnS + 2H+ + 2Cl- = Mn2+ + 2Cl- + H2S MnS + 2H+ = Mn2+ + H2S Для подавления гидролиза фторида калия следует: а) добавить кислоту; б) добавить щелочь; в) разбавить раствор водой; г) повысить температуру.   К F КF → К+ + F- К F КF → К+ + F-КOH HF Гидролиз идет по аниону F-. сильное слабая F- + Н+ОН-<=>HF+OH- - щелочн. среда рН>7 основание кислота КF + Н2О<=> HF + КOH Чтобы подавить гидролиз, необходимо сместить равновесие реакции влево (если в задании требуется усилить гидролиз, то равновесие нужно сместить вправо). а) Если добавить кислоту, то равновесие гидролиза сместится вправо и гидролиз усилится, т.к. в результате образуется слабый электролит – вода (по правилу Бертолле: реакции протекают в направлении образования слабого электролита): F- + Н+ОН-<=>HF+OH- HCl → H+ + Cl- б) Если добавить щелочь, то равновесие гидролиза сместится влево и гидролиз ослабеет, т.к. в правой части уравнения увеличится концентрация гидроксид – ионов (по принципу Ле – Шателье: равновесие реакции смещается в направлении, которое ослабляет внешнее воздействие): F- + Н+ОН-<=>HF+OH- NaOH → Na+ + OH- в) Разбавление раствора соли усиливает гидролиз (касается всех солей). г) Гидролиз – процесс эндотермический, поэтому повышение температуры усиливает гидролиз (касается всех солей). Ответ (б). Значение рН растворов веществ увеличивается в ряду: 1) Na2CO3 и ZnCl2 3) KCl и BeSO4 2) CaS и Cu(NO3)2 4) MnSO4 и BaCO3 Решение: Шкала рН рН увеличивается если: 0  7 14 1) кислая → нейтральная; 7 14 1) кислая → нейтральная;   2) кислая → щелочная; 2) кислая → щелочная;кислая щелочная 3) нейтральная → щелочная. Если соль образована слабым основанием и сильной кислотой, то среда – кислая. Если соль образована сильным основанием и слабой кислотой, то среда – щелочная. Если соль образована слабым основанием и слабой кислотой, либо сильным основанием и сильной кислотой, то среда – нейтральная. Таким образом, значение рН увеличивается, если первая соль дает кислую (или нейтральную) среду, а вторая – щелочную, либо первая соль дает кислую среду, а вторая – нейтральную. Na2CO3 (щелочная среда) и ZnCl2 (кислая среда); CaS (щелочная среда) и Cu(NO3)2 ( кислая среда); KCl (нейтральная среда) и BeSO4 (кислая среда); MnSO4 (кислая среда) и BaCO3 (щелочная среда). Ответ - 4. Вычислить рН 0,1М раствора HJ. Решение: рН = -lg [H+], т.е. надо найти концентрацию ионов Н+. 0,1моль/л х HJ → H+ + J- 1 моль 1 моль Из уравнения диссоциации кислоты следует: [H+] = [HJ] = 0,1 = 1·10-1 моль/л рН = -lg [H+] = -lg 10-1 = 1 Вычислить рН 0,005М раствора Ва(ОН)2. Решение: 0,005моль/л х Ва(ОН)2 → Ва2+ + 2ОН- 1 моль 2 моль х = 0,005·2 = 0,01 = 1·10-2 моль/л 1 рОН = -lg [ОH-] = -lg 10-2 = 2 рН + рОН = 14 => рН = 14 – рОН = 14 – 2 = 12. Вычислить концентрацию гидроксид – ионов в насыщенном растворе Са(ОН)2, если водородный показатель равен 10. Решение: рОН = 14 – рН = 14 – 10 = 4 рОН = -lg [ОH-] => [ОH-] = 1·10-4 моль/л. Растворимость хлорида свинца (II) составляет 10,58 г/л. Вычислить ПР (PbCl2). Решение: Переведем значение растворимости S = 10.58 г/л в молярную растворимость L (моль/л): L = S/Mв М(PbCl2) = 207 + 2·35,5 = 278 г/моль L(PbCl2) = [PbCl2] = 10,58/278 = 3,93·10-2 моль/л L L 2 L PbCl2 <=> Pb2+ + 2Cl- 1моль 1моль 2моль Следовательно, по уравнению диссоциации: [Pb2+] = L = 3,93·10-2 моль/л [Cl-] = 2L = 7,86·10-2 моль/л ПР(PbCl2) = [Pb2+]·[Cl-]2 = L·(2L)2 = 4 L3 = 2,43·10-6 . Растворимость насыщенного раствора Zn(OH)2 равна 1,49·10-5 / 100 г Н2О. Вычислить ПР(Zn(OH)2). Решение: Т.к. плотность воды равна 1 г/мл, то масса воды равна ее объему и равна 100 мл. Поскольку раствор насыщенный, то воды в нем очень мало, поэтому при решении таких задач принимают объем данного насыщенного раствора равным 100 мл. 1) Находим растворимость Zn(OH)2 в моль/л, т.е. находим его молярную концентрацию: СМ = nв =mв-ва = 1,49·10-5 = 1,5·10-5 моль/л Vр-ра Mв-ва·Vр-ра 99·0,1 2) В насыщенном растворе: 1,5·10-5 1,5·10-5 2·1,5·10-5 Zn(OH)2 <=> Zn2+ + 2OH- 1 моль 1 моль 2 моль По уравнению реакции: [Zn2+] = 1,5·10-5 моль/л; [OH-] = 3·10-5 моль/л 3) Находим ПР(Zn(OH)2): ПР(Zn(OH)2) = [Zn2+]·[OH-]2 = 1,5·10-5·(3·10-5)2 = 1,35·10-14. Чему равна масса (в граммах) сульфата меди в 500 мл 0,25 М раствора CuSO4, плотность которого равна 1,15 г/мл. Рассчитать: а) массовую долю вещества в растворе; б) молярную концентрацию эквивалента; в) титр. Решение: С  М = 0,25 моль/л СМ = nв =mв-ва => М = 0,25 моль/л СМ = nв =mв-ва =>Vр-ра = 500 мл Vр-ра Mв-ва·Vр-ра ρ = 1,15 г/мл mв-ва = СМ· Mв-ва·Vр-ра = 0,25·160·0,5 = 20 г m  в-ва – ? Mв-ва (CuSO4) = 64+32+4·16 = 160 г/моль в-ва – ? Mв-ва (CuSO4) = 64+32+4·16 = 160 г/мольω - ? ω = m в-ва Сэк - ? mр-ра Т - ? mр-ра = Vр-ра·ρ = 500·1,15 = 575 г ω = 20 = 0,0348 или 3,48% 575 Сэк(В)= nэк Vр-ра Количество эквивалентов растворенного вещества: nэк = mв-ва , Мэк(В) Мэк(В) =М(В)·fэк fэк (CuSO4) = 1 = 1 2·1 2 Мэк(В) = 160·1/2 = 80 г/моль·эк nэк = 20 = 0,25 моль·эк 80 Сэк(CuSO4)= 0,25 = 0,5 моль·эк/л 0,5 Однако, есть формула, которая позволяет значительно упростить этот расчет: СМ (В)= Сэк(В) · fэк => Сэк(В) = СМ (В)/ fэк Сэк(CuSO4)= 0,25 = 0,5 моль·эк/л 1/2 Т(CuSO4) = mв-ва= 20 = 0,04 г/мл Vр-ра 500 Сколько моль FeCl3 нужно растворить в 2500 мл воды, чтобы получить раствор с массовой долей хлорида железа 0,02 и плотностью 1,015 г/мл? Рассчитать: а) молярную концентрацию; б) молярную концентрацию эквивалента; в) титр. Решение: V  р-ра = 2500 мл n = mв-ва р-ра = 2500 мл n = mв-ва ω = 0,02 М(В) ρ  = 1,015 г/мл ω = m в-ва = 1,015 г/мл ω = m в-ва n (FeCl3) - ? mр-ра СМ - ? Пусть х г – масса вещества. Сэк - ? mр-ра = m в-ва + m (Н2О), поскольку V(Н2О) = Т - ? m (Н2О) = 2500 г, то имеем 0,02 = х => х + 2500 х = 0,02(х + 2500) х = 0,02х + 50 х – 0,02х = 50 х = 51 г – масса вещества. М (FeCl3) = 56+3·36 = 164 г/моль n(FeCl3) = 51 = 0,31 моль 164 СМ = nв = 0,31 = 0,123 моль/л Vр-ра 2,513 Vр-ра = mр-ра = 2551 = 2513 мл ρ 1,015 mр-ра = m в-ва + m (Н2О) = 51+2500 = 2551 г Сэк(В) = СМ (В)/ fэк fэк (FeCl3) = 1 = 1 3·1 3 Сэк(FeCl3) = 0,123 = 0,369 моль·эк/л 1/3 Т(FeCl3) = mв-ва= 51 = 0,02 г/мл Vр-ра 2500 |
