ПЗ 1 химия. Решение задач. Расчеты концентрации растворов. Расчеты температур кипения, замерзания
 Скачать 45.76 Kb. Скачать 45.76 Kb.
|
|
ПЗ 1Тема:Решение задач. Расчеты концентрации растворов. Расчеты температур кипения, замерзания. Задача 1 Концентрация раствора хлорида кальция CaCl2 в уксусной кислоте составляет 11,1%, масса раствора равна 100 грамм. Рассчитайте, температуры кипения и замерзания этого раствора (К = 3,9 К ∙ кг/кмоль, Е = 3,1 К ∙ кг/кмоль, t зам. = 16,6◦С, t кип. = 118,5◦С). Решение: По закону Рауля:  где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Кк и Кэ – соответственно криоскопическая и эбуллиоскопическая константы растворителя; g- масса растворенного вещества, г; G- масса растворителя, г; Мr- молекулярная масса растворенного вещества; Mr(CaCl2)= Ar (Ca) + Ar (Cl) * 2 = 40 + 35,5 * 2 = 111. Повышение температуры кипения раствора: 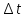 =3.9*1000*11,1/100*111=3,9 °C =3.9*1000*11,1/100*111=3,9 °CТемпература кипения раствора: tкип=118,5+3,9=122,4 °C. Понижение температуры замерзания раствора: 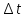 =3.1*1000*11,1/100*111=3,1 °C =3.1*1000*11,1/100*111=3,1 °CТемпература замерзания раствора tзам= 16,6 – 3,1 =13,5°C Задача 2 Имеется 4% раствор NaOH в феноле, масса раствора равна 100 грамм. Рассчитайте температуры кипения и замерзания, если криоскопическая и эбуллиоскопическая постоянные фенола равны соответственно: КС6Н5ОН = 7,27 К ∙ кг/кмоль, ЕС6Н5ОН = 3,1 К ∙ кг/кмоль, t кип. = 182,1◦С, t зам. = 41,0◦С. Решение: По закону Рауля:  где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Кк и Кэ – соответственно криоскопическая и эбуллиоскопическая константы растворителя; g- масса растворенного вещества, г; G- масса растворителя, г; Мr- молекулярная масса растворенного вещества; Mr(NaOH)= 39,997 Повышение температуры кипения раствора: 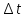 =7,27*1000*4/100*39,997=7,2 °C =7,27*1000*4/100*39,997=7,2 °CТемпература кипения раствора: tкип=182,1+7,2=189,3°C. Понижение температуры замерзания раствора: 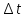 =3.1*1000*4/100*39,997=3,1 °C =3.1*1000*4/100*39,997=3,1 °CТемпература замерзания раствора tзам= 41,0 – 3,1 =37,9 °C Задача 3 Какая среда образуется при растворении солей: а) Al(NO3)3 Среда кислая, тк соль образована от кислоты первая стадия гидролиза Al (NO3) 3 + HOH→ AlOH (NO3) 2+ HNO3 втррая сталия. AlOH (NO3) 2+H2o→ Al (OH) 2NO3+HNO3 третья стадия. б) KNO3 Это соль сильного основания (KOH) и сильной кислоты (HNO3). Соответственно среда будет нейтральная. в) K2SO3 K2CO3 - соль сильного основания, но слабой кислоты (H2CO3). Тогда среда будет щелочная. г) Cs2CO3 Cs2CO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону. Среда щелочная. Задача 4 Масса соли, которая вводится в организм при вливании 353 г 0,85% физиологического раствора, равна (г) Решение 353*0,85/100=3 Ответ: 3 г. Задача 5 К 50 г раствора хлорида кальция с массовой долей 4% добавили 1 г этой же соли и 10 г воды. Массовая доля соли в полученном растворе равна _%. Решение Масса соли при этом процессе не изменяется, она только перераспределяется между раствором и твердым веществом   Ответ 4,9. Контрольные вопросы: В чем заключается закон Вант-Гоффа? Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Каков физический смысл криоскопической и эбулиоскопической констант? По физическому смыслу эбуллиоскопическая и криоскопическая константы — это повышение (безразлично, выражено оно как Δt через градусы Цельсия или ΔT через градусы Кельвина) температуры кипения и понижение температуры кристаллизации раствора, моляльная концентрация которого равна единице. Сделайте вывод. Для расчета нормальной концентрации полученного раствора к свойствам относятся, в первую очередь, осмотическое давление и изменение температур замерзания и кипения растворов по сравнению с соответствующими температурами чистого растворителя. Все растворители имеют определенные температуры замерзания (кристаллизации) и кипения. Присутствие в них растворенного вещества понижает температуру замерзания и повышает температуру кипения на некоторую величину Δt. Для разбавленных растворов неэлектролитов эту величину можно рассчитать по следствию из закона Рауля. |
