Задания по химии с решением. Решение Закон гласит количества эквивалентов вступающих в реакцию веществ равны
 Скачать 64.02 Kb. Скачать 64.02 Kb.
|
|
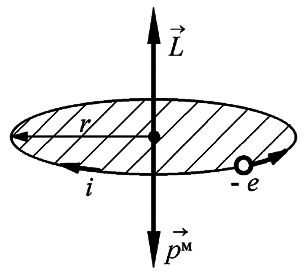
1. При восстановлении 1,17 г оксида олова водородом образовалось 0,16 г воды. Вычислите эквивалентную массу олова. Дано: 1,17 г оксида олова, 0,16 г воды Решение: Закон гласит: количества эквивалентов вступающих в реакцию веществ равны. 0.16г воды — это 0.16*16/18 = 0.1422 г кислорода Исходный оксид олова содержал 1.0278г олова и 0.1422г кислорода. Если атомная масса 118 г/моль, то фактор экв. равен 2, и формула оксида SnO. экв. масса кислорода = 8 г/(моль*экв) кол-во экв. кислорода 0.1422/8 = 0.017775 моль*экв. олова столько же, значит его экв. масса: 1.0278 / 0.017775 = 57.9 г / (моль*экв) Ответ: 57,9 г. 2. Объясните физический смысл орбитального квантового числа. Укажите значения, которые оно может принимать и формы орбиталей, которые им соответствуют. В квантовых состояниях с заданным значением главного квантового числа Из выводов предыдущего параграфа следует, что стационарные волновые функции Следовательно, в любом квантовом состоянии атом обладает определенным значением квадрата момента импульса, причем модуль орбитального момента импульса движущегося в атоме электрона однозначно определяется орбитальным квантовым числом:
Проанализируем эту формулу квантования момента импульса. Сравнивая ее с условием квантования момента импульса движущегося электрона в теории Бора, можно заметить, что эти условия не совпадают. И дело не только в отличии числовых значений, рассчитанных по этим формулам. Принципиальное отличие этих соотношений состоит в том, что в квантовой механике возможны состояния атома с нулевым моментом импульса. Во всех При классическом описании движения электрона в атоме по определенной траектории (орбите) в любом состоянии атом должен обладать ненулевым моментом импульса. Опыт подтверждает существование квантовых состояний атома с нулевыми орбитальными моментами. Следовательно, опыт подтверждает, что только отказ от классического траекторного способа описания движения электрона в атоме позволяет правильно рассчитать и предсказать свойства атома. Вероятностный способ описания движения частиц в квантовой механике является единственно правильным способом описания свойств атомных систем - таков вывод современной физики. Так как движущийся вокруг ядра электрон является заряженной частицей, то такое движение обуславливает протекание некоторого замкнутого тока в атоме, который можно охарактеризовать орбитальным магнитным моментом В теории Бора, когда с позиции классической теории рассматривается круговое движение электрона по орбите радиуса который можно охарактеризовать величиной магнитного момента Связь механического и магнитного моментов при этом определяется гиромагнитным отношением
Так как заряд электрона отрицателен, то для орбитального движения направление вектора магнитного момента Для расчета орбитального магнитного момента в квантовой теории следует определить пространственную плотность электрического тока
Итак, в любом квантовом состоянии атом водорода обладает не только механическим моментом
Здесь универсальная постоянная 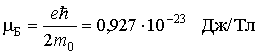 служит единицей измерения магнитных моментов атомов и называется магнетоном Бора. Если атом переходит из одного квантового состояния в другое с испусканием (поглощением) фотона излучения, то возможны лишь такие переходы, для которых орбитальное квантовое число Физический смысл орбитального квантового числа l заключается в том, что оно определяет значение углового момента. Дискретность l определяет дискретные значения L, т.е. величина углового момента квантуется. Для состояния с l = 0 угловой момент равен нулю. 3. Укажите тип кристаллической решетки и характер связи в кристаллах NaCl и Na. Чему равно координационное число натрия в этих решетках? Натрий - элемент IA группы ПСХЭ Д.И. Менделеева, порядковый номер 11, имеет на внешнем энергетическом уровне 1 электрон, следовательно - типичный металл. Металлы могут образовывать всего 2 вида химической связи: а) Металлическая связь (для металлического натрия - простого вещества); б) Ионная химическая связь (в соединения с атомам элементов-неметаллов). Строение кристаллических решеток обусловлено видом химической связи. Для веществ с металлической связью образуется металлическая кристаллическая решетка (в узлах КР находятся атом-ионы натрия, а между ними располагаются делокализованные общие электроны, принадлежащие сразу всем атом-ионам - электронный газ). В случае металлического натрия кристаллическая решетка кубическая гранецентрированная. Вещества с ионной химической связью обладают ионной кристаллической решеткой (в узлах находятся ионы Na+ и Cl-, при этом они чередуются между собой через один). Тип кристаллической решетки в этом случае кубическая. Таким образом один атом натрия в обоих случаях координирует 8 соседних частиц. Значит, координационное число натрия равно 8. 4. Определить, на сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 27 раз (температурный коэффициент (γ) равен 3). Дано: скорость реакции увеличилась в 27 раз (γ) = 3 Решение: По правилу Вант-Гоффа имеем V2/V1 = гамма^ (t2-t1)/10 V2/V1 - отношение скоростей реакций при температурах t2 и t1 (по условию 27) А гамма - температурный коэффициент(по условию 3) 27= 3^(t2-t1)/10 (t2-t1)/10 = 3 t2-t1 = 30 Ответ: на 30 градусов 5. Вычислите энергию Гиббса тепловой денатурации трипсина при 50о С, если при 25оС ∆Н0реакции= 283 кДж/моль, а ∆S0 реакции =288 Дж/(моль·К). Считать, что изменение энтальпии и энтропии не зависит от температуры в данном диапазоне. Дано: ∆Н0реакции= 283 кДж/моль ∆S0 реакции =288 Дж/(моль·К) Решение: Обратите внимание, что T · ΔS° = 323 ∙ 288 ∙ 10–3 = 93,024 кДж/моль, то есть ΔН° > T · ΔS° Ответ: > 0, реакция эндэргоническая за счет энтальпийного фактора. Реакция не может самопроизвольно протекать при данной температуре. 6. Рассчитайте объем раствора с массовой долей карбоната натрия 15% (g=1,16 г/см3), необходимый для приготовления 120 мл 0,45 М раствора Na2СО3. Дано: Доля карбоната натрия 15% (g=1,16 г/см3) 120 мл 0,45 М раствора Na2СО3. 1. Вычислим количество вещества Na2CO3 в 0,45М растворе объемом 120 мл: n(Na2CO3)= C(Na2CO3) ⋅ V(р-ра) = 0,45⋅ 0,12= 0,054 моль 2. Масса вещества составит: m(Na2CO3)= n(Na2CO3) M(Na2CO3)= 0,054 ·106 = 5,72 г 3. Вычислим массу раствора с массовой долей Na2CO3 0,15 mр—ра (Na2CO3)= m(Na2CO3)\ω(Na2CO3)=5,72\0,15 = 38,13 г 4. Vр—ра(Na2CO3)= mр—ра (Na2CO3)\ρр—ра(Na2CO3) = 38,13\1,16 = 32,8 мл Ответ: 32,8 мл 7. В желудке содержится соляная кислота, которая практически полностью диссоциирует в водных растворах. Рассчитайте рН желудочного сока, если массовая доля HCl в нем составляет в норме 0,05%. Плотность желудочного сока принять равной 1 г/см3. Дано: 0,05 % HCl в 100 г жел. сока. Решение: n(HCl)=m/M=0,5/36,5=0,014 моль при плотности жел. сока=1, мол. концентрация С (HCl)=n/V=0,014/0,1=0,14 моль/л HCl=H+ + Cl+ [H+]=C=0,14 моль/л pH=-lg[H+]=0,86 Ответ: 0,86 8. Запишите уравнение Гендерсона-Хасельбаха для расчета рН фосфатной и гидрокарбонатной буферной системы. Формула для расчета рН буферного раствора: рН = рК о + lg C о /С с Это уравнение Гендерсона – Хассельбаха. Для фосфатной буферной системы HPO42-/H2PO4- pH можно рассчитать по уравнению: 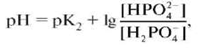 где K2 - константа диссоциации ортофосфорной кислоты по второй ступени. к гидрокарбонатной буферной системе (уравнение Гендерсона-Гассельбаха) имеет следующий вид: рН = 6,1 + lg ; рН = 6,1 + lg. где s´ -коэффициент растворимости СО2 в воде при парциальном давлении 101 кПа. 9. Имеются два раствора хлорида кальция и хлорида натрия с одинаковой процентной концентрацией 0,85% и одинаковой плотностью 1 г\мл при температуре 310 К. Будут ли эти растворы изотоничны по отношению друг к другу? Дано: хлорид натрия – 0,85% Плотность - 1 г/мл С-310 К. Решение: Моляльная концентрация соли в растворе равна:
сm (ZnCl2) = 0,85 г/136 г/моль 0,125 кг = 0,05 моль/кг; По закону Рауля понижение температуры кристаллизации без учета диссоциации электролита составляет: Ткр = Kкр сm = 1,86 град/кг моль 0,05 моль/кг = 0,093 град. Сравнивая найденное значение с экспериментально определенным понижением температуры кристаллизации, определяем изотонический коэффициент i: i = Ткр.эксп. / Ткр.выч. = 0,23/0,093 = 2,47. Зная изотонический коэффициент, можно найти кажущуюся степень диссоциации соли:
Ответ: = 0,735 10. Составьте ионные и молекулярные уравнения реакции гидролиза CH3COONH4 и рассчитайте Kг. (KдNH4OH = 1,8·10–5, KдCH3COOH=1,8·10–5). CH3COONH4 + HOH = NH4OH + CH3COOH CH3COO(-) + NH4(+) + HOH = NH4(+) + OH(-) + CH3COO(-) + H(+) NH4(+) + HOH = NH4(+) + H(+) + OH(-) CH3COONH4+ HOH ↔ NH4OH + CH3COOH. КД (NH4OH) = 1,8 · 10-5 рК = -ℓg КД = - ℓg 1,8 · 10-5 = -(ℓg 1,8 - ℓg 10-5) = -0,26 = 5 = 4,74. Определяем интервал буферного действия по формуле: рОН = рК ± 1. рОН = 4, 74 ± 1; рН = 3,74 -5,74. Ответ: значение рОН = 4,74 входит в интервал рК 3,74 – 5,74, поэтому такой аммиачный буфер можно приготовить. 11. Используя электронно-ионный метод, определите стехиометрические коэффициенты методом в следующей ОВР: Н2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O Уравнения полуреакций выгляд так(в скобках степени окисления): S(2-)-2e = S(0), Cr2O7(2-)+14H(1+) +6e=2Cr(3+) + 7H2O. Т. о. коэффицент для серы 3. Полное уравнение: 3H2S+K2Cr2O7+4H2SO4 = 3S+Cr2(SO4)3+K2SO4+7H2O 12. Вычислите ЭДС марганцево-никелевого гальванического элемента (–)Мn/MnSO4׀׀NiSO4/Ni(+), если образующие его электроды опущены в растворы солей с одинаковой активностью катиона (Е0Mn/Мn2+ = – 1,05 B, Е0Ni/Ni 2+= –0,23 В). Mn | Mn+2 || Ni+2| Ni Ео (Mn(2+)/Mn) = − 1,18 В Ео (Ni(2+)/Ni) = − 0,25 B Поскольку в схеме гальванического элемента слева записывается анод, а справа – катод, то в данном гальваническом элементе анодом является алюминиевый электрод, а катодом – цинковый. В гальваническом элементе анодом становится металл, обладающего меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала. Поскольку марганец в ряду стандартных электродных потенциалов (электрохимическом ряду напряжений) стоит левее никеля, следовательно, марганец имеет меньший стандартный электродный потенциал восстановления, чем никель. Значит, в гальваническом элементе марганцевый электрод будет анодом, а никелевый – катодом. На аноде протекает процесс окисления, а на катоде – процесс восстановления. Процессы окисления-восстановления на электродах. Анод (-) Mn(0) – 2е = Mn(2+) | 1 – окисление на аноде Катод (+) Ni(2+) + 2e = Ni(0) | 1 – восстановление на катоде Суммируя реакции на аноде и катоде, получаем уравнение токообразующей реакции, которое в ионной форме, выражает происходящую в элементе реакцию. Mn + Ni(2+) → Mn(2+) + Ni Стандартная ЭДС гальванического элемента. ЭДСо = Ео (катода) – Ео (анода) = Ео (Ni(2+)/Ni) - Ео (Mn(2+)/Mn) = − 0,25 − (− 1,18) = 0,93 В Стандартная ЭДС гальванического элемента соответствует молярной концентрации ионов Mn(2+) и Ni(2+) в растворах электролитов равной 1моль/л. Список используемой литературы 1. https://ru.wikipedia.org/wiki/Оксид_меди(II) 2. https://studfile.net/preview/5364605/page:4/ 3. https://infopedia.su/13x4f13.html | ||||||||||||||||||||||||||||||||||||||||||

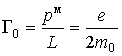 .
.