ответы ЭТМ. Роль электротехнических материалов
 Скачать 1.55 Mb. Скачать 1.55 Mb.
|
|
Сегнетоэлектрики. Главное свойство сегнетоэлектриков — наличие зависимости относительной диэлектрической проницаемости от напряженности электрического поля. Сегнетоэлектрики имеют доменную структуру, причем в пределах каждого домена все электрические дипольные моменты сориентированы друг относительно друга. (Наличие доменной структуры в сегнетоэлектриках, имеющей формальное сходство с доменной структурой магнитных материалов, дало основание для названия сегнетоэлектриков «ферроэлектриками». Сегнетоэлектрики относятся к полярным диэлектрикам с упоря- доченным расположением дипольных электрических моментов. Снижение избыточной электростатической энергии достигается за счет самопроизвольного разбиения сегнетоэлектрика на макроскопические области — домены размером 0,01-1 мкм, обладающие спонтанной поляризацией. Направление электрических моментов у соседних доменов противоположно или перпендикулярно. При этом электрические моменты доменов ориентируются по принципу «голова» к «хвосту». Внешнее электрическое поле Е создает поток электрической индукции D внутри сегнетоэлектрика. Этот поток изменяет направление электрических моментов доменов, создавая эффект очень сильной поляризации. Поэтому сегнетоэлектрики характеризуются сверхбольшими значениями относительной диэлектрической проницаемости. Наличие доменов существенно сказывается на свойствах сегнетоэлектрика. Под действием электрического поля доменные границы смещаются так, что объемы доменов, поляризованных по полю, увеличиваются за счет объемов доменов, поляризованных против поля. Доменные границы обычно «закреплены» на дефектах и неоднородностях в кристалле, и необходимы электрического поля достаточной величины, чтобы их перемещать по образцу. В сильном поле образец целиком поляризуется по полю — становится однодоменным. После выключения поля в течение длительного времени образец остается поляризованным. Необходимо достаточно сильное электрическое поле противоположного направления, называется коэрцитивным, чтобы суммарные объемы доменов противоположного знака сравнялись. В сильном поле происходит полная переполяризация образца. Зависимость электрической индукции D образца от напряженности электрического поля Е нелинейная и имеет вид петли гистерезиса. Температурная зависимость ε сегнетоэлектрика имеет вид кривой с экстремумом. Резкий спад ε после температуры Кюри (Тк) связан с тепловой разориентацией электрических дипольных моментов в доменах. Первым материалом, у которого были обнаружены сегнетоэлектрические свойства, была сегнетова соль (в честь нее эти материалы получили свое название), которая в XVII веке использовалась для врачевания ран. В настоящее время широко применяются такие сегнетоэлектрики как титанат бария (BaTiO3), титанат кальция (СaTiO3), титанат стронция (SrTiO3) и другие. Сегнетоэлектрики используются для создания варикондов (нелинейных конденсаторов), для которых характерна зависимость емкости от напряженности электрического поля. 5.Композиционные материалы на основе слюды Композитные материалы, изготовленные на основе щипаной слюды, состоят из частичек слюды и полимерного связующего. Существует три вида таких композиций: миканит, микалента и микафолий. Широкое распространение получили слюдяные бумаги. От традиционной бумаги они отличаются только составом. Слюдяная бумaга так же, как и целлюлозная, отливается из пульпы (частички слюды в жидкости, как правило, в воде) на бумагоделательных машинах. Важнейший процесс при изготовлении слюдяных бумаг — процесс измельчения слюды. В зависимости от применяемого метода измельчения получают слюдинитовую либо слюдопластовую бумагу. При производстве слюдинитовой бумаги для расщепления применяется термохимический метод. При производстве слюдопластовой бумаги используется механический способ измельчения на многовалковом прокатном станке. В обоих случаях требуется дальнейшее расщепление слюды с помощью гидравлических методов. В качестве сырья для слюдобумаг используют отходы слюдяных заводов: для слюдинитовой бумаги — мусковит, для слюдопластовой — флогопит и мусковит. Слюдинитовая и слюдопластовая бумаги — полуфабрикаты. Из них изготавливают различные изоляционные материалы, такие как слюдинит, слюдопласт. Бумаги вытесняют КМ на основе щипаной слюды, так как они более дешевые и менее трудоемки в изготовлении. Из этих бумаг изготавливают широкую гамму различных материалов. Пассивные и активные диэлектрики. Сегнетоэлектрики. Пассивные или линейные диэлектрики характеризуются отсутствием зависимости относительной диэлектрической проницаемости от напряженности электрического поля меньшей величины электрической прочности диэлектрика. Пассивные диэлектрики — это электроизоляционные материалы. Yдельное электрическое сопротивление должно стремиться к максимуму. При этом следует различать два случая: если материал используется только как электрический изолятор, то относительную диэлектрическую проницаемость стремятся уменьшить до минимума. Это будет способствовать уменьшению вероятности возникновения паразитных наводок в электрической схеме. Кроме того, при использовании пассивного диэлектрика в печатных платах уменьшение ε способствует увеличению быстродействия; 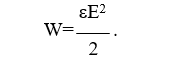 если пассивный диэлектрик используется как конденсаторный материал, то относительную диэлектрическую проницаемость стремятся увеличить до максимума, так как это приводит к увеличению электрической энергии (W), запасенной в конденсаторе: если пассивный диэлектрик используется как конденсаторный материал, то относительную диэлектрическую проницаемость стремятся увеличить до максимума, так как это приводит к увеличению электрической энергии (W), запасенной в конденсаторе: Представители пассивных диэлектриков: оксид алюминия (Al2O3), оксид магния (MgO), диоксид кремния (SiO2), полиэтилен, полипропилен, тефлон и др. Активные диэлектрики — диэлектрики, у которых имеются специфические зависимости ε, γ, коэффициента прохождения электромагнитной волны через материал, а также показателя преломления света от напряженности электрического поля. Активный диэлектрик также называется нелинейным диэлектриком или управляемым, так как его свойства изменяются под воздействием электрического поля или другого внешнего энергетического фактора. Ассортимент и виды активных диэлектриков постоянно расши- ряются, особенно в последние десятилетия, что связано с развитием электро- и радиотехники, оптоэлектроники. Существует достаточно большое количество различных групп активных диэлектриков. Основные группы представлены и кратко охарактеризованы ниже. Сегнетоэлектрики. Главное свойство сегнетоэлектриков — наличие зависимости относительной диэлектрической проницаемости от напряженности электрического поля. Сегнетоэлектрики имеют доменную структуру, причем в пределах каждого домена все электрические дипольные моменты сориентированы друг относительно друга. (Наличие доменной структуры в сегнетоэлектриках, имеющей формальное сходство с доменной структурой магнитных материалов, дало основание для названия сегнетоэлектриков «ферроэлектриками». Сегнетоэлектрики относятся к полярным диэлектрикам с упоря- доченным расположением дипольных электрических моментов. Снижение избыточной электростатической энергии достигается за счет самопроизвольного разбиения сегнетоэлектрика на макроскопические области — домены размером 0,01-1 мкм, обладающие спонтанной поляризацией. Направление электрических моментов у соседних доменов противоположно или перпендикулярно. При этом электрические моменты доменов ориентируются по принципу «голова» к «хвосту». Внешнее электрическое поле Е создает поток электрической индукции D внутри сегнетоэлектрика. Этот поток изменяет направление электрических моментов доменов, создавая эффект очень сильной поляризации. Поэтому сегнетоэлектрики характеризуются сверхбольшими значениями относительной диэлектрической проницаемости. Наличие доменов существенно сказывается на свойствах сегнетоэлектрика. Под действием электрического поля доменные границы смещаются так, что объемы доменов, поляризованных по полю, увеличиваются за счет объемов доменов, поляризованных против поля. Доменные границы обычно «закреплены» на дефектах и неоднородностях в кристалле, и необходимы электрического поля достаточной величины, чтобы их перемещать по образцу. В сильном поле образец целиком поляризуется по полю — становится однодоменным. После выключения поля в течение длительного времени образец остается поляризованным. Необходимо достаточно сильное электрическое поле противоположного направления, называется коэрцитивным, чтобы суммарные объемы доменов противоположного знака сравнялись. В сильном поле происходит полная переполяризация образца. Зависимость электрической индукции D образца от напряженности электрического поля Е нелинейная и имеет вид петли гистерезиса. Температурная зависимость ε сегнетоэлектрика имеет вид кривой с экстремумом. Резкий спад ε после температуры Кюри (Тк) связан с тепловой разориентацией электрических дипольных моментов в доменах. Первым материалом, у которого были обнаружены сегнетоэлектрические свойства, была сегнетова соль (в честь нее эти материалы получили свое название), которая в XVII веке использовалась для врачевания ран. В настоящее время широко применяются такие сегнетоэлектрики как титанат бария (BaTiO3), титанат кальция (СaTiO3), титанат стронция (SrTiO3) и другие. Сегнетоэлектрики используются для создания варикондов (нелинейных конденсаторов), для которых характерна зависимость емкости от напряженности электрического поля. 7.ЭЛЕМЕНТЫ ЗОННОЙ ТЕОРИИ ТВЕРДОГО ТЕЛА Электроны в атоме могут занимать только определенные разрешенные орбиты. Иными словами, электроны находятся на определенных энергетических уровнях, что иллюстрируется энергетической диаграммой. При этом, чем дальше от атомного ядра находится электрон, тем больше его энергия. На каждом энергетическом уровне может находиться не более двух электронов с антипараллельными спинами. Подобное утверждение вытекает из общей формулировки принципа Паули: в любом заданном состоянии может находиться не более одного электрона, определенного квантовыми числами: l, n, m, s. l, n, m — определяют орбиту электрона в атоме; s — определяет спин электрона (↓↑). Если в случае изолированного атома электроны занимают определенные энергетические уровни, то в твердом теле вследствие взаимного влияния всей совокупности электронов уровни расщепляются на подуровни и образуются зоны — заполненная (валентная), запрещенная (энергетическая щель) и свободная (зона проводимости) Электрон в свободной зоне более слабо связан с ядром, т. е. он «квазисвободен». Отсюда следует второе название зоны — «зона проводимости». Зоны могут перекрываться или заполняться частично, что характерно для проводников, имеющих высокую концентрацию квазисвободных электронов. 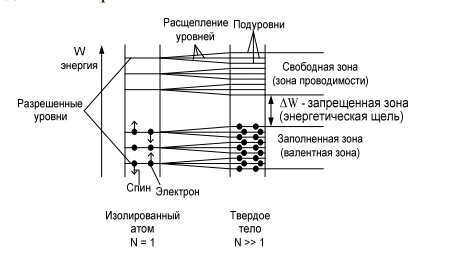 Ширина запрещенной зоны (∆W) важная характеристика материала. ∆W измеряется в электрон-вольтах [эВ]. 1 эВ = 1,6·10^- 19 Дж — это энергия, которую приобретает электрон, проходя в пространстве расстояние между точками, разность потенциалов которых равна 1 В. По величине ∆W электротехнические материалы можно разделить на проводники, полупроводники и диэлектрики 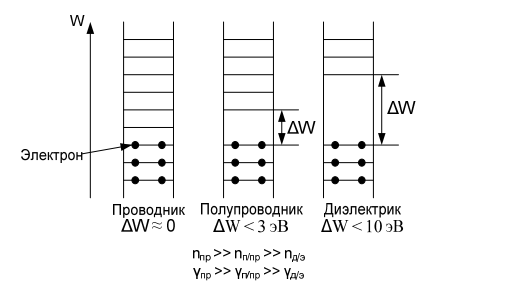  8. Виды химической связи. Ковалентная и ионная связи. 1)Ковалентная связь Ковалентная связь (гомеополярная связь) образуется за счет электронов с антипараллельными спинами, являющимися общими для пары атомов . Связь эта жестко локализована в пространстве. Энергия связи зависит от степени перекрытия электронных оболочек 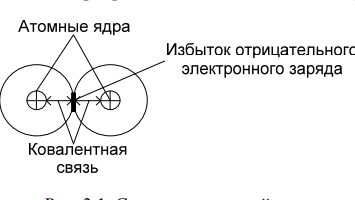 Следует различать полярные и неполярные молекулы Неполярные молекулы состоят из одинаковых атомов (Н2 — молекула водорода, Cl2 — молекула хлора, N2 — молекула азота) или из атомов, имеющих близкие значения электроотрицательности. Такие молекулы имеют симметричную структуру (электронная пара в равной мере принадлежит обоим атомам). Электроотрицательность — способность атомов в химических соединениях притягивать к себе электроны другого атома. Полярные молекулы резко различаются по виду и размерам атомов, и по их электроотрицательности. Такие молекулы образуют несимметричную молекулу (электронная пара смещена в сторону более электроотрицательного атома). В результате у полярных молекул образуется электрический дипольный момент p=ql , где q — элек- трический заряд; l — расстояние Дипольный момент (p) измеряется в Кл·м или в Дебаях (Д), 1 Д = 3,3·10^- 30 Кл·м. Примеры неполярных и полярных молекул: Н2, Cl2 — неполярные молекулы (р = 0); HCl (соляная кислота), С-О (оксид углерода), Н2О — полярные молекулы (р больше 0). Полярные диэлектрики по сравнению с неполярными обладают значительно более низкими диэлектрическими характеристиками. Неполярные вещества применяются как лучшие диэлектрики. Особенно они важны для устройств, работающих в диапазоне сверхвысоких частот (СВЧ). Полярные вещества применяются там, где допустима изоляция среднего уровня. Данный тип связи наблюдается у веществ в газообразном, жидком и твердом состояниях, имеет место, как в диэлектриках, так и в полупроводниках. 2)Ионная связь Ионная связь (гетерополярная связь) образуется за счет взаимного кулоновского притяжения разноименно заряженных ионов. При этом притяжение разноименно заряженных ионов превышает отталкивание одноименно заряженных. Эта связь наблюдается в, так называемых, ионных кристаллах, которые являются гигантской ассоциа- цией ионов. Прочность или энергия (W) ионной связи определяется следующим : взаимным кулоновским притяжением положительных и отрицательных ионов; отталкиванием внешних электронных оболочек этих же ионов, возникающим при очень малых расстояниях между ионами. 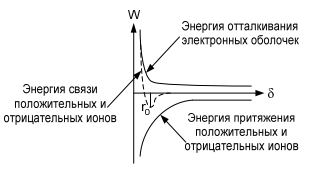 В итоге образуется кристаллическая структура, которая определяется величиной r0, размерами ионов и имеет минимум свободной энергии. Существует семь типов кристаллических решеток: кубическая; гексагональная; тетрагональная; ромбическая; триклинная; моноклинная; ромбоэдрическая (тригональная). Ионные кристаллы образуются, в частности, из следующих элементов: с одной стороны, элементы I, II и III групп таблицы Д. М. Менделеева, такие как: Li, Na, K, Be, Mg, Al, Y и др.; с другой стороны, элементы VI и VII групп таблицы Д. И. Менделеева, такие как: О, F, Cl и др. т. е. соединяются атомы с резко различной электроотрицательностью. Пример молекул с ионной связью: Li2O, MgO, NaCl и др Ионная связь так же, как и ковалентная, очень прочная Ионная и ковалентная связи — два крайних вида связи, на практике, как правило, в веществах имеется ковалентная и ионная связи одновременно (смешанная связь) . Ионная связь наблюдается в диэлектриках и полупроводниках.  9. Виды химической связи. Металлическая, молекулярная и водородная связи. Металлическая связь Металлическая связь имеет место в веществах, состоящих из положительно заряженных ионов, находящихся в узлах кристаллической решетки, и квазисвободных (обобществленных, коллективизированных, легко перемещаемых под действием электрического поля) электронов 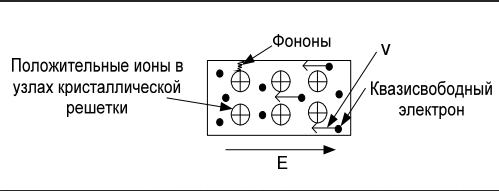 Вещества с металлической связью имеют: высокую электропроводность; высокую теплопроводность; высокую отражательную способность (блеск); высокую плотность упаковки; пластичность. Вещества, обладающие таким набором свойств, являются металлами — проводниками (Ag, Cu, Au, Al, Li, Na, Fe и др.). Металлическая связь, такая же прочная, как ионная и ковалентная Молекулярная связь Молекулярная связь (связь Ван–дер–Ваальса) возникает между молекулами, внутри которых уже имеется ковалентная связь. Эта связь обусловлена синхронным движением внешних валентных электронов, которые в каждый момент времени максимально удалены друг от друга. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказываются сильнее сил взаимного отталкивания электронов внешних орбит. 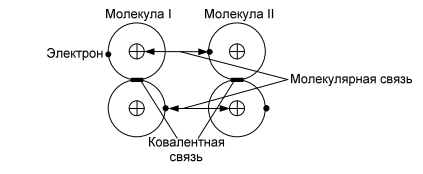 Эта связь слабая, у нее низкая энергия связи. Энергия молекулярной связи приблизительно 0,05 – 0,2 эВ. Молекулярная связь легко разрушается тепловым движением. Наличие в веществе двух видов связи (ковалентной и молекулярной) приводит к тому, что у вещества наблюдается анизотропия свойств. Молекулярная связь имеет место в диэлектриках: полимеры, твердые Н2, N2, O2, Cl2 и др. Водородная связь Водородная связь (Н-связь) возникает между двумя электроотрицательными атомами через атом водорода . Ее суть заключается в следующем. Атом водорода, ковалентно связанный с элекроотрицательным атомом (например, кислородом), несет относительно высокий положительный заряд и электростатически притягивается электроотрицательным атомом другой молекулы с образованием водородной связи. 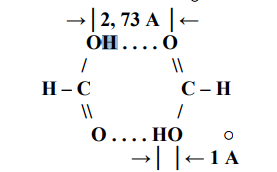 Комплекс, имеющий Н-связь, рассматривается, как система с наиболее энергетически выгодным расположением электронов. Возможность образования Н-связи во многом определяется малым размером атома водорода, позволяющим подойти к другим атомам на очень близкое расстояние. Энергия водородной связи зависит от электроотрица- тельности атомов и характерна для групп типа: - ОН, -NH и др. |
