ждблорипмоас. ИПЗ_Физика. Российский государственный социальный университет итоговое практическое задание по дисциплине Физика
 Скачать 45.26 Kb. Скачать 45.26 Kb.
|
ИТОГОВОЕ ПРАКТИЧЕСКОЕ ЗАДАНИЕ по дисциплине «Физика» Укажите возможные способы определения массы одной молекулы (тема практического задания)
Москва 2022 СодержаниеВведение 3 Относительная атомная масса элементов 4 Заключение 7 ВведениеСуществует много разных методов определения масс молекул. С их помощью установлено, что большинство молекул, неорганических соединений, имеют диаметр порядка 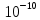 м, массу порядка м, массу порядка  кг. Так как массы молекул очень малы, удобно использовать в расчётах не абсолютные значения масс, а относительные значения. По международному соглашению массы всех атомов и молекул сравнивают с кг. Так как массы молекул очень малы, удобно использовать в расчётах не абсолютные значения масс, а относительные значения. По международному соглашению массы всех атомов и молекул сравнивают с 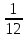 массы атома углерода, с так называемой атомной единицей массы. массы атома углерода, с так называемой атомной единицей массы.Атомная единица массы m0 равна одной двенадцатой части массы атома изотопа 12C. Масса атома углерода m(12C) = 1,995 * 10-26 кг. Следовательно, а.е.м. равна: 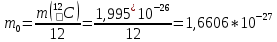 Относительной атомной (молярной) массой называют отношение массы m атома (молекулы) к а.е.м.: 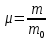 Относительная атомная масса элементов Относительная атомная масса всех химических элементов точно измерена и приведена в таблице Менделеева. Складывая относительные атомные массы элементов, входящих в состав молекулы вещества, можно вычислить относи- тельную молярную массу вещества. В международной системе единиц (СИ) количество вещества выражается в молях. Единица количества вещества – моль, численно равна относительной атомной (или молекулярной) массе, выраженной в граммах. В частности, для углекислого газа СО2 ((С) = 12, (О2) = 32), моль равен 44 г/моль. Эта единица количества вещества примечательна тем, что моль любого вещества содержит одно и то же число молекул. В самом деле, если обозначить относительные массы двух каких-либо веществ через 1 и 2, а массы молекул этих веществ – через m1 и m2, то можно написать такие очевидные равенства: 1 = m1N1 и 2 = m2N2, где N1 и N2 числа частиц в моле этих веществ. Так как из самого определения относительной массы вытекает, что 1 = 2 m1 , m2 то, разделив приведенные выше равенства одно на другое, получаем, что N1 = N2, то есть, что моль любого вещества содержит одинаковое число молекул. Число частиц в одном моле любого вещества , равное 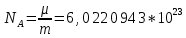 моль мольКоторое одинаково для всех веществ. Это число Nа - называют числом постоянной Авогадро. Теперь, можно определить моль как единицу особой величины – количества вещества: 1 моль – это количество вещества, содержащее число молекул или других частиц например, атомов, если вещество состоит из атомов, равное числу Авогадро Nа, то есть столько структурных элементов вещества, сколько атомов содержится в 0,012 кг C нуклида углерода с атомной массой 12. Зная Nа, можно оценить среднее расстояние между атомами (молекулами). Имеем m г вещества плотностью r. Тогда, m = N * m = N*p*V, где N - количество атомов (молекул), V - объём одного атома (молекулы). В этом случае: 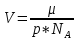 Мы не знаем какова форма молекулы. Ее для каждого вещества определяют путём сложных расчётов, в которых используются экспериментальные данные, полученные с помощью электронных и ионных микроскопов. Для наших целей допустимо упрощение, согласно которому молекула может быть представлена в виде кубика со стороной L, либо в виде шарика радиусом r. Тогда объём «кубической» молекулы V = L^3. Следовательно, на каждый атом приходится кубик стороной: 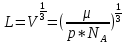 Оценим L для атома золота: m = 196,37 г/моль, r = 19,32 г/см 3 , получаем L » 2,6×10-10 м. Таким образом, размеры атомов порядка 10-10 м, так как в твёрдых телах (в жидких тоже) расстояние между соседними атомами (молекулами) мало отличается от их размеров. Масса одной молекулы: 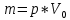 Отметим, что существуют разновидности атомов углерода со значениями относительной атомной массы 10. 12, 13 и 14 а.е.м. (изотопы углерода). Среднее значение А, для природного углерода равно 12,011 а.e.м. Аналогичным образом определяется относительная молекулярная масса, обозначаемая символом m0: 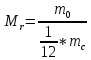 Где Mc – масса одной молекулы данного вещества Обычно значение относительной молекулярной массы определяют, исходя из состава молекулы. Так, для воды значение М складывается из значений относительных атомных масс водорода и кислорода, определенных до целочисленных значений: М = 2 * 1 + 16 = 18 а.е.м. Историческая справка: Менделеев Дмитрий Иванович (1834-1907) - русский химик. Работы в области химии, физики, метрологии, метеорологии. В 1869 г. открыл одни из фундаментальных законов природы - периодический закон химических элементов - и на его основе создал периодическую таблицу химических элементов. Предсказал существование критической температуры. обобщив уравнение Клапейрона, и записал общее уравнение состояния идеального газа. ЗаключениеЯ понял, что существует много разных методов определения масс молекул. С их помощью установлено, что большинство молекул, неорганических соединений. Так как массы молекул очень малы, удобно использовать в расчётах не абсолютные значения масс, а относительные значения. Поэтому в качестве единицы массы введена в обращение атомная единица массы, с которой сравнивается масса любой структурной частицы. |

