Полушин Ю.С Руководство. Руководство по анестезиологии и реаниматологии под редакцией профессора Ю. С. Полушина
 Скачать 4.32 Mb. Скачать 4.32 Mb.
|
6.1.3. Респираторная поддержка при паренхиматозном повреждении легкихПод паренхиматозным повреждением понимают патологический процесс в легких, в который вовлечены газообменная зона и интерстициальное пространство. Он может быть диффузным или локальным. Примерами диффузного процесса являются кардиогенный отек легких, ОРДС и ОПЛ, интерстициальные пневмонии. Локальные повреждения могут наблюдаться при долевых пневмониях, аспирации, контузии легкого и т.д. При всех заболеваниях, вызывающих паренхиматозное повреждение легких, имеются в разной степени выраженный интерстициальный отек, альвеолярный отек, недостаток сурфактанта и дисфункция дистальных воздухопроводящих путей. Соответствующие изменения механических свойств легких и нарушения газообмена определяют стратегию респираторной поддержки. В основном паренхиматозное повреждение легких приводит к снижению растяжимости и уменьшает дыхательный объем. Функциональная емкость легких уменьшена, при этом кривая «объем-давление» сдвинута вправо (рис.6.16). 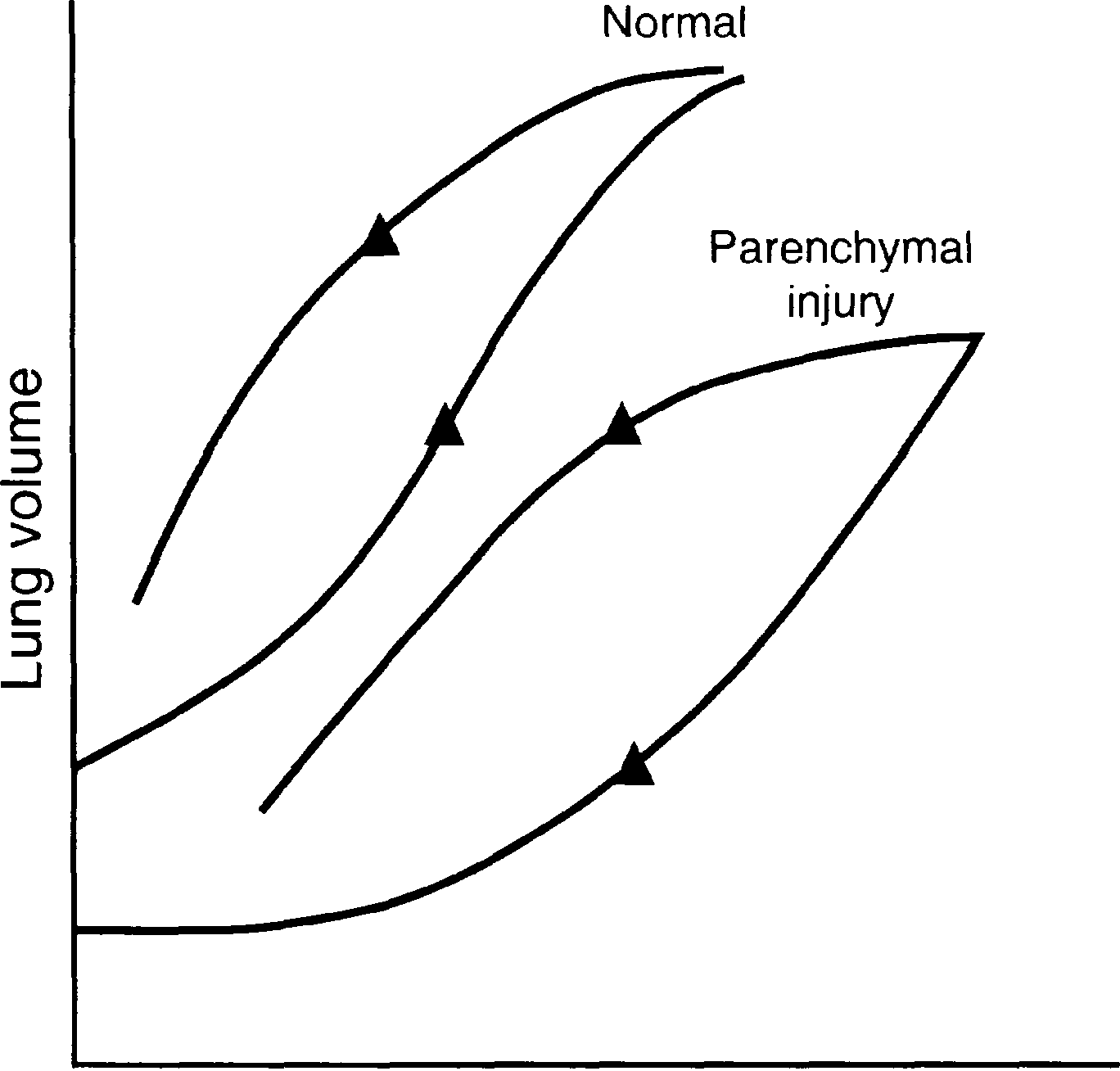 Рис. 6.16. Кривая объем-давление в норме и при паренхиматозном повреждении легких Важно иметь в виду, что даже при диффузных процессах степень воспалительного процесса в разных участках легких может быть неодинаковой, соответственно, и механические свойства легочной ткани будут различны. При проведении ИВЛ доставляемый газ в основном поступает в регионы легких с наилучшей растяжимостью и меньшим сопротивлением воздухопроводящих путей (т.е. в более здоровые отделы легких). “Обычный” дыхательный объем, таким образом, может распределяться в наиболее сохранные регионы, приводя к большему региональному объему и к потенциальному повреждению легких за счет перерастяжения его отдельных участков (рис. 6.17). Эти обстоятельства являются одним из доводов для использования при тяжелых паренхиматозных повреждениях легких вентиляции, контролируемой по давлению, поскольку лимитируется максимальное растяжение во всех вентилируемых единицах до установленного уровня, независимо от региональных изменений в легких. 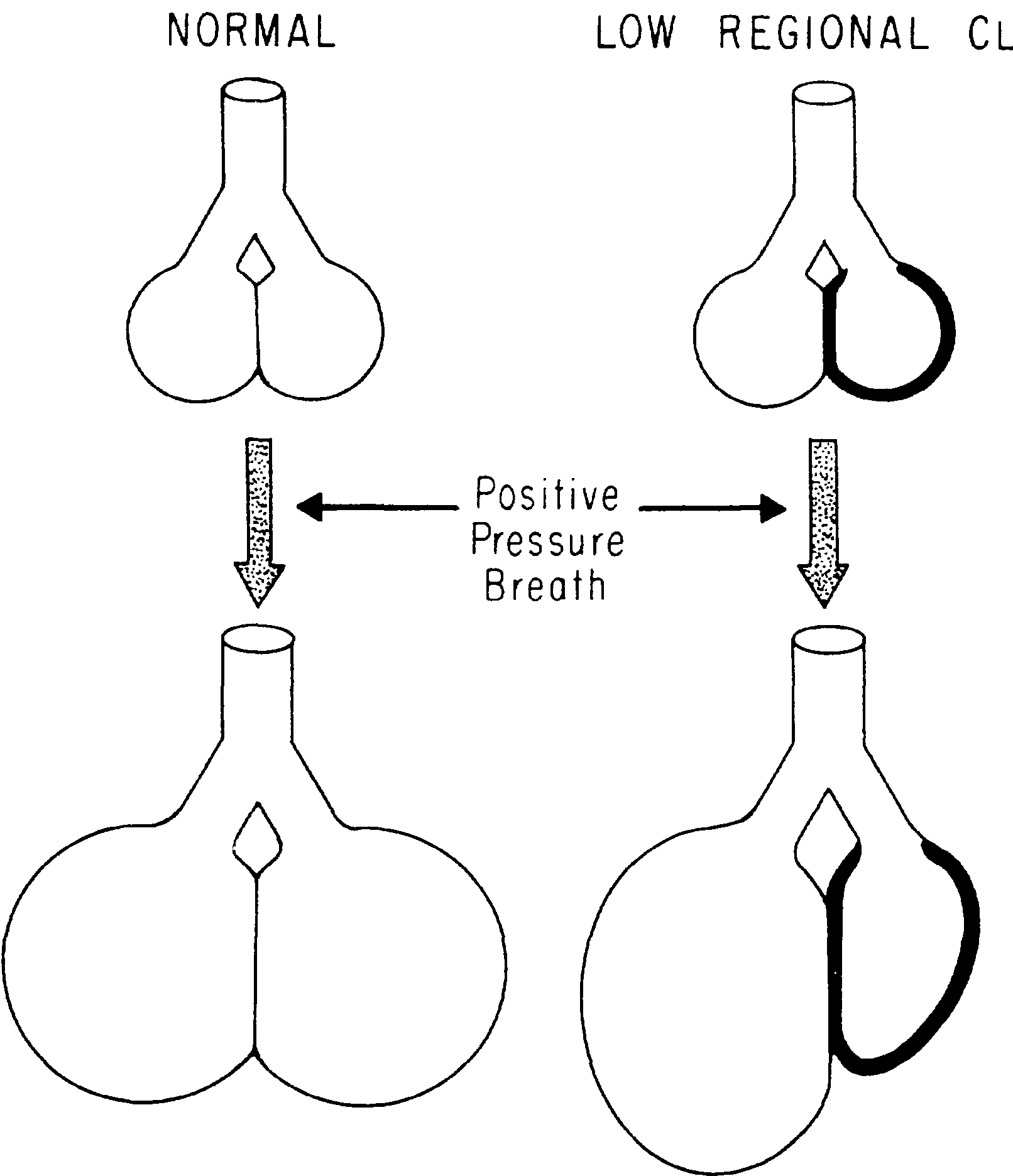 Рис. 6.17. Распределение дыхательного объема между регионами с различной растяжимостью Паренхиматозное повреждение может также затрагивать воздухопроводящие пути, особенно бронхиолы и альвеолярные ходы. Их сужение и коллабирование способствует ухудшению вентиляции поврежденных отделов легких. Нарушение газообмена при паренхиматозном повреждении связано также с уменьшением объема легких, нарушением распределения вентиляции и, соответственно, вентиляционно-перфузионных отношений. Степень шунтирования может меняться и в зависимости от фазы дыхательного цикла. Интересно, что может быть низкое соответствие вентиляции и перфузии в инспираторную фазу, и шунт в экспираторную фазу, если имеет место альвеолярный коллапс на выдохе. Стратегическая цель респираторной поддержки при паренхиматозном повреждении легких заключается в обеспечении адекватного газообмена и минимизации потенциального ятрогенного повреждения легких. При проведении респираторной поддержки клиническое решение принимается в основном с учетом четырех важных факторов: артериального рН, степени артериального насыщения гемоглобина кислородом, фракционной концентрации кислорода (токсическое воздействие кислорода), возможном перерастяжении легких объемом или давлением. В идеале рН должен быть в переделах нормальных значений 7.35 - 7.45. Однако, если проводится защита легких от чрезмерного перерастяжения (небольшой дыхательный объем), низкий уровень рН вследствие высокого парциального давления РСО2 корригировать довольно сложно. Кроме того, есть сведения, что значения рН в диапазоне 7,1-7,2 достаточно хорошо переносятся больными с острой дыхательной недостаточностью. Этот уровень рН коррелирует с увеличением РСО2 до 80 мм рт. ст. Такую тактику респираторной поддержки, когда допускается развитие респираторного ацидоза с целью предотвращения чрезмерного перерастяжения легких, иногда принято называть допустимой гиперкапнией. Допускается прирост РСО2 на 10 мм рт. ст. в час. Однако эта тактика должна проводиться с крайней осторожностью у больных с патологий ЦНС и нестабильной гемодинамикой (при инотропной поддержке или нарушениях ритма). На сегодняшний день принято считать, что для адекватного снабжения кислородом тканей SaO2 должна быть выше 88% (PO2 60-65 мм рт. ст.). Более низкое насыщение гемоглобина кислородом (в пределах 85-88%) может достаточно хорошо переноситься, если за счет поддержания соответствующих уровней сердечного выброса и концентрации гемоглобина сохраняется нормальная доставка кислорода тканям (DO2 - 300-400 мл/мин/м2). Независимо от DO2, напряжение кислорода в крови должно поддерживаться не ниже 55 мм рт. ст., чтобы минимизировать эффект легочной вазоконстрикции и, как следствие, не допустить прогрессирования легочной гипертензии. Концепция повреждения легких избыточным растяжением более подробно изложена в главе 35. Перерастяжение легочной ткани может осуществляться двумя способами: 1) при повторяющемся закрытии и открытии поврежденных альвеол, спадающихся на выдохе; 2) при избыточном перерастяжении легких в конце вдоха за счет большого дыхательного объема или высокого ПДКВ. В соответствии с этим требуется во-первых, восстановить газообмен в “рекрутируемых альвеолах” с помощью ПДКВ, чтобы не перерастягивать здоровые регионы легких; во-вторых, – избежать перерастяжения здоровых альвеол во время инспираторной фазы, ориентируясь на давление плато (не больше 35 мм рт. ст.). Лучшая оценка механических свойств легких может быть достигнута с использованием графического мониторинга кривой «объем-давление» (рис. 6.18). Рис. 6.18. Кривая «объем-давление», как критерий подбора параметров вентиляции Точная концентрация О2, при которой он становится токсичным, неизвестна, допустимым принято считать уровень FiO2 – 0,5-0,6. В совокупности основную цель респираторной поддержки можно свести к обеспечению оптимального уровня pH и SaO2 при минимальном растяжении легких (оценивается по давлению в контуре) и концентрации кислорода в подаваемой смеси (табл. 6.3). Таблица 6.3 Цели респираторной поддержки
Выбор режима и подбор параметров респираторной поддержки. При тяжелом повреждении легких в основном используется принудительная вентиляция легких, например режимы CMV-PC, CMV-VC, AssistCMV, IMV, SIMV. Этот подход гарантирует выполнение большей части работы дыхания вентилятором. Использование триггерной вентиляции (например, AssistCMV) позволяет больному инициировать дополнительные вдохи (с заданным давлением или объемом), что может помочь в обеспечении требуемого уровня СО2 и улучшить самочувствие пациента. Однако в ряде случаев сложно достичь адекватной синхронизации дыхания больного и работы аппарата ИВЛ, что требует использования релаксантов и седации. Эта мера должна быть использована, когда другие способы неэффективны. При менее тяжелых формах паренхиматозной дыхательной недостаточности или на этапе выздоровления могут использоваться режимы вспомогательной вентиляции легких. Существует также подход, который предусматривает использование ВВЛ при тяжелом ОПЛ. Считается, что вентиляция с сохраненным спонтанным дыханием более предпочтительна вследствие меньшего давления в дыхательных путях и лучшей синхронизации больного с аппаратом ИВЛ (уменьшение седации), а также меньшего влияния на системную гемодинамику. Выбор контроля по объему или по давлению зависит от конкретной клинической цели. Если в основном необходимо обеспечить адекватный уровень РСО2, при котором достигается комфорт больного и невысокое давление в дыхательных путях (умеренное повреждение легких) предпочтительна вентиляция, контролируемая по объему. Напротив, если риск перерастяжения легких достаточно велик и необходимо достичь синхронизации больного с аппаратом ИВЛ (уровень РСО2 не является первоочередной задачей), предпочтительна вентиляция легких, контролируемая по давлению. Дыхательный объем и ПДКВ должны быть подобраны таким образом, чтобы давление плато не превышало 35 см Н2О. Для подержания такого давления может возникнуть необходимость снижения дыхательного объема до 5-6 мл/кг вместо традиционно используемых 8-10 мл/кг. Подбор частоты дыхания, как правило, осуществляется по уровню РСО2. Начальная частота дыхания обычно составляет 12-18 в мин. Увеличение частоты и, соответственно, минутной вентиляции, приводит к увеличению выведения СО2. В определенный момент, однако, происходит задержка элиминации газа («воздушная ловушка») вследствие неадекватного времени выдоха. В этой ситуации при вентиляции с контролем по давлению снижается минутная вентиляция, а при вентиляции, управляемой по объему, повышается давление в дыхательных путях. При обычных параметрах вдоха это происходит при частоте дыхания более 35 в мин, а иногда и раньше, если используется инвертируемое отношения вдоха к выдоху или при очень большой постоянной времени. Цель установки ПДКВ - рекрутировать “рекрутируемые” альвеолы, не перерастягивая уже открытые. ПДКВ выполняет свою функцию, предотвращая коллабирование на выдохе раскрываемых дыхательным объемом поврежденных альвеол. Эффект рекрутирования может быть усилен временным (на 1 мин) установлением ПДКВ на 5-10 см Н2О выше оптимального. Подбор оптимального ПДКВ осуществляется на основе показателей механики дыхания или газообмена. При подборе оптимального ПДКВ на основе показателей механики существует два основных подхода. Первый заключается в том, чтобы с помощью кривой «объем-давление» установить значения дыхательного объема (VT) и ПДКВ между нижней и верхней точками изгиба кривой. Затем постепенно следует изменить ПДКВ, чтобы определить уровень, когда легочно-торакальный комплайнс будет наибольшим. Используя в качестве критерия показатели газообмена, титруют уровень ПДКВ (после рекрутирования спавшихся альвеол за счет маневра, описанного выше) и определяют момент, когда уровень FiО2 будет минимальным. Обычно используют ПДКВ в пределах 8-25 см Н2О. Второй подход основан на изменении отношения вдоха к выдоху. Установка инспираторного времени и отношения вдоха к выдоху требует рассмотрения с нескольких позиций. Нормальное отношение приблизительно составляет от 1:2 до 1:4. Эти параметры способствуют комфортным ощущениям больного и поэтому используются при установке начального режима ИВЛ. Оценка графического мониторинга способствует установке адекватного времени выдоха, чтобы предотвратить развитие внутреннего ПДКВ (ауто-ПДКВ). Обратное соотношение вдоха к выдоху I:E может использоваться в качестве альтернативы увеличению ПДКВ с целью улучшения вентиляционно-перфузионных отношений при тяжелой дыхательной недостаточности. Обычно инвертируемое отношение вдоха к выдоху используется у больных, у которых подбор ПДКВ и давления вдоха не привел к нормализации показателей газообмена или используется токсическая концентрация О2. Удлинение инспираторного времени имеет несколько физиологических эффектов. Во-первых, длинный вдох приводит к удлинению времени смешивания газа в альвеолах и воздухопроводящих путях. Во-вторых, длительное инспираторное время дает лучшую возможность плохо наполняемым альвеолярным единицам вентилироваться и рекрутироваться. И, наконец, если экспираторное время становится неадекватным, развивается ауто-ПДКВ. Показано, что использование этого маневра в ряде случаев способствует улучшению газообмена, хотя какой именно из физиологических механизмов способствует этому точно неизвестно. Когда используется инвертируемый режим, необходимо также иметь в виду и некоторые другие аспекты. Во-первых, развитие воздушной ловушки имеет разные последствия при вентиляции с контролем по объему и по давлению. Во-вторых, продленный вдох чаще используется с вентиляцией, контролируемой по давлению, чтобы использовать быстрый начальный поток и ограничение по давлению. Иногда инвертируемое отношение вдоха к выдоху применяется и при объемной вентиляции, причем, как правило, за счет удлинения паузы вдоха. В-третьих, длительное инспираторное время приводит к повышению среднего давления за дыхательный цикл, что может привести к снижению венозного возврата. Более того, в присутствии воздушной ловушки альвеолярное давление выше, чем давление в воздухопроводящих путях, и это делает мониторинг внутригрудного давления более сложным. В-четвертых, увеличение отношения вдоха к выдоху более чем 1:1 (или время вдоха более 1,5 с) крайне некомфортно для больного. Обычно в этих случаях требуется седация и релаксация. Учитывая все это, удлиненная инспираторная фаза должна использоваться только при тяжелой дыхательной недостаточности, опытными специалистами и при наличии соответствующего мониторинга механики дыхания. Расчет при этом должен строиться на улучшение распределения газа и наполнения слабовентилируемых альвеол, но не на создание ауто-ПДКВ. Это связано с тем, что убедительных данных, доказывающих преимущество ауто-ПДКВ в отношении улучшения газообмена и нормализации вентиляционно-перфузионных отношений по сравнению с обычным внешним ПДКВ не имеется. Более того, ауто-ПДКВ может оказаться выше в регионах легких с обструкцией дыхательных путей и нормальной растяжимостью, чем в зонах, где легкие более упругие и требуют расправления. При внешнем ПДКВ распределение давления более равномерно. 6.1.4. Респираторная поддержка при обструктивной патологии легкихОбструктивные легочные расстройства встречаются при многих заболеваниях, но наиболее часто они имеют место при бронхиальной астме и хронической обструктивной болезни легких (ХОЗЛ). Хотя термин ХОЗЛ охватывает широкий круг заболеваний, его использование обычно ограничивается хроническим бронхитом и эмфиземой. Бронхиальная астма является как бы эталоном обратимых обструктивных болезней воздухопроводящих путей, тогда как термин ХОЗЛ предполагает, возможно отчасти, необратимую обструкцию. Острая дыхательная недостаточность в связи с острым обострением обструкции дыхательных путей (гиперкапническая дыхательная недостаточность) является частым явлением при этих заболеваниях. Инфекция, внешние раздражители (например, аллергены, токсины), патология со стороны сердечно-сосудистой системы или системный воспалительный процесс могут явиться причиной быстрого развития дыхательной недостаточности. Изменение механики дыхания, сужение дыхательных путей и увеличение сопротивления приводят к двум важным последствиям. Во-первых, увеличение давления, необходимого для обеспечения воздушного потока, может приводить к избыточной нагрузке на дыхательную мускулатуру, утомлению дыхательных мышц и неадекватной минутной вентиляции легких. Во-вторых, суженные дыхательные пути приводят к появлению областей в легких, которые не могут полностью опорожниться («воздушная ловушка»). Этот феномен приводит к образованию положительного давления в конце выдоха (внутреннее ПДКВ, или ауто-ПДКВ). Создание ауто-ПДКВ может вызвать затруднение работы аппарата в триггерном режиме, поскольку давление не возвращается на уровень внешнего ПДКВ, относительно которого работает триггерная система. Имеется несколько причин нарушения газообмена при обструктивной патологии. Во-первых, снижается минутная вентиляция вследствие усталости дыхательной мускулатуры (гиперкапническая дыхательная недостаточность). Во-вторых, региональная гиповентиляция и нарушение вентиляционно-перфузионных отношений приводят к прогрессированию гипоксемии. Альвеолярный отек и коллапс не характерны для обструктивной дыхательной недостаточности, поэтому шунтирование является менее важной причиной гипоксемии. В-третьих, перерастянутые зоны легких и связанные с этим эмфизематозные изменения могут приводить к нарушению капиллярного кровотока и увеличению мертвого пространства. Это еще больше ухудшает эффективную вентиляцию и затрудняет работу дыхательной помпы по обеспечению адекватной вентиляции и обеспечению газообмена. В-четвертых, гипоксемическая легочная вазоконстрикция вместе с хроническими легочными сосудистыми изменениями при некоторых заболеваниях дыхательных путей приводят к перегрузке правого желудочка, дальнейшему ухудшению легочного кровообращения и увеличению мертвого пространства. Стратегическая цель респираторной поддержки, как и при других видах дыхательной недостаточности, заключается в обеспечении адекватного газообмена и минимизации возможного ятрогенного повреждения легких. Однако в проведении респираторной поддержки у больных с обструктивными заболеваниями имеется ряд особенностей. Во-первых, учитывая хроническую усталость дыхательных мышц, наиболее показан тот режим, который снижает нагрузку на дыхательную мускулатуру. Во-вторых, сужение дыхательных путей может приводить к высокому давлению в дыхательных путях. Более того, внутреннее ПДКВ дополнительно способствует повышению альвеолярного давления. Поскольку процесс в легких неоднородный, высокое давление может привести к перерастяжению его менее поврежденных отделов. Хотя давление плато является важным маркером повреждения легких вследствие перерастяжения, необходимо учитывать, что пиковое давление в дыхательных путях даже в присутствии приемлемого давления плато, может приводить к повреждению легких вследствие периодического перерастяжения. Уменьшение дыхательного объема, насколько это возможно в такой ситуации, при одновременном снижении рН и повышении РСО2 может считаться определенным компромиссом. Как уже упоминалось, больные достаточно хорошо переносят дыхательный ацидоз при стабильной гемодинамике и отсутствии патологии со стороны ЦНС (допустимая гиперкапния). В-третьих, хотя нарушение V/Q имеет место при острой обструкции дыхательных путей, шунт менее выражен, чем при паренхиматозном повреждении, и оксигенация, как правило, поддерживается без использования токсических концентраций кислорода. Для поддержания адекватной оксигенации обычно используется FiO2 ниже 0.6. Роль ПДКВ при обструктивной патологии не так велика, как при паренхиматозной. Более того, использование ПДКВ может привести к еще большему перераздуванию неповрежденных альвеол. Использование ПДКВ может быть полезно при вспомогательной вентиляции, когда внутреннее ПДКВ нарушает процесс триггерования. При необходимости проведения ИВЛ предпочтение отдается режимам, которые позволяют обеспечить принудительную вентиляцию легких (CMV, AssistCMV, PCV, IMV и SIMV с большой аппаратной поддержкой). Может использоваться вентиляция, контролируемая как по объему, так и по давлению. Вентиляция с контролем по давлению предлагает высокий начальный поток, который может изменяться в зависимости от усилия больного. Это обстоятельство может помогать поддерживать короткий вдох (и следовательно, большое экспираторное время), если вентиляция инициируется больным. Кроме того, лучше достигается синхронизация дыхания больного с аппаратом ИВЛ, чем в том случае, когда поток фиксирован. Вентиляция с контролем по давлению предоставляет также надежное ограничение давления на вдохе, но, однако, не гарантирует дыхательного объема. Как и при паренхиматозной дыхательной недостаточности, выбор того или иного режима зависит от конкретной цели применения ИВЛ. Если поддержание РСО2 является приоритетной задачей, более предпочтительна вентиляция с контролем по объему. Если же необходима защита легких от перерастяжения или следует достичь лучшей синхронизации аппарата с дыханием больного, можно выбрать вентиляцию, контролируемую по давлению. При отсутствии у больного усталости дыхательной мускулатуры, а также при отлучении от механической вентиляции используется ВВЛ (IMV, SIMV (PC), PSV, SIMV (PC)+ PSV и др.). Присутствие «воздушной ловушки» и высокой нагрузки на дыхательную мускулатуры может вызвать чувство диспноэ и сделать сложным процесс синхронизации за счет нарушения процесса триггерования, доставки потока и циклирования вдоха в соответствие с потребностями больного. Использование ВВЛ может приводить к избыточной частоте дыхания и увеличению ауто-ПДКВ, особенно если используется объемная вентиляция (АssistСMV). Для достижения хорошей синхронизации необходима тщательная установка инспираторного давления, объема, и времени. Кроме того, в некоторых случаях целесообразно использование умеренной седации для притупления нейрореспираторного драйва. Дыхательный объем должен быть установлен на минимальное значение, позволяющее обеспечить приемлемый уровень СО2 и альвеолярное давление (давление плато) не более 35 см Н2О. Обычно эти показатели удается обеспечить при дыхательном объеме в пределах 6-8 мл/кг. Инспираторное время должно быть адекватным с точки зрения комфорта больного (необходим достаточно высокий поток) и избежания чрезмерно высоко пикового давления (за счет высокого сопротивления потоку). Обычно используется инспираторное время принудительного вдоха около 0.7-1.0 с. При установке инспираторного времени необходимо учитывать частоту дыхания (от чего также зависит I:E). Другими словами, необходимо достичь оптимального баланса между необходимостью альвеолярной вентиляции и опасностью «воздушной ловушки». Как уже обсуждалось, возникновение «воздушной ловушки» зависит от трех факторов: механических свойств дыхательной системы больного (выражается постоянной времени, которая равняется растяжимости, умноженной на сопротивление), минутной вентиляции, отношения вдоха к выдоху. При увеличении значения любого из этих показателей риск развития «воздушной ловушки» возрастает. Для его снижения необходимо уменьшить минутную вентиляцию и отношение I:E. Цена этому – повышение уровня СО2. Гиперкапния, а также чувство нехватки воздуха при использовании малого дыхательного объема, могут потребовать необходимость седации больного и даже его релаксации, чтобы предотвратить борьбу с вентилятором и создание высокого пикового давления. Теоретически при таких обстоятельствах показано использование газов с низкой плотностью (гелий с кислородом), чтобы уменьшить работу дыхания и облегчить выход газа из легких. Дополнительное следствие «воздушной ловушки» и высокого интраторакального давления - нарушение функции правого желудочка. В этой ситуации необходимо увеличить преднагрузку, чтобы оптимизировать его работу. Так как альвеолярное воспаление, отек и коллапс не являются характерными особенностями острой дыхательной недостаточности обструктивного генеза, в применении ПДКВ нет существенной необходимости. Более того, оно может способствовать дополнительному растяжению зон легких с хорошей растяжимостью. По-видимому, к нему необходимо прибегать только при возникновении ателектазов или отека легких. ПДКВ, однако, может быть полезно при ВВЛ и высоком внутреннем ПДКВ, для того чтобы улучшить работу триггерной системы. Во время инициации аппаратного вдоха больным с обструкцией дыхательных путей, существенной проблемой является дополнительная нагрузка за счет повышении порога при создании внутреннего ПДКВ. Проще говоря, внутренний ПДКВ должен быть преодолен инспираторными мышцами, чтобы изменение давления или потока в дыхательном контуре стало сигналом для вентилятора, что больной желает сделать вдох. Эта проблема клинически проявляется тем, что у больного наблюдается сокращение дыхательной мускулатуры, но нет ответной активности вентилятора. Разумное наружное ПДКВ поможет выровнять это «пойманное» давление с давлением в дыхательном контуре и уменьшить усилие по триггерованию вентилятора. Выявлено, что при таких обстоятельствах оптимальное внешнее ПДКВ может составлять 70-80 % от внутреннего ПДКВ. До этого предела используемое внешнее ПДКВ воздействует только на давление в контуре и в дыхательных путях. На альвеолярное давление оно не оказывает влияния. Если применяемое внешнее ПДКВ выше этой величины, оно начинает повышать альвеолярное давление и, таким образом, становится контрпродуктивным вследствие регионального перерастяжения в менее обтурируемых регионах. На практике подбор правильного ПДКВ осуществляется постепенным изменением последнего на 2-3 см Н2О с одновременной оценкой ответа больного. Если выбор удачный, усилие больного по инициированию вдоха становятся меньше, так как соответствующий уровень ПДКВ обеспечен. Увеличение диспноэ и другие признаки повышения внутригрудного давления (уменьшение артериального давления) позволяют предположить, что уровень ПДКВ избыточный. 6.1.5. Методы перехода на самостоятельное дыханиеПеревод на самостоятельное дыхание после длительной механической вентиляции может быть сложной и неприятной задачей для больного и лечащего персонала. Причем в данном контексте под переводом на самостоятельное дыхание понимается процесс постепенного уменьшения уровня респираторной поддержки с помощью режимов вспомогательной вентиляции. Процесс отлучения может быть относительно прост (выход из анестезии, передозировка опиоидов, приступ бронхиальной астмы) или крайне сложен (больные с РДСВ). Перевод на самостоятельное дыхание может занимать до 40 % общего времени нахождения больных на ИВЛ, поэтому роль правильной тактики проведения этого этапа не вызывает сомнений. Важнейшая цель респираторной терапии - как можно более раннее прекращение респираторной поддержки. Замедленный перевод на самостоятельное дыхание подвергает больного неоправданному риску развития назокомиальной инфекции и баротравмы, травмы дыхательных путей, требует использования седативных препаратов, увеличивает стоимость лечения. В то же время преждевременное прекращение ИВЛ имеет еще более серьезные последствия: устранение защиты дыхательных путей от аспирации, гипоксемия, нарушение центральной гемодинамики, перегрузка и утомление дыхательной мускулатуры, прогрессирование дыхательной недостаточности. Процесс отлучения является психологическим стрессом для больных. Многие из тех, кто подвергается этому испытанию, имеют ограниченный респираторный резерв. Поэтому один из важных принципов при любой стратегии отлучения – никогда не доводить больного до переутомления. Перед началом процесса отлучения от респиратора должно быть оценено общее состояние больного. Любые выявленные отклонения гомеостатических показателей по возможности должны быть сведены до приемлемых значений. Факторы, которые следует оценивать в этой ситуации, представлены в табл. 6.4. Таблица 6.4 Факторы, затрудняющие перевод на самостоятельное дыхание
Причина, вызвавшая начало ИВЛ, должна быть устранена или, по крайней мере, разрешаться. Обычно процесс перевода на самостоятельное дыхание инициируется при выполнении следующих критериев (как минимум): - стабилизации по основному заболеванию, - РО2/ FiO2 > 200, - ПДКВ < 10 см Н2О, - надежный нейрореспираторный драйв, - стабильные показатели гемодинамики при минимальных дозах инотропов и вазопрессоров. Если в процессе перевода развивается усталость дыхательной мускулатуры, необходимо оценить значимость всех факторов, которые могут привести к этому состоянию. Увеличение нагрузки нередко связано с повышением сопротивления дыхательных путей, снижением растяжимости легких, а также в связи с большой тратой энергии при десинхронизации дыхания больного с аппаратом ИВЛ. Функция дыхательных мышц может быть также снижена вследствие болезни, бездействия, использования релаксантов и глюкокортикоидов, недостаточного питания, гипоксии и нарушения электролитного баланса. Усталость дыхательной мускулатуры клинически проявляется тахипноэ, парадоксальным дыханием и, наконец, увеличением СО2. Поскольку максимальное инспираторное давление (МИП) является хорошим индикатором функциональных возможностей дыхательной мускулатуры, снижение МИП может указывать на утомление дыхательных мышц. Чтобы его избежать, мышцам необходимо доставить соответствующее количество О2 и питательных инградиентов. Это требует как адекватной тканевой перфузии (сердечный выброс), так и содержания достаточного О2 (SaO2) в артериальной крови. При неадекватной калорийной поддержке, слабость дыхательной мускулатуры может быть связана с катаболизмом протеина дыхательных мышц. Если развилась усталость, дыхательной мускулатуре необходимо дать отдохнуть. Для этого может потребоваться до 24 ч и более. Отдых дыхательной мускулатуры обычно обеспечивается с помощью режимов АssistСMV или SIMV с частотой, достаточной для устранения необходимости спонтанного дыхания. Если усталость дыхательной мускулатуры развивается вследствие чрезмерной нагрузки, эта нагрузка должна быть уменьшена до очередной попытки перевода на спонтанное дыхание. Производительность дыхательной мускулатуры можно улучшить путем тренировок как на силу, так и на выносливость. Низкий дыхательный объем стимулирует тренировку силы путем развития увеличенных сакромер. Работа, при которой сочетаются низкое напряжение и большой дыхательный объем, стимулирует развитие выносливости путем увеличения плотности митохондрий. Спонтанное дыхание в режиме SIMV способствует поддержанию мышечной силы дыхательной мускулатуры, дыхание в режиме РS -тренировке выносливости. При оценке адекватности легочной функции обращают внимание на механические и нейромышечные возможности дыхательной системы, а также способность легких к адекватной оксигенации артериальной крови (несоответствие вентиляции и перфузии, нарушение диффузии или развитие шунта). Некоторые из параметров, которые могут помочь оценить возможность отлучения от респиратора, представлены в таблице 6.5. Таблица 6.5 Физиологические параметры, используемые для оценки возможности отлучения от респиратора
Судя по представленным критериям, спонтанный дыхательный объем, по крайней мере, не менее 5 мл/кг, с частотой дыхания менее 30 раз в минуту считается приемлемым для отлучения от аппарата ИВЛ. Больные, которым требуется вентиляция более чем 10 л/мин, обеспечить такую вентиляцию без утомления дыхательных мышц не могут. Одним из критериев успеха перевода на самостоятельное дыхание является значение инспираторного индекса. Этот индекс высчитывается путем деления частоты дыхания на дыхательный объем в литрах. Быстрое повышение значения индекса >100 после перевода на самостоятельное дыхание свидетельствует о сомнительном успехе. При значении индекса менее 100 вероятность удачного перевода на спонтанное дыхание высока. Максимальное инспираторное давление более 20 см Н2О предполагает адекватную мышечную силу. Однако если больной имеет высокий импеданс (большое сопротивление и низкий комплайнс), это давление может быть недостаточным, чтобы предотвратить мышечное переутомление. Жизненная емкость легких является более приемлемым индикатором респираторного резерва, чем дыхательный объем. Особенно этот показатель информативен у больных с нейромышечной патологией (миастения или болезнь Гийена-Барре). Жизненная емкость должна быть более 15 мл/кг, чтобы больной мог сделать глубокий вдох для расправления ателектазов и обеспечить эффективный кашель. Объем форсированного выдоха за 1 с (FEV1) у больных с ХОЗЛ - весьма полезный показатель возможности их перевода на самостоятельное дыхание. Жизненная емкость у них может быть нормальной при медленном выдохе. Однако при быстром выдохе иногда развивается коллапс воздухопроводящих путей (эффект экспираторного закрытия дыхательных путей). При FEV1 больше 10 мл /кг успешное отлучение от механической вентиляции является более вероятным. У интубированных больных этот показатель оценить трудно, так как на него влияет сопротивление эндотрахеальной трубки. Максимальная произвольная вентиляция хотя и критикуется за зависимость от усилия и желания больного, этот тест достаточно объективно характеризует его вентиляционный резерв. Как правило, больные могут быть отлучены от респиратора, если спонтанная вентиляция в покое меньше 10 л/мин, и больной может ее удвоить (MVV). Альвеоло-артериальная разница менее 300 мм рт. ст. или более 300 мм рт. ст. при 100% кислороде свидетельствует о достаточности легочной оксигенации, чтобы приступить к отлучению от аппарата ИВЛ. Если РаО2 составляет 60 мм рт ст. при FiO2 < 0,4, оксигенация у больного считается удовлетворительной. У послеоперационных больных способность поддержать артериальную сатурацию гемоглобина более 90 % при дыхании комнатным воздухом или в режиме СРАР с давлением менее 5 см Н2О также является маркером для проведения успешной экстубации. Выраженный интрапульмональный шунт нарушает процесс оксигенации крови. Если он более 20 %, то отлучением заниматься не следует. Частыми причинами шунтирования у больных, которым проводится ИВЛ, являются задержка секрета, бронхиолоспазм, отек легких, пневмония. Эти состояния могут корригироваться путем аспирации, использования бронходилятаторов, физиотерапии и постурального дренирования, применением диуретиков и антибиотиков. При инициировании отлучения больного от респиратора VD/VT должно быть менее 0,55. Иногда полезно измерить продукцию СО2 и потребление О2, чтобы оценить возможность прекращения ИВЛ. Увеличение этих показателей подразумевает гиперметаболизм, что требует повышения вентиляции. Методы перевода больных на самостоятельное дыхание. Для отлучения от аппарата может быть использован один или комбинация нескольких методов: IMV, SIMV и PSV. Многие клиницисты предпочитают использовать PSV в комбинации с SIMV. Во многом выбор метода прекращения респираторной поддержки зависит от персональных пристрастий и традиций медицинского коллектива. Психологическая подготовка является важной и должна быть проведена до отсоединения больного от респиратора. Перед каждым сеансом тренировки и оценки возможности отлучения врач должен объяснить весь этот процесс пациенту. Больной должен быть уверен, что за ним будет обеспечен постоянный контроль и при необходимости восстановлен прежний уровень респираторной поддержки. Необходимо частое ободрение, поскольку удачное отлучение от искусственной вентиляции во многом зависит от желания и усилий больного. Психологическая поддержка особенно важна в случае проведения длительной ИВЛ. Во время процедуры перехода на спонтанное дыхание возможно возвращение на более высокий уровень респираторной поддержки, поэтому больной и персонал должны быть психологически готовы к этому. Не следует доводить тренировку самостоятельного дыхания до переутомления дыхательной мускулатуры, необходимо обеспечивать периоды полноценного отдыха. В таблице 6.6 представлены показатели и их значения, при которых необходимо прерывать процесс перевода на спонтанное дыхание. Таблица 6.6 Признаки необходимости прерывания процесса перевода на спонтанное дыхание
Отлучение от ИВЛ с использованием SIMV режима. Использование SIMV включает уменьшение количества аппаратных вдохов, в то же время позволяя больному наращивать активность самостоятельного дыхания. Если пациент показывает признаки усталости, необходимо увеличить количество принудительных вдохов. В начальном периоде вообще возможен возврат к полной аппаратной поддержке для обеспечения полноценного отдыха. Преимуществом этого способа является его удобство. Простое изменение аппаратной частоты дыхания увеличивает или уменьшает нагрузку на больного. При этом гарантируется безопасность, поскольку используется какой-то минимум аппаратного дыхания. На некоторых вентиляторах, кроме того, имеется еще запасной режим (back-up). Постепенно снижая частоту аппаратных вдохов, можно определить оптимальный для больного уровень РСО2. Отлучение от респиратора с помощью вентиляции с поддержкой давлением. Применение этого режима возможно в двух вариантах. Один из них предусматривает выбор такого уровня давления поддержки, который обеспечивает целевой дыхательный объем и частоту дыхания. Затем осуществляется его пошаговое уменьшение. Второй подход состоит из использования комбинации SIMV и PSV. При этом больной тренирует самостоятельное дыхание путем уменьшения аппаратных вдохов, а низкий уровень давления PSV облегчает работу дыхания, связанную с преодолением сопротивления эндотрахеальной трубки и дыхательного контура. Комбинация SIMV и PSV лучше обеспечивает тренировку выносливости, чем каждый из этих режимов по отдельности. Кроме того, она позволяет более разнообразно подходить к разработке программы перевода на самостоятельное дыхание, начиная либо с уменьшения количества принудительных вдохов, либо, наоборот, со снижения давления поддержки. Подбор требуемого уровня PSV осуществляется индивидуально. Слишком высокое давление приводит к чересчур маленькой работе больного. С другой стороны, слишком низкий уровень поддержки может привести к быстрой усталости дыхательных мышц. 6.1.6. Осложнения искусственной вентиляции легкихОсложнения ИВЛ могут проявиться со стороны дыхательных путей (отек гортани, травма слизистой трахеи, трахеобронхиты, потеря увлажняющей функции верхних дыхательных путей), легких (ателектаз, баротравма, токсическое действие кислорода, назокомиальная пневмония), сердечно-сосудистой (уменьшение венозного возврата и сердечного выброса, гипотензия) и других систем (повышение внутричерепного давления, снижение темпа диуреза, нарушение КОС и пр.). Возможны чисто технические проблемы (случайная разгерметизация контура, прекращение электропитания, потеря давления газа, нарушение проходимости трубок и канюль и пр.), которые при несвоевременном их распознавании создают угрозу для жизни больного. Поэтому проведение ИВЛ в обязательном порядке должно сопровождаться тщательным мониторингом, а также применением комплекса мер по предотвращению их развития. В частности, при проведении инвазивной ИВЛ чрезвычайно важно обеспечить увлажнение газа, поступающего в дыхательные пути больного, что уменьшит повреждающее воздействие ее на дыхательные пути и легкие. Для того чтобы не допустить фальных последствий при внезапной поломке оборудования, необходимо иметь дыхательные мешки для ручной вентиляции у каждой койки больного, которому проводится ИВЛ. Баротравма (пневмоторакс, пневмомедиастинум, подкожная эмфизема) может быть результатом чрезмерного давления в дыхательных путях и перерастяжения альвеол большим объемом. Чтобы избежать ятрогенного повреждения легких, пиковое альвеолярное давление (давление плато) не должно превышать 35 см Н2О. Для уменьшения токсического действия кислорода не следует без крайней необходимости применять высокие его концентрации в подаваемой газовой смеси. Безопасным считается уровень FiO2 ниже 0,6. | |||||||||||||||||||||||||||||||||||||||||||||||||||
