лабораторная работа по химии. Сульфаниловая кислота_3e09862ce99514a56eda551c3b00c208. Синтез сульфаниловой кислоты
 Скачать 148 Kb. Скачать 148 Kb.
|
  Лабораторная работа Синтез сульфаниловой кислоты I. Теоретические основы сульфонированияСульфоновые кислоты RSO3H (сульфокислоты) имеют важное промышленное значение. Их натриевые соли RSO3Na широко применяются в качестве моющих средств (детергентов). В основном в качестве моющих средств используются алкиларенсульфонаты натрия C9-15H19-31-С6H4-SO3Na. Важным их преимуществом перед солями жирных кислот, которые используются в обычных мылах, является то, что их кальциевые и магниевые соли лучше растворимы в воде и при использовании жесткой воды сульфонаты не образуют хлопьев. Сульфоновые группы часто вводятся в молекулы органических соединений для повышения их растворимости в воде, что имеет важное значение в промышленности красителей и лекарственных препаратов. Сульфоновые кислоты обычно получают прямым сульфонированием аренов. В качестве сульфонирующего реагента используют концентрированную серную кислоту и дымящую серную кислоту – раствор оксида серы (VI) в серной кислоте, который получил название «олеум». Сульфонирование можно проводить и с помощью индивидуального оксида серы (VI). Сульфонирование относится к процессам электрофильного замещения в аренах. Считают, что активными электрофильными частицами являются оксид серы(VI) (триоксид серы, серный ангидрид) и бисульфониевый или гидросульфониевый катион. Предложены следующие схемы их образования в серной кислоте: 2H2SO4 3H2SO4 Электрофил атакует бензольное кольцо, при этом сначала образуется π-комплекс, затем σ-комплекс, и, наконец, происходит отрыв протона с образованием продукта реакции: 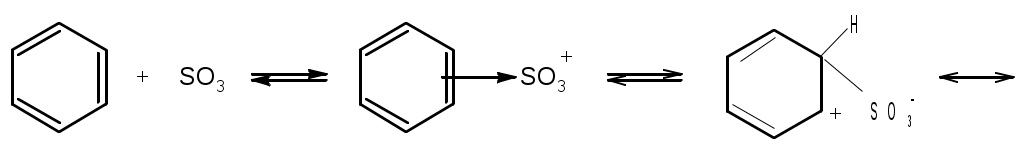 π-комплекс 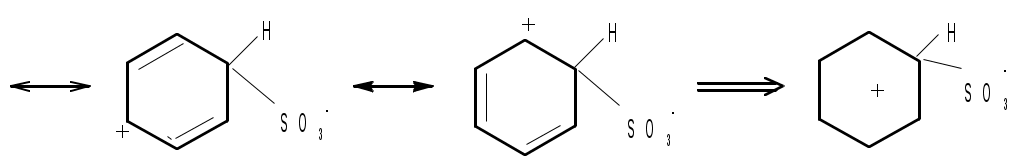 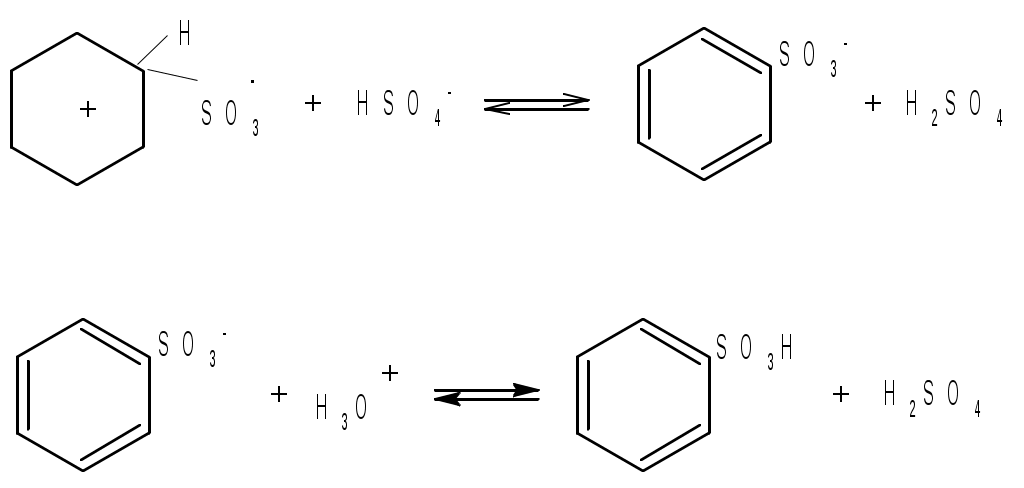 . .Важной отличительной особенностью реакции сульфонирования аренов является ее обратимость. Обратный процесс называется десульфонированием и часто используется в органическом синтезе для удаления сульфонoвой группы. При сульфонировании бензола чаще всего для смещения равновесия вправо образующуюся воду удаляют в виде азеотропа с бензолом. Сульфонирование бензола проводят иногда избытком серной кислоты и даже дымящей серной кислотой, то есть олеумом (раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4). Обратимость сульфонирования связана с взаимным превращением кинетически и термодинамически контролируемых изомеров в зависимости от условий реакции. Так, при сульфонировании нафталина при 800С преимущественно образуется нафталинсульфоновая-1 кислота – кинетически контролируемый продукт, а при 1600С – нафталинсульфоновая-2 кислота – термодинамически контролируемый продукт. Однако, если реакционную смесь, сульфонированнную при 800С, нагревать при 1600С, то основным продуктом реакции является нафталинсульфоновая-2 кислота: 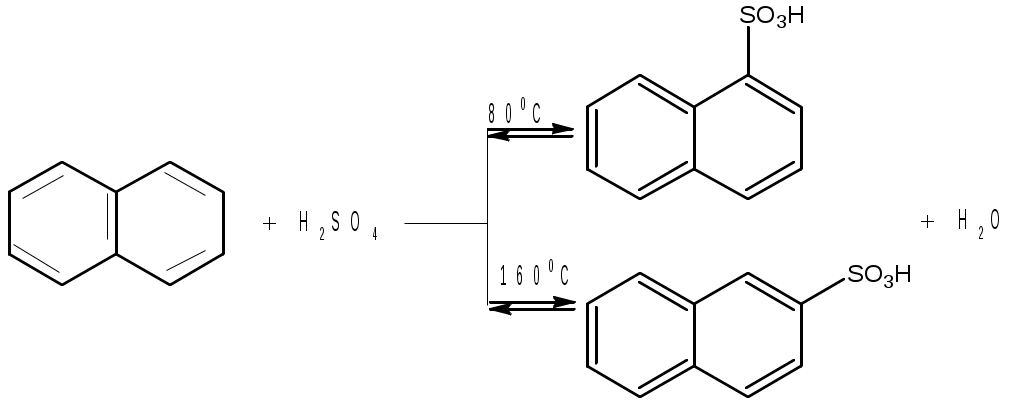 . .То же самое имеет место в случае сульфонирования фенолов концентрированной серной кислотой: 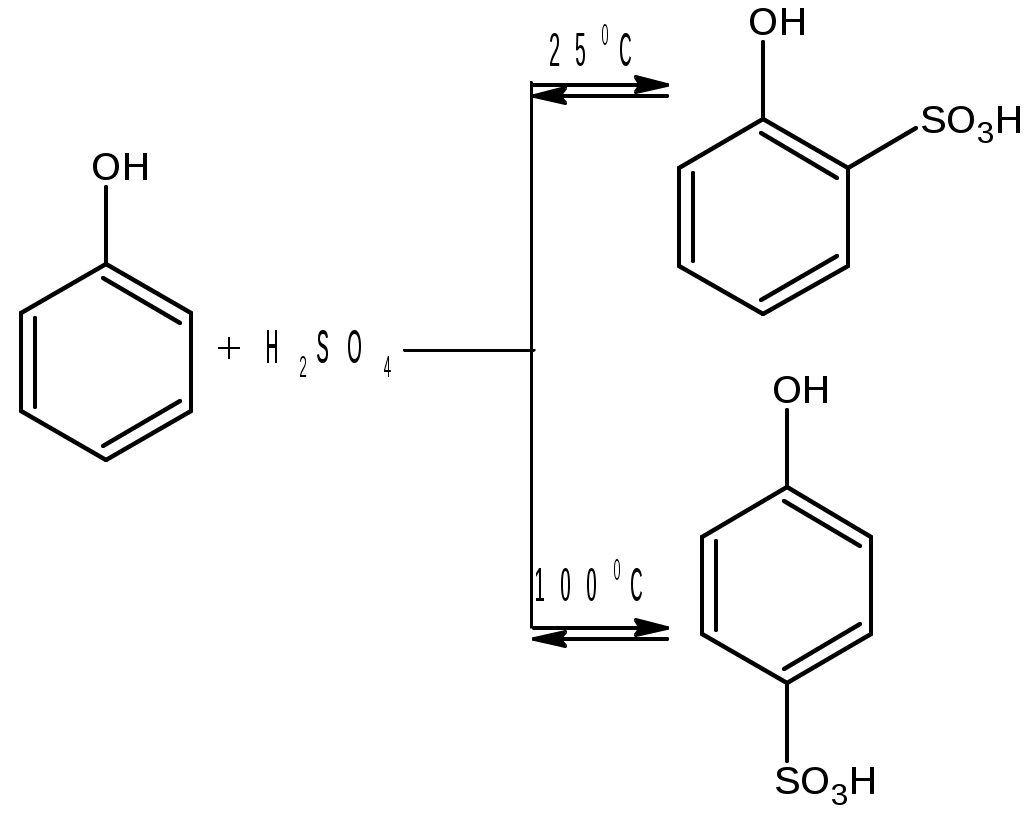 . .При сульфонировании толуола концентрированной кислотой при 00С соотношение орто- (о-) и пара- (п-) изомеров толуолсульфоновой кислоты составляет соответственно 43 и 53 %, а при 1000С – 13 и 79 %, соответственно. Наличие донорного заместителя облегчает сульфонирование, и оно преимущественно происходит в о- и п-положениях. Соотношение изомеров зависит от температуры реакции, как это было показано выше. Если бензол сульфонируется при 60-800С, то толуол и фенол сульфонируются уже при 0-250С. А вот для введения второй сульфоновой группы требуются жесткие условия. При этом образуется мета- (м-) изомер – бензолдисульфонoвая-1,3 кислота: 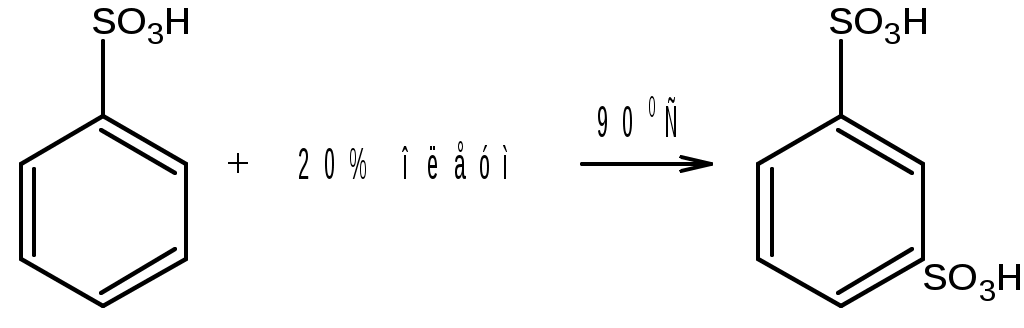 . .Так как сульфоновые кислоты обычно представляют собой вязкие жидкости, их чаще всего выделяют из реакционной смеси в виде солей кальция, бария или натрия. Важное значение для синтеза красителей имеет сульфонирование ароматических аминов. При этом получают важнейшие полупродукты – ароматические аминоарен-сульфонаты. Сульфонирование аренаминов проводят при высокой температуре. При этих условиях вода удаляется испарением (сульфонирование спеканием). Один из важнейших представителей аминоаренсульфоновых кислот – сульфаниловую или 4-аминобензолсульфоновую кислоту получают из анилина и серной кислоты. Реагенты имеют противоположную химическую природу: амины – основания, сульфонирующий реагент – кислота. Поэтому, при обработке анилина серной кислотой он, как и все амины, дает соль – сульфат анилина. 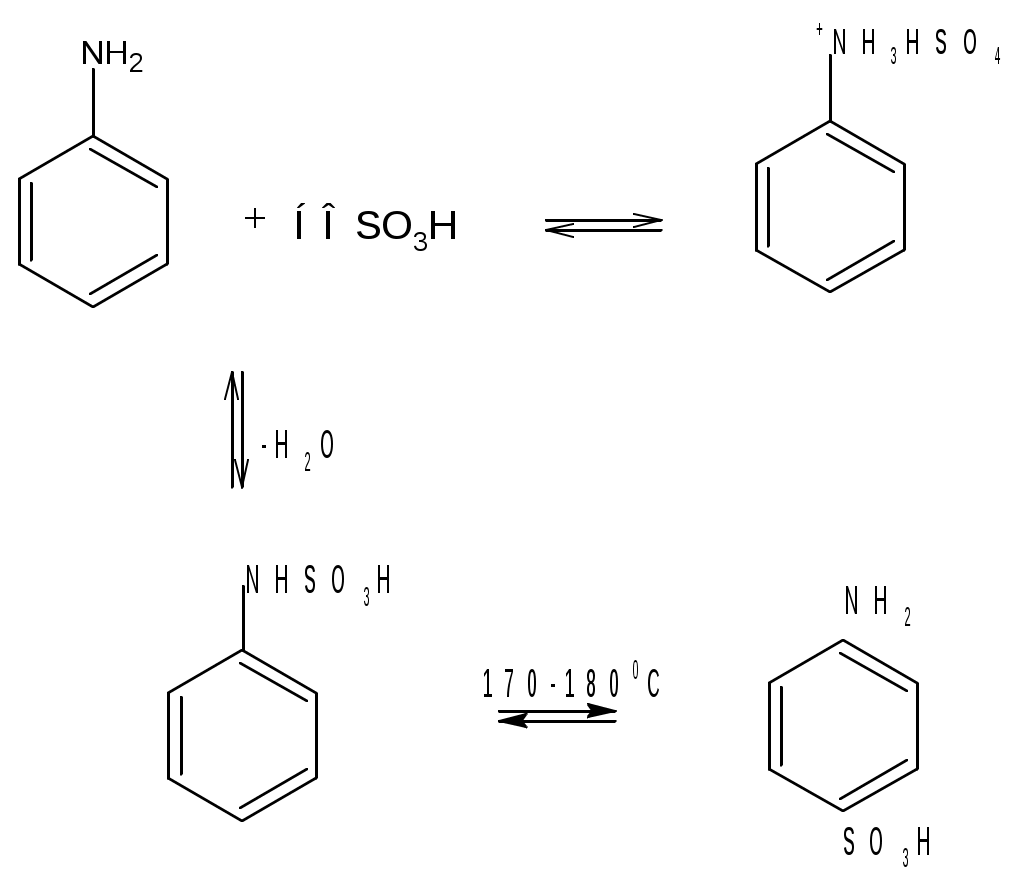 Преимущественное направление сульфонирования определяется температурой реакции. При температуре около 1000С образуется, в основном о-изомер (ортаниловая кислота); при повышении температуры до 180-1900С главным продуктом реакции становится п-изомер (сульфаниловая кислота). Очевидно, такой результат можно объяснить обратимостью реакции сульфонирования, большей скоростью образования ортаниловой кислоты (кинетический контроль) и большей термодинамической устойчивостью сульфаниловой кислоты. Соль находится в равновесии с исходными анилином и серной кислотой, которые при нагревании взаимодействуют по схеме N-сульфонирования по ядру. Фениламино-сульфоновая кислота при высокой температуре превращается в продукт С-сульфо-нирования по ядру. Свойства сульфаниловой кислоты (п-аминобензолсульфокислоты или 4-аминобензолсульфоновой кислоты), на первый взгляд, совершенно не соответствуют свойствам соединения, содержащего свободные амино- и сульфоновую группы. Так, ароматические амины и ароматические сульфоновые кислоты имеют низкие температуры плавления. Температура плавления сульфаниловой кислоты настолько высока, что при нагревании выше 2800С кислота разлагается прежде, чем начинает плавиться. Сульфоновые кислоты, как уже упоминалось, хорошо растворимы в воде, в то время, как растворимость сульфаниловой кислоты в воде незначительна. Эти противоречия становятся понятны, если предположить, что в сульфаниловой кислоте, где в бензольном кольце присутствуют противоположные по химической природе амино- и сульфоновая группы, протон сульфоновой группы переходит к азоту аминогруппы. В результате образуется диполярный ион – 4-сульфонатобензоламмоний: 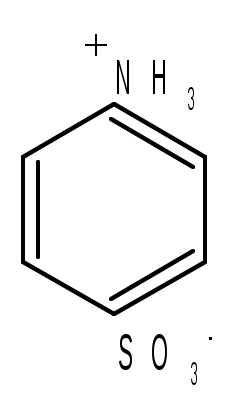 II. Учебные вопросыЧто получается при смешении серной кислоты с анилином? Реакция сульфонирования обратима.Что способствует смещению равновесия в сторону образования продуктов реакции? Что произойдет, если температура реакции будет выше 1900? Как определить окончание реакции при “мокром” способе синтеза? До каких пор ведут реакцию при “сухом” способе синтеза? Из какого растворителя и почему перекристаллизовывают сульфаниловую кислоту? В каких случаях и зачем при очистке раствор сульфаниловой кислоты кипятят с активированным углем? ІІІ. Уравнения реакций Основная реакция: 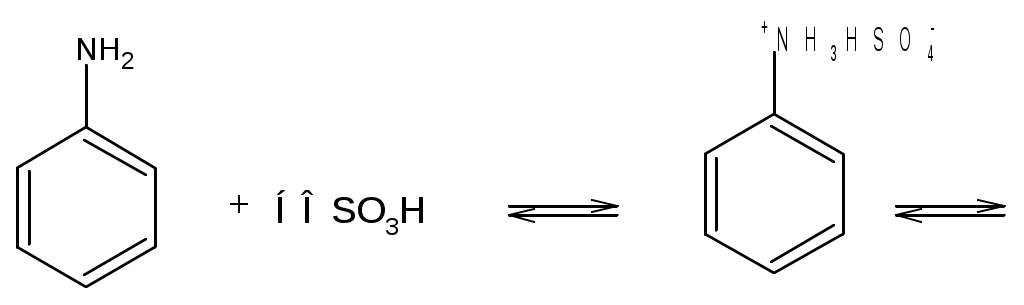 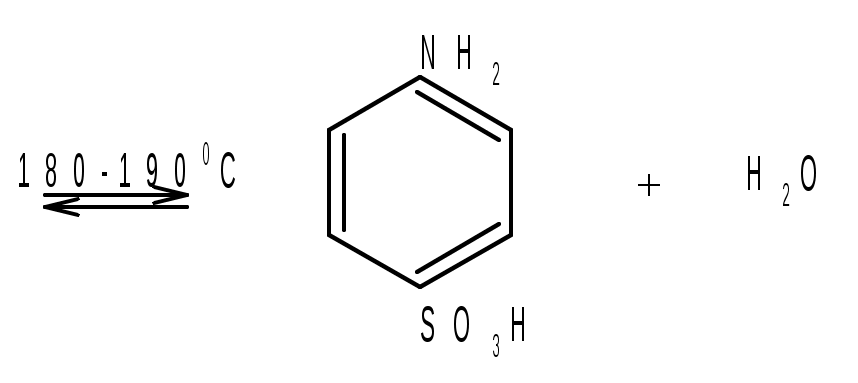 Реактивы:
Таблица физико-химических констант исходных веществ и полученных соединений (составляется по данным “Справочника химика”).VI. Составление расчетной таблицы (по заданию преподавателя).VII. Схемы приборов и установок  Рис.1.1- фарфоровая чашка, Рис.2. 1-реакционная колба, 2-асбестовый кружок, 2-асбестовый кружок, 3-термометр. 3-термометр. VIII. Примечания и меры предосторожности Анилин и серную кислоту необходимо смешивать в вытяжном шкафу осторожно, небольшими порциями! Избегайте попадания серной кислоты и анилина на кожу!При попадании анилина на кожу немедленно промыть с мылом! При нагревании смеси тщательно следите за температурой, избегайте перегрева! IX. Методика проведения синтеза. 1-ый метод_(“сухой”) В фарфоровой ступке осторожно смешивают 9,3 г анилина и 5,6 мл серной кислоты. Смесь тщательно растирают до образования сухого порошка. Полученную соль переносят в фарфоровую чашку (Рис.1), устанавливают термометр так, чтобы его шарик находился в реакционной массе. Смесь нагревают на воздушной бане при температуре 180-1850С до тех пор, пока масса не станет сухой и твердой. После этого нужно прекратить нагревание, подождать, пока чашка охладится, перенести твердую массу в фарфоровую ступку с помощью шпателя и растереть до порошка. 2-ой метод_(“мокрый”) В сухой колбе емкостью 50 мл к 10 мл анилина при перемешивании небольшими порциями осторожно прибавляют 18 мл серной кислоты. В колбу устанавливают термометр так, чтобы его шарик находился в реакционной массе и не касался дна колбы (Рис.2). Смесь нагревают на сетке при 180-1900С в течение нескольких часов до тех пор, пока разбавленная водная проба, при прибавлении раствора NaOH перестанет пахнуть анилином. Выделение полученного продукта Несколько охлажденную смесь выливают при перемешивании стеклянной палочкой в стакан со 150 мл холодной воды. Стакан охлаждают в бане с холодной водой, периодически помешивая смесь. После того, как кристаллизация закончилась, кристаллы отделяют от раствора с помощью прибора для вакуумного фильтрования и оставляют сушить. X. Очистка полученного продукта. Полученную сульфаниловую кислоту очищают методом перекристаллизации из 200-250 мл воды (см. лабораторную работу Перекристаллизация). XI. Оценка чистоты синтезированной сульфаниловой кислотыСтруктура сульфаниловой кислоты подтверждается данными ПМР-спектра. Протоны бензольного кольца характеризуются резонансным квартетом. Каждый протон представлен двумя сигналами. Химический сдвиг определяется как центр дублета δН1=6,8 м.д., δН2=7,8 м.д. Расщепление на два сигнала определяется спин-спиновым взаимодействием протонов Н1 и Н2 с константой спин-спинового взаимодействия JНН = 8 Гц. Протонам группы NH2 соответствует резонансный сигнал δ=6,3 м.д., гидроксильному протону δ=14 м.д. Интегральные интенсивности резонансных сигналов соответствуют числу атомов водорода в в указанных функциональных группах.XII. Определение выхода продукта. Определяют массу полученной сульфаниловой кислоты и рассчитывают выход в % от теоретического. XIII. Вопросы по теоретическим основам работыКакой основной метод получения сульфоновых кислот? Приведите механизмы реакций сульфонирования толуола, нафталина и фенола серной кислотой. Кинетический и термодинамический контроль продуктов реакции. Почему в реакции сульфанирования концентрация серной кислоты должна быть не меньше 65%? Региоселективность реакции сульфонирования. Приведите механизм реакции сульфонирования этилбензола оксидом серы (VI). Каким образом равновесие в реакции сульфонирования смещают в сторону образования продуктов реакции? Каковы особенности сульфонирования анилина серной кислотой? Почему аминогруппа в сульфаниловой кислоте не проявляет основных свойств? Почему сульфаниловая кислота плохо растворяется в воде? |
