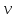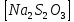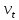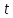лр 4 по химии. Скорость химических реакций
 Скачать 55.19 Kb. Скачать 55.19 Kb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №4 по дисциплине «Химия» Тема: Скорость химических реакций
Санкт-Петербург 2021 Цель работы: изучение влияния концентрации реагирующих веществ и температуры на скорость гомогенной химической реакции. Основные теоретические положения Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени. 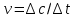 – изменение концентрации за единицу времени. – изменение концентрации за единицу времени.Скорость химической реакции зависит от природы реагирующих веществ, их концентрации и температуры. Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. 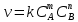 (для реакции (для реакции 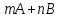 ), ), 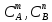 – концентрация веществ участвующих в реакции. – концентрация веществ участвующих в реакции.Константой скорости химической реакции называется скорость химической реакции когда концентрация веществ равна 1 моль/л, и она зависит от природы реагирующих веществ, температуры и присутствия катализатора. Скорость химической реакции зависит от температуры и описывается правилом Вант-Гоффа: повышение температуры на каждые 10° увеличивает скорость реакции в 2-4 раза. 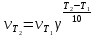 , , 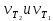 – скорости реакции при температурах – скорости реакции при температурах 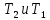 , γ – температурный коэффициент скорости реакции. , γ – температурный коэффициент скорости реакции.Физический смысл температурного коэффициента γ – он показывает во сколько раз увеличивается скорость химической реакции при увеличении температуры на 10° или, если температура увеличилась на n*10° то скорость химической реакции увеличилась на γn. Зависимость константы скорости от температуры описывается основным законом химической кинетики – уравнением Аррениуса: 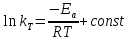 , где , где 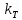 – константа скорости реакции при температуре – константа скорости реакции при температуре 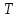 , , 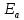 – энергия активации, – энергия активации, 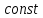 – константа интегрирования. – константа интегрирования.Энергия активации химической реакции – это минимальная энергия (в расчете на 1 моль), которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к реакции. Энергия активации химической реакции зависит от природы реагирующих веществ и не зависит от температуры. В лабораторной работе для исследования зависимости скорости реакции от концентрации и температуры используется реакция взаимодействия серной кислоты ( 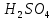 ) и тиосульфата натрия ( ) и тиосульфата натрия (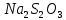 ). Эта реакция протекает в две стадии: ). Эта реакция протекает в две стадии: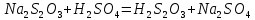 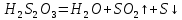 Скорость всей реакции определяется скоростью второй стадии: 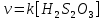 Поскольку концентрация 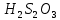 в растворе прямо пропорциональна в растворе прямо пропорциональна концентрации 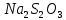 , скорость реакции можно рассматривать как: , скорость реакции можно рассматривать как: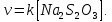 Обработка результатов 1. Зависимость скорости химической реакции от концентрации 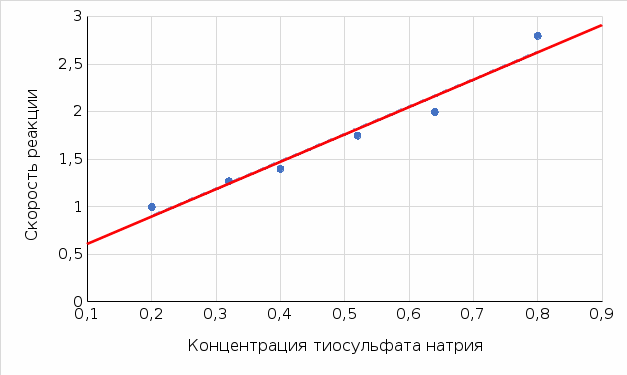 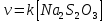
2. Зависимость скорости химической реакции от температуры 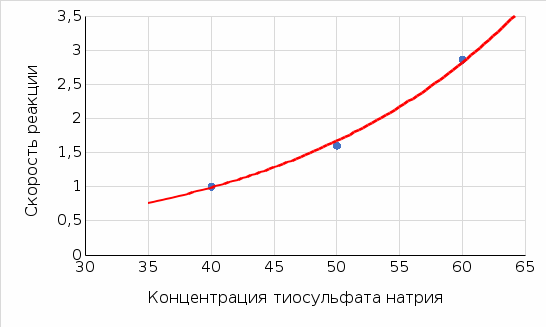 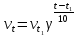
На основании правила Вант-Гоффа: 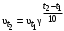 , выразите и рассчитайте температурный коэффициент γ для трех пар: , выразите и рассчитайте температурный коэффициент γ для трех пар: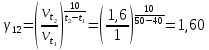 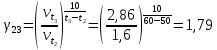 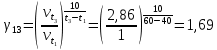 На основании формулы 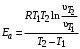 рассчитайте энергию активации реакции для трех пар температур. рассчитайте энергию активации реакции для трех пар температур.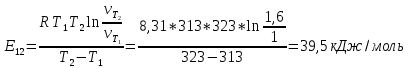 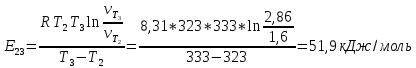 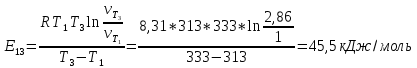 Выводы: скорость химической реакции линейно зависит от концентрации 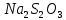 , так же зависит от температуры опыта которое описано правилом Вант-Гоффа. Правило Вант-Гоффа не соблюдается так, как полученный в результате эксперимента коэффициент немного меньше теоретического значения ( , так же зависит от температуры опыта которое описано правилом Вант-Гоффа. Правило Вант-Гоффа не соблюдается так, как полученный в результате эксперимента коэффициент немного меньше теоретического значения (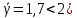 , так как в ходе эксперимента на полученные данные влияли некоторые факторы, например, не идеальность человеческого глаза, задержка в остановке секундомера и т.д. , так как в ходе эксперимента на полученные данные влияли некоторые факторы, например, не идеальность человеческого глаза, задержка в остановке секундомера и т.д. |