жвапваавп. Скорость химических реакций
 Скачать 32.26 Kb. Скачать 32.26 Kb.
|
|
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Ижевский государственный технический университет имени М.Т. Калашникова» (ФГБОУ ВО «ИжГТУ имени М.Т. Калашникова») Факультет «Химия и химическая технология» Институт строительства и архитектуры имени В.А. Шумилова Лабораторная работа №2 «Скорость химических реакций» Выполнил: Студент группы Б20-500-3 Е.А. Бушмелева Проверил: к.т.н., доцент ХиХТ Н.В.Семакина Ижевск 2020 «Скорость химических реакций» Цель работы: Научиться экспериментально определять скорость химических реакций и оценивать влияние различных факторов на характер их протекания. Теоретическая часть 1. Скорость химических реакций - изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. 2. Закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. V = k · CAa · CBb 3. Правило Вант-Гоффа: при повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза Экспериментальная часть Опыт 1 Влияние концентрации на скорость химических реакций Влияние концентрации на скорость изучаем на реакции взаимодействия тиосульфата натрия и серной кислоты: Na S O + H SO = Na SO + SO +S + H O Порядок выполнения опыта Внесла в пробирку 5 капель р-ра Na S O и 3 капли р-ра H SO . Выделившаяся сера делает р-р мутным. Для проведения опыта приготовила в 3 пробирках равные объемы р-ров различной концентрации. По секундомеру определила время с момента добавления капли кислоты до помутнения р-ра в пробирке №1. Опыт повторила поочередно с пробирками 2 и 3. Данные опыта занесла в таблицу. Таблица экспериментальных и расчетных данных
По полученным данным построила график зависимости скорости реакции от концентрации тиосульфата натрия. Для этого на оси абсцисс отложила в определенном масштабе относительные концентрации тиосульфата натрия, а на оси ординат – скорость в условных единицах. Вывод: Чем больше концентрация раствора, тем выше скорость протекающей реакции. Опыт 2 Влияние температуры на скорость химической реакции Влияние температуры на скорость изучаем на реакции взаимодействия тиосульфата натрия и серной кислоты: 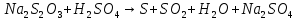 Порядок выполнения опыта В трех пробирках приготовила р-р Na S O одинаковой концентрации путем добавления в каждую 4-х капель р-ра Na S O и 8 капель H O По секундомеру определила время с момента добавления капли кислоты до помутнения р-ра в пробирке №1(взяла данные, полученные в №1). В стакане нагрела воду до температуры на 10 С выше комнатной и поместила туда пробирку №2, дала р-ру прогреться и, не вынимая из него пробирку, определила время с момента добавления капли кислоты до помутнения р-ра. Повторила опыт в пробирке №3, предварительно нагрев в стакане до температуры на 10 С выше, чем в предыдущем случае. Данные опыта записала в таблицу. Таблица экспериментальных и расчетных данных
По полученным данным построила график зависимости скорости реакции от температуры и вычислила температурный коэффициент реакции. Вывод: При повышении температуры на 10 С скорость реакции увеличивается примерно в 2 раза, опираясь на правило Вант-Гоффа. Погрешность измерений связана с неточностью снятых временных показателей. | |||||||||||||||||||||||||||||||||||||||||||||||||||
