Тема 1. Некоторые теоретические принципы органической химии.. Соединения с двухвалентным углеродом (карбены)
 Скачать 96.64 Kb. Скачать 96.64 Kb.
|
|
Соединения с двухвалентным углеродом (карбены) В последние годы большое внимание привлекают так называемые карбены— производные свободного метилена и его гомологов. Сам свободный метилен по своим свойствам и продолжительности жизни (0,005 сек) мало отличается от свободного метила. На основании приближенных квантовомеханических расчетов можно считать, что метилен имеет два неспаренных электрона, т. е. представляет собою настоящий бирадикал: Свободный метилен может получаться при пиролизе углеводородов, а еще лучше при пиролизе кетена, при фотохимическом распаде (фотолизе) диазометана и др. Как промежуточное соединение он возникает при каталитическом восстановлении окиси углерода и в ряде других случаев. Несмотря на малую продолжительность жизни, этот бирадикал играет важную роль во многих реакциях, например в реакции Фишера—Тропша, при действии диазометана на двойную связь и др. В отсутствие других реакционноспособных веществ метилен димеризуется в этилен или полимеризуется в твердые полиметилены. Свободный этилиден СН3—СН еще менее стоек, чем метилен, так как он очень легко перегруппировывается в этилен: Более прочными оказываются дигалокарбены, которые легко могут быть получены из хлороформа и других галоформов щелочным гидролизом. Например, хлороформ образует в этих условиях неустойчивый анион распадающийся с образованием дихлоркарбена: Дигалокарбены легко вступают в реакции с нуклеофильными реагентами. Особый интерес представляет реакциядигалокарбенов с двойной связью, приводящая к препаративному получению соединений с трехчленным циклом например: 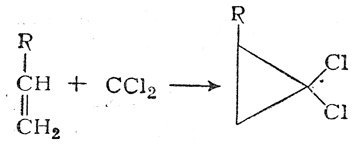 При действии на образовавшиеся циклопропаны натрием или магнием можно получить аллены, например: 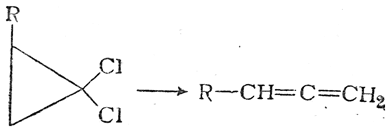 В настоящее время механизмы многих реакций пересматриваются с учетом возможности их протекания через промежуточное образование карбенов. Длины основных типов углерод углеродных связей. Определив экспериментально длину связи, можно предсказать ее кратность и, наоборот, вычислив кратности связей, можно предсказать их длину. 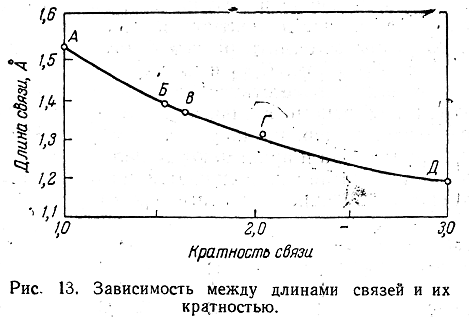 Зависимость между длинами и кратностью связей (вычисленной по методу молекулярных орбит) изображена на рис. 13, где даны точки для этана (А), графита (Б), бензола (В), этилена (Г) и ацетилена (Д). Теория отталкивания электронных пар валентной оболочки (ОЭПВО) — один из подходов в химии, необходимый для объяснения и предсказания геометрии молекул. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально (принцип минимума энергии). Неподеленная электронная пара занимает больший объем, чем пара электронов на орбитали, участвующей в образовании одинарной связи. Сила отталкивания электронных пар в данной валентной оболочке понижается в следующем порядке: неподеленная пара — неподеленная пара (Е — Е) > неподеленная пара — связывающая пара (Е—X) > связывающая пара — связывающая пара (X—X). Это допущение вытекает из таких простых аргументов, как то, что неподеленная электронная пара находится в поле только одного положительного атомного остова и, следовательно, более диффузна, чем связывающая электронная пара, испытывающая сжатие полем зарядов двух атомных остовов. Отсюда следует вывод, что в серии изоэлектронных молекул (то есть содержащих равное число электронных пар в валентной оболочке) неподеленная пара, заменяя связывающую электронную пару, стремится занять больше пространства вокруг атома. Это уменьшает валентные углы между связями, например, в ряду  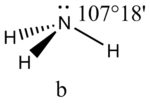 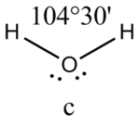 Энергии связей и закономерности ее изменений. 1) Длина связи с участием атома углерода зависит от его гибридизации: при увеличении кратности связи ее длина уменьшается 2) Энергия связи уменьшается с увеличением вклада s-орбиталей в гибридизованное состояние: sp3 (25% s-АО) > sp2 (33,3% s-АО) > sp (50% s-АО) 3) Чем длиннее связь, тем меньше ее энергия (т.е. связь слабее) Гиперконъюгация или сверхсопряжение Эффект, подобный положительному мезомерному, возникает при замещении водорода у кратной связи алкильной группой. Этот эффект направлен в сторону кратной связи и называется гиперконъюгацией (сверхсопряжением): 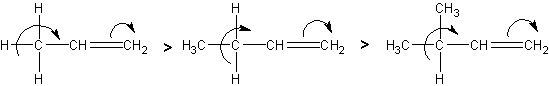 Эффект напоминает положительный мезомерный, поскольку отдает электроны в сопряженную p-систему: 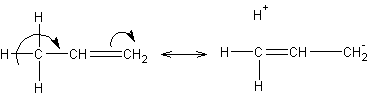 Сверхсопряжение уменьшается в последовательности: СН3 > CH3-CH2 > (CH3)2CH > (CH3)3C. Для проявления эффекта гиперконъюгации необходимо наличие хотя бы одного атома водорода при атоме углерода, соседствующем с p- системой. Трет-бутильная группировка не проявляет этого эффекта, а потому мезомерный эффект ее равен нулю. Уравне́ние Га́ммета — выражение для линейной зависимости свободных энергий, фундаментального принципа физической органической химии[1], утверждающее, что количественные изменения реакционной способности в одной реакции из двух схожих (то есть в которых исходные реагенты различаются только некоторыми заместитителями) коррелируют с количественными изменениями реакционной способности в другой. Открыто в 1935 году Л. Гамметом[2] и Г. Буркхардом[3]. В аналитическом виде оно записывается следующим образом: {\displaystyle \lg {\frac {k_{j}}{k_{0}j}}=\sigma _{j}\rho _{j}} где k — константы скоростей двух реакций для данного заместителя, стандартной и j-й; ρ — параметр чувствительности реакции к смене заместителя; σ — параметр заместителя. Уравнение Гаммета демонстрирует то, что заместители оказывают пропорциональный вклад в ход реакций, в которых проявляются лишь их индуктивный и мезомерный эффекты, но не проявляется стерическое и прочие специфические взаимодействия. Кроме того, параметры заместителей и реакции допускают возможность их сравнения. Так, определение параметра ρ является частым приёмом при изучении механизма реакций[4]. Существует ряд шкал σ-параметров с учётом мезомерного эффекта и без. Уравнение Гаммета лишь частично применимо для процессов, в которых есть существенный вклад резонансного влияния заместителя на реакционный центр соединения. В последнем случае используют уточнённое уравнение Гаммета — Тафта. Классификация органических реакций. В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций: · замещение; C2H6 + Cl2 (на свету)→CH3CH2Cl + HCl хлорирование этана CH3CH2Cl + KOH (водн. р-р) → CH3CH2OH + KCl щелочной гидролиз хлорэтана · присоединение; CH2=CH-CH3 + Br2 →CH2Br-CHBr-CH3 бромирование пропена CH2=CH2 + H2O→CH3CH2OH гидратация этилена К реакциям присоединения относятся также реакции полимеризации: n A → An Например, образование полиэтилена: n CH2=CH2→(-CH2-CH2-) n · отщепление (элиминирование); · отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи) CH3-CH2Cl →CH2=CH2 + HCl · отщепление воды (при нагревании спирта с серной кислотой) CH3-CH2OH→CH2=CH2 + H2O дегидратация этанола · отщепление водорода от алкана (в присутствии катализатора) CH3-CH3 →CH2=CH2 + H2 дегидрирование этана · изомеризация (перегруппировка); 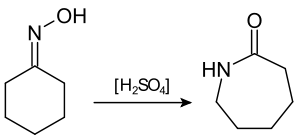 Перегруппировка Бекмана, из оксимов в амиды под действием серной конц. (капролактам) разложение. СН4 → C + 2H2 пиролиз метана (1000 oC) |
