Лабораторная работа по физике Спектр излучения атома. Лаб_раб_10_Спектр_атома. Спектр излучения атома
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
 Министерство образования и науки Российской Федерации Министерство образования и науки Российской Федерации Новосибирский государственный университет экономики и управления – «НИНХ» Кафедра математики и естественных наук Учебная дисциплина: Компьютерные технологии в физике и естествознании Лабораторная работа и ИРГЗ №_10_ на тему: «Спектр излучения атома» Выполнил: Студент: Номер группы: Номер варианта: Проверил: 2021 Знакомство с планетарной и квантовой моделями атома при изучении процессов поглощения и испускания электромагнитного излучения возбужденными атомами водорода. Экспериментальное подтверждение закономерностей формирования линейчатого спектра излучения атома водорода. Экспериментальное определение постоянной Ридберга. Измерения и обработка результатов 1 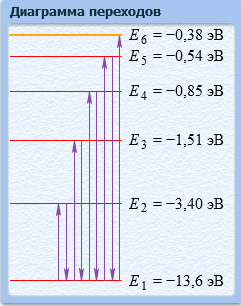 . . 2. Длины волн прямого и обратного переходов совпадают. Изменения энергий для поглощений и испусканий на один и тот же уровень относятся как -1. 3. 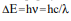 (1) (1)
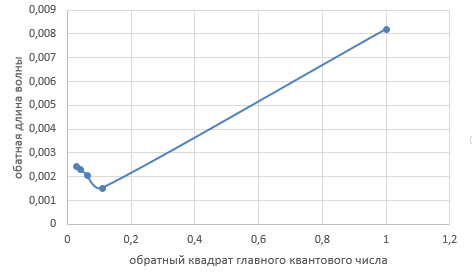
4. 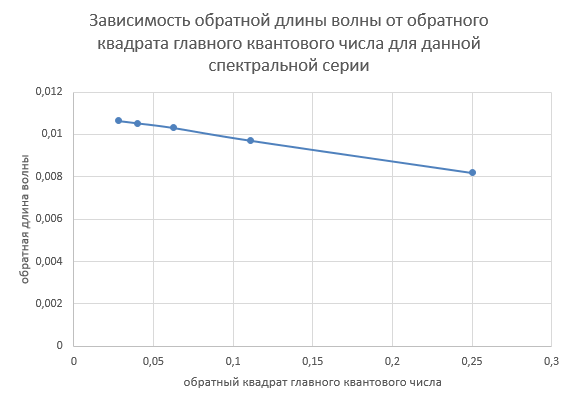 Постоянная Ридберга из графика R=1,0987095* 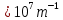 , что включает в себя небольшую погрешность от табличных значений. , что включает в себя небольшую погрешность от табличных значений.5. 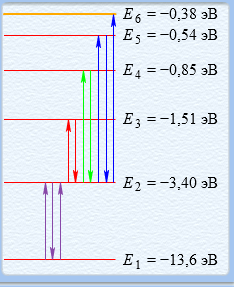 6.
 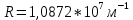 7. 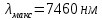 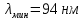 Чем меньше ∆Е, тем больше будет длина волны.  Ответы на контрольные вопросы. СПЕКТРОМ электромагнитного излучения (ЭМИ) называется совокупность электромагнитных волн, которые излучаются или поглощаются атомами (молекулами) данного вещества. ЛИНЕЙЧАТЫЙ спектр состоит из отдельных волновых составляющих, близких к гармоническим волнам и называемых спектральными линиями. Расстояние между линиями (по шкале длин волн или частот) много больше ширины линий. ПОЛОСНОЙ спектр излучают молекулярные газы. СПЛОШНОЙ спектр излучается нагретыми телами. ПЛАНЕТАРНАЯ МОДЕЛЬ атома: в центре атома расположено очень малое положительно заряженное ядро, вокруг которого по определенным (разрешенным) стационарным орбитам движутся электроны, масса которых во много раз меньше массы ядра. При движении по орбите электрон не испускает электромагнитное излучение (ЭМИ). При поглощении ЭМИ (фотона) электрон переходит на более «высокую» разрешенную орбиту, на которой его энергия становится больше на величину ∆ЕЭЛ, равную энергии поглощенного фотона ЕФ. При переходе между разрешенными энергетическими уровнями электрон испускает или поглощает фотон с такой же энергией: ЕФ = |∆ЕЭЛ |. КВАНТОВАЯ модель атома отличается от планетарной в первую очередь тем, что в ней электрон не имеет точно определенной координаты и скорости, поэтому бессмысленно говорить о траектории его движения. Можно определить (и нарисовать) только границы области его преимущественного нахождения (орбитали). ГЛАВНОЕ квантовое число n определяет величину энергии электрона в атоме En = 2 i n E , где Еi- энергия ионизации атома водорода (13.6 эВ). ОРБИТАЛЬНОЕ квантовое число l определяет модуль момента импульса электрона при его орбитальном движении L = ⋅ l(l + 1). Оно принимает целочисленные значения l = 0, 1, 2, ... n-1 . МАГНИТНОЕ квантовое число ml определяет проекцию вектора момента импульса LZ орбитального движения электрона на направление внешнего магнитного поля B . Оно принимает положительные и отрицательные целочисленные значения, которые по модулю меньше или равны l : Lz = ⋅ ml , где ml = 0, ±1, ±2, ... , ±l Спином называется внутреннее движение электрона, классической моделью которого является вращение вокруг своей оси. Этому движению соответствует вектор момента импульса собственного движения (спина), который часто также называют спином. Спиновое квантовое число определяет модуль спина: S = ⋅ s(s + 1). Для электрона s = 2 1 (аналогично, для протона и нейтрона). Для фотона s = 1. ВЫРОЖДЕННЫМИ называются квантовые состояния электрона с одинаковой энергией. КРАТНОСТЬ ВЫРОЖДЕНИЯ равна количеству состояний электрона с одной и той же энергией. КРАТКАЯ запись состояния электрона в атоме: первая - ЦИФРА, равная главному квантовому числу, вторая - БУКВА, определяющая азимутальное квантовое число. Как показатель степени записывается число, равное количеству электронов, обладающих данными главным и азимутальным квантовым числом. Состояние электрона 2d невозможно, т.к. оно соответствует n = 2 и l = 2, что запрещено неравенством l < n. Электрон в атоме может переходить только между состояниями, удовлетворяющему правилу отбора азимутального квантового числа ∆l = ±1. Это связано с законом сохранения момента импульса и с тем, что излучаемый или поглощаемый фотон имеет спиновое квантовое число, равное 1. СПЕКТРАЛЬНОЙ СЕРИЕЙ называется совокупность линий излучения, соответствующих переходу электрона в атоме на один и тот же нижний уровень энергии. Спектральные серии атома водорода: серия Лаймана, серия Бальмера, серия Пашена, серия Брэккета, серия Пфурда, серия Хэмпфри. Водородоподобный атом или ион представляет собой любое атомное ядро, которое имеет один электрон и, следовательно, является изоэлектронным атому водороду. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

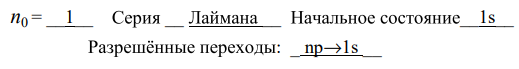

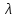
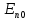 эВ
эВ э эВ
э эВ